Receptor gamma activado por proliferador de peroxisoma - Peroxisome proliferator-activated receptor gamma
El receptor gamma activado por el proliferador de peroxisomas ( PPAR-γ o PPARG ), también conocido como receptor de resistencia a la insulina inversa de glitazona , o NR1C3 (subfamilia 1 del receptor nuclear, grupo C, miembro 3) es un receptor nuclear de tipo II (genes reguladores de proteínas) que en humanos está codificado por el gen PPARG .
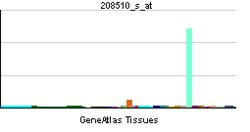
Distribución de tejidos
PPARG está presente principalmente en tejido adiposo , colon y macrófagos. Se detectan dos isoformas de PPARG en el ser humano y en el ratón: PPAR-γ1 (que se encuentra en casi todos los tejidos excepto el músculo) y PPAR-γ2 (que se encuentra principalmente en el tejido adiposo y el intestino).
La expresion genica
Este gen codifica un miembro de la subfamilia de receptores nucleares del receptor activado por proliferador de peroxisoma (PPAR). Los PPAR forman heterodímeros con receptores de retinoides X (RXR) y estos heterodímeros regulan la transcripción de varios genes. Se conocen tres subtipos de PPAR: PPAR-alfa , PPAR-delta y PPAR-gamma. La proteína codificada por este gen es PPAR-gamma y es un regulador de la diferenciación de adipocitos . Alternativamente, se han descrito variantes de transcripciones empalmadas que codifican diferentes isoformas .
La actividad PPARG se puede regular mediante la fosforilación a través de la vía MEK / ERK. Esta modificación disminuye la actividad transcripcional de PPARG y conduce a modificaciones de genes diabéticos y da como resultado insensibilidad a la insulina. Por ejemplo, la fosforilación de la serina 112 inhibirá la función de PPARG y mejorará el potencial adipogénico de los fibroblastos.
Función
PPARG regula el almacenamiento de ácidos grasos y el metabolismo de la glucosa. Los genes activados por PPARG estimulan la captación de lípidos y la adipogénesis por las células grasas. Los ratones knockout de PPARG carecen de tejido adiposo, lo que establece a PPARG como un regulador maestro de la diferenciación de adipocitos .
PPARG aumenta la sensibilidad a la insulina mejorando el almacenamiento de ácidos grasos en las células grasas (reduciendo la lipotoxicidad ), mejorando la liberación de adiponectina de las células grasas, induciendo FGF21 y mejorando la producción de fosfato de dinucleótido de adenina de ácido nicotínico a través de la regulación positiva de la enzima CD38 .
PPARG promueve la activación de macrófagos M2 antiinflamatorios en ratones.
La adiponectina induce el transporte inverso de colesterol mediado por ABCA1 mediante la activación de PPAR-γ y LXRα / β .
Muchos agentes de origen natural se unen directamente con PPAR gamma y lo activan. Estos agentes incluyen varios ácidos grasos poliinsaturados como el ácido araquidónico y los metabolitos del ácido araquidónico, como ciertos miembros de la familia del ácido 5-hidroxiicosatetraenoico y del ácido 5-oxo-eicosatetraenoico , por ejemplo, 5-oxo-15 (S) -HETE y 5-oxo-ETE o Familia del ácido 15-hidroxiicosatetraenoico que incluye 15 ( S ) -HETE, 15 ( R ) -HETE y 15 ( S ) -HpETE. El fitocannabinoide tetrahidrocannabinol (THC), su metabolito THC-COOH y su análogo sintético ácido ajulémico (AJA). La activación de PPAR gamma por estos y otros ligandos puede ser responsable de inhibir el crecimiento de líneas celulares de cáncer de mama, gástrico, pulmón, próstata y otras líneas de células cancerosas humanas cultivadas.
Durante la embriogénesis, PPARG primero se expresa sustancialmente en la almohadilla de grasa marrón interescapular. El agotamiento de PPARG resultará en letalidad embrionaria en E10.5, debido a las anomalías vasculares en la placenta, sin permeación de los vasos sanguíneos fetales y dilatación y ruptura de los senos sanguíneos maternos. La expresión PPARG se puede detectar en la placenta ya en E8.5 y durante el resto de la gestación, localizada principalmente en la célula del trofoblasto primario de la placenta humana. Se requiere PPARG para la diferenciación epitelial del tejido del trofoblasto, que es fundamental para la vascularización adecuada de la placenta. Los agonistas de PPARG inhiben la invasión de citotrofoblasto extravelloso. También se requiere PPARG para la acumulación de gotitas de lípidos en la placenta.
Interacciones
Se ha demostrado que el receptor gamma activado por el proliferador de peroxisomas interactúa con:
Relevancia clínica
PPAR-gamma se ha implicado en la patología de numerosas enfermedades que incluyen obesidad, diabetes, aterosclerosis y cáncer. Los agonistas de PPAR-gamma se han utilizado en el tratamiento de la hiperlipidemia y la hiperglucemia . PPAR-gamma disminuye la respuesta inflamatoria de muchas células cardiovasculares, particularmente las células endoteliales . PPAR-gamma activa el gen PON1 , aumentando la síntesis y liberación de paraoxonasa 1 del hígado, reduciendo la aterosclerosis .
Una dieta baja en fibra reduce la producción de ácido butírico y ácido propiónico por la microbiota en el colon, lo que puede inducir inflamación y tener otros efectos adversos en la medida en que estos ácidos grasos de cadena corta activan PPAR-gamma. PPAR-gamma bajo reduce la capacidad del tejido adiposo para almacenar grasa, lo que resulta en un mayor almacenamiento de grasa en el tejido no adiposo ( lipotoxicidad ). Una dieta de proteína de soja aumenta el PPAR-gamma del tejido adiposo, reduciendo así la lipotoxicidad.
Muchos fármacos sensibilizantes a la insulina (a saber, las tiazolidindionas ) utilizados en el tratamiento de la diabetes activan el PPARG como un medio para reducir la glucosa sérica sin aumentar la secreción de insulina pancreática. La activación de PPARG es más eficaz para la resistencia a la insulina del músculo esquelético que para la resistencia a la insulina del hígado. Actualmente se estudian diferentes clases de compuestos que activan PPARG más débiles que las tiazolidinedionas (los denominados "agonistas parciales de PPARgamma") con la esperanza de que tales compuestos sigan siendo agentes hipoglucemiantes eficaces pero con menos efectos secundarios.
Se ha demostrado que el ácido decanoico triglicérido de cadena media es un ligando PPAR-gamma de activación parcial que no aumenta la adipogénesis. La activación de PPAR-gamma por el ácido decanoico se ha demostrado que aumenta el número mitocondrial, aumentar la mitocondrial enzima citrato sintasa , aumentar complejo I actividad en las mitocondrias, y aumentar la actividad del antioxidante de la enzima catalasa .
Una proteína de fusión de PPAR-γ1 y el factor de transcripción tiroideo PAX8 está presente en aproximadamente un tercio de los carcinomas foliculares de tiroides, para ser específicos de aquellos cánceres con una translocación cromosómica de t (2; 3) (q13; p25), que permite la yuxtaposición de porciones de ambos genes.
Se ha demostrado que el cannabidiol fitocannabinoide (CBD) activa PPAR gamma en modelos in vitro e in vivo . Los ácidos carboxílicos cannabinoides THCA , CBDA y CBGA activan PAARy de forma más eficaz que sus productos descarboxilados ; sin embargo, el THCA fue el ácido encontrado con mayor actividad. Como análogo sintético del THC-COOH (el principal metabolito no psicotrópico del THC ), el ácido ajulémico también es un potente agonista de PPARγ. El grupo ácido carboxílico es fundamental para un tiempo de activación más fuerte y prolongado.
Referencias
Otras lecturas
- Qi C, Zhu Y, Reddy JK (2001). "Receptores activados por proliferadores de peroxisomas, coactivadores y dianas aguas abajo". Bioquímica y Biofísica Celular . 32 Primavera (1-3): 187-204. doi : 10.1385 / cbb: 32: 1-3: 187 . PMID 11330046 . S2CID 31795393 .
- Kadowaki T, Hara K, Kubota N, Tobe K, Terauchi Y, Yamauchi T, et al. (2002). "El papel de PPARgamma en la obesidad inducida por una dieta alta en grasas y la resistencia a la insulina". Revista de diabetes y sus complicaciones . 16 (1): 41–5. doi : 10.1016 / S1056-8727 (01) 00206-9 . PMID 11872365 .
- Wakino S, Law RE, Hsueh WA (2002). "Efectos protectores vasculares por activación del receptor nuclear PPARgamma". Revista de diabetes y sus complicaciones . 16 (1): 46–9. doi : 10.1016 / S1056-8727 (01) 00197-0 . PMID 11872366 .
- Takano H, Komuro I (2002). "Funciones del receptor gamma activado por proliferador de peroxisoma en la enfermedad cardiovascular". Revista de diabetes y sus complicaciones . 16 (1): 108-14. doi : 10.1016 / S1056-8727 (01) 00203-3 . PMID 11872377 .
- Stumvoll M, Häring H (agosto de 2002). "El polimorfismo del receptor activado por proliferador de peroxisomas-gamma2 Pro12Ala" . Diabetes . 51 (8): 2341–7. doi : 10.2337 / diabetes.51.8.2341 . PMID 12145143 .
- Koeffler HP (enero de 2003). "Receptor gamma activado por proliferador de peroxisomas y cánceres". Investigación clínica del cáncer . 9 (1): 1–9. PMID 12538445 .
- Puigserver P, Spiegelman BM (febrero de 2003). "Coactivador 1 alfa del receptor gamma activado por proliferador de peroxisomas (PGC-1 alfa): coactivador transcripcional y regulador metabólico" . Revisiones endocrinas . 24 (1): 78–90. doi : 10.1210 / er.2002-0012 . PMID 12588810 .
- Takano H, Hasegawa H, Nagai T, Komuro I (mayo de 2003). "El papel de la vía dependiente de PPARgamma en el desarrollo de la hipertrofia cardíaca". Drogas de hoy . 39 (5): 347–57. doi : 10.1358 / punto.2003.39.5.799458 . PMID 12861348 .
- Rangwala SM, Lazar MA (junio de 2004). "Receptor gamma activado por proliferador de peroxisomas en diabetes y metabolismo". Tendencias en Ciencias Farmacológicas . 25 (6): 331–6. doi : 10.1016 / j.tips.2004.03.012 . PMID 15165749 .
- Cuzzocrea S (julio de 2004). "Ligandos gamma de receptores activados por proliferador de peroxisomas y lesión por isquemia y reperfusión". Farmacología vascular . 41 (6): 187–95. doi : 10.1016 / j.vph.2004.10.004 . PMID 15653094 .
- Savage DB (enero de 2005). "PPAR gamma como regulador metabólico: conocimientos de genómica y farmacología". Reseñas de expertos en medicina molecular . 7 (1): 1–16. doi : 10.1017 / S1462399405008793 . PMID 15673477 .
- Pégorier JP (abril de 2005). "[Receptores PPAR y sensibilidad a la insulina: nuevos agonistas en desarrollo]". Annales d'Endocrinologie . 66 (2 Pt 2): 1S10–7. PMID 15959400 .
- Tsai YS, Maeda N (abril de 2005). "PPARgamma: un determinante crítico de la distribución de grasa corporal en humanos y ratones". Tendencias en Medicina Cardiovascular . 15 (3): 81–5. doi : 10.1016 / j.tcm.2005.04.002 . PMID 16039966 .
- Gurnell M (diciembre de 2005). "Receptor gamma activado por proliferador de peroxisomas y la regulación de la función de los adipocitos: lecciones de estudios genéticos humanos". Mejores prácticas e investigación. Endocrinología clínica y metabolismo . 19 (4): 501–23. doi : 10.1016 / j.beem.2005.10.001 . PMID 16311214 .
- Cecil JE, Watt P, Palmer CN, Hetherington M (junio de 2006). "Balance energético e ingesta de alimentos: el papel de los polimorfismos del gen PPARgamma". Fisiología y comportamiento . 88 (3): 227–33. doi : 10.1016 / j.physbeh.2006.05.028 . PMID 16777151 . S2CID 54243343 .
- Rousseaux C, Desreumaux P (2007). "[El receptor gamma activado por proliferador de peroxisoma y enfermedad intestinal inflamatoria crónica (PPARgamma e IBD)]". Journal de la Société de Biologie . 200 (2): 121–31. doi : 10.1051 / jbio: 2006015 . PMID 17151549 .
- Eriksson JG (abril de 2007). "Polimorfismos genéticos, tamaño al nacer y desarrollo de hipertensión y diabetes tipo 2" . La Revista de Nutrición . 137 (4): 1063–5. doi : 10.1093 / jn / 137.4.1063 . PMID 17374678 .
- Tönjes A, Stumvoll M (julio de 2007). "El papel del polimorfismo Pro12Ala en el receptor gamma activado por el proliferador de peroxisomas en el riesgo de diabetes". Opinión Actual en Nutrición Clínica y Cuidados Metabólicos . 10 (4): 410–4. doi : 10.1097 / MCO.0b013e3281e389d9 . PMID 17563457 . S2CID 30323803 .
- Burgermeister E, Seger R (julio de 2007). "MAPK quinasas como lanzaderas nucleocitoplasmáticas para PPARgamma" . Ciclo celular . 6 (13): 1539–48. doi : 10.4161 / cc.6.13.4453 . PMID 17611413 .
- Papageorgiou E, Pitulis N, Msaouel P, Lembessis P, Koutsilieris M (agosto de 2007). "La diafonía no genómica entre ligandos PPAR-gamma y ERK1 / 2 en líneas de células cancerosas". Opinión de expertos sobre objetivos terapéuticos . 11 (8): 1071–85. doi : 10.1517 / 14728222.11.8.1071 . PMID 17665979 . S2CID 86480850 .
Este artículo incorpora texto de la Biblioteca Nacional de Medicina de los Estados Unidos , que es de dominio público .