Receptor de hidrocarburos arilo - Aryl hydrocarbon receptor
El receptor de hidrocarburo de arilo ( AhR o AHR o ahr o ahR ) es una proteína que en los seres humanos está codificada por el gen AHR . El receptor de hidrocarburos arilo es un factor de transcripción que regula la expresión génica. Originalmente se pensó que funcionaba principalmente como sensor de productos químicos xenobióticos y también como regulador de enzimas como el citocromo P450 que metabolizan estos productos químicos. Los más notables de estos productos químicos xenobióticos son los hidrocarburos aromáticos (arilo) de los que el receptor deriva su nombre.
Más recientemente, se ha descubierto que AhR es activado (o desactivado) por varios derivados de indol endógenos tales como quinurenina . Además de regular las enzimas del metabolismo, el AhR tiene funciones en la regulación de la inmunidad, el mantenimiento de las células madre y la diferenciación celular .
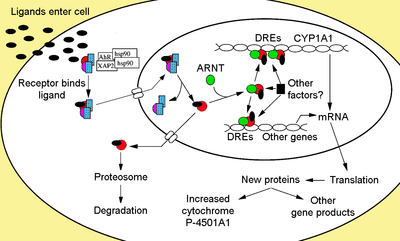
El receptor de hidrocarburo de arilo es un miembro de la familia de factores de transcripción básicos de hélice-bucle-hélice . AHR se une a varios ligandos exógenos, como flavonoides de plantas naturales , polifenólicos e indoles , así como a hidrocarburos aromáticos policíclicos sintéticos y compuestos similares a las dioxinas . AhR es un factor de transcripción citosólico que normalmente está inactivo, unido a varias co-chaperonas . Una vez que el ligando se une a sustancias químicas como la 2,3,7,8-tetraclorodibenzo- p- dioxina (TCDD), las chaperonas se disocian, lo que provoca que AhR se transloque al núcleo y se dimerice con ARNT ( translocador nuclear de AhR ) , lo que provoca cambios en la transcripción génica. .
Dominios funcionales de proteínas
La proteína AhR contiene varios dominios críticos para la función y se clasifica como un miembro de la familia básica de factores de transcripción helix-loop-helix / Per-Arnt-Sim (bHLH / PAS) . El motivo bHLH se encuentra en el N-terminal de la proteína y es una entidad común en una variedad de factores de transcripción . Los miembros de la superfamilia de bHLH tienen dos dominios funcionalmente distintivos y altamente conservados. La primera es la región básica (b), que participa en la unión del factor de transcripción al ADN . La segunda es la región hélice-bucle-hélice (HLH), que facilita las interacciones proteína-proteína. También están contenidos con el AhR dos dominios PAS, PAS-A y PAS-B, que son tramos de 200-350 aminoácidos que exhiben una alta homología de secuencia con los dominios de proteínas que se encontraron originalmente en el período de genes de Drosophila (Per) y resuelto (Sim) y en el socio de dimerización de AhR, el translocador nuclear del receptor de hidrocarburo de arilo (ARNT). Los dominios PAS soportan interacciones secundarias específicas con otras proteínas que contienen dominios PAS, como es el caso de AhR y ARNT, de modo que se pueden formar complejos proteicos diméricos y heteroméricos. El sitio de unión del ligando de AhR está contenido dentro del dominio PAS-B y contiene varios residuos conservados críticos para la unión del ligando. Finalmente, un dominio rico en glutamina (rico en Q) se encuentra en la región C-terminal de la proteína y está involucrado en el reclutamiento y transactivación del coactivador.
Ligandos
Los ligandos AhR se han clasificado generalmente en dos categorías, sintéticos o naturales. Los primeros ligandos que se descubrieron fueron los sintéticos y miembros de los hidrocarburos aromáticos halogenados ( dibenzodioxinas policloradas , dibenzofuranos y bifenilos ) y los hidrocarburos aromáticos policíclicos ( 3-metilcolantreno , benzo [ a ] pireno , benzantracenos y benzoflavonas ). Se ha diseñado una gama de ligandos sintéticos para apuntar al posible tratamiento futuro del cáncer de mama.
La investigación se ha centrado en compuestos naturales con la esperanza de identificar un ligando endógeno. Los compuestos de origen natural que se han identificado como ligandos de Ahr incluyen derivados de triptófano como el tinte índigo y la indirrubina , tetrapirroles como la bilirrubina , los metabolitos del ácido araquidónico lipoxina A4 y prostaglandina G , lipoproteína de baja densidad modificada y varios carotenoides dietéticos . Una suposición hecha en la búsqueda de un ligando endógeno es que el ligando será un agonista del receptor . Sin embargo, el trabajo de Savouret et al. ha demostrado que este puede no ser el caso, ya que sus hallazgos demuestran que el 7-cetocolesterol inhibe competitivamente la transducción de señales de Ahr.
La carbidopa es un modulador selectivo del receptor de hidrocarburos arilo (SAhRM).
Indolocarbazole (ICZ) es uno de los agonistas no halogenados más fuertes para AHR reportados in vitro.
Vía de señalización
Complejo citosólico
El Ahr no unido al ligando se retiene en el citoplasma como un complejo proteico inactivo que consta de un dímero de Hsp90 , prostaglandina E sintasa 3 (PTGES3, p23) y una sola molécula de la proteína que interactúa con el receptor AH similar a inmunofilina , también conocida como hepatitis. Proteína 2 asociada a X del virus B (XAP2), proteína de interacción AhR (AIP) y 9 activada por AhR (ARA9). El dímero de Hsp90, junto con PTGES3 (p23), tiene un papel multifuncional en la protección del receptor de la proteólisis, lo que limita al receptor en una conformación receptiva a la unión del ligando y previene la unión prematura de ARNT . AIP interactúa con el carboxilo terminal de Hsp90 y se une a la secuencia de localización nuclear AhR (NLS) evitando el tráfico inapropiado del receptor hacia el núcleo.
Activación del receptor
Tras la unión del ligando a AhR, se libera AIP dando como resultado la exposición del NLS, que se encuentra en la región bHLH, lo que lleva a la importación al núcleo. Se presume que una vez en el núcleo, Hsp90 se disocia exponiendo los dos dominios PAS permitiendo la unión de ARNT. El complejo de heterodímero AhR / ARNT activado es entonces capaz de interactuar directa o indirectamente con el ADN mediante la unión a secuencias de reconocimiento ubicadas en la región reguladora 5 'de genes que responden a dioxinas.
Unión al ADN (elemento de respuesta xenobiótico - XRE)
El motivo de reconocimiento clásico del complejo AhR / ARNT, denominado elemento sensible a AhR, dioxina o xenobiótico (AHRE, DRE o XRE), contiene la secuencia central 5'-GCGTG-3 'dentro de la secuencia consenso 5 '-T / GNGCGTGA / CG / CA-3' en la región promotora de genes sensibles a AhR. El heterodímero AhR / ARNT se une directamente a la secuencia del núcleo AHRE / DRE / XRE de una manera asimétrica de manera que ARNT se une a 5'-GTG-3 'y AhR se une a 5'-TC / TGC-3'. Investigaciones recientes sugieren que un segundo tipo de elemento denominado AHRE-II, 5'-CATG (N6) C [T / A] TG-3 ', es capaz de actuar indirectamente con el complejo AhR / ARNT. Independientemente del elemento de respuesta, el resultado final es una variedad de cambios diferenciales en la expresión génica.
Papel funcional en fisiología y toxicología.
Papel en el desarrollo
En términos de evolución, la función fisiológica más antigua de AhR está en desarrollo. Se presume que AhR ha evolucionado a partir de invertebrados donde cumplió un papel independiente del ligando en los procesos de desarrollo normales. El homólogo de AhR en Drosophila , sin espinas (ss) es necesario para el desarrollo de los segmentos distales de la antena y la pata. Ss se dimeriza con tango (tgo), que es el homólogo del mamífero Arnt, para iniciar la transcripción de genes. La evolución del receptor en los vertebrados resultó en la capacidad de unirse al ligando y podría haber ayudado a los humanos a evolucionar para tolerar el humo de los incendios. En el desarrollo de vertebrados, AhR aparentemente juega un papel en la proliferación y diferenciación celular. A pesar de carecer de un ligando endógeno claro, el AhR parece desempeñar un papel en la diferenciación de muchas vías de desarrollo, incluidas la hematopoyesis, los sistemas linfoides, las células T, las neuronas y los hepatocitos. También se ha encontrado que AhR tiene una función importante en las células madre hematopoyéticas: el antagonismo de AhR promueve su autorrenovación y expansión ex vivo y está involucrado en la diferenciación de megacariocitos.
Respuesta adaptativa e innata
La respuesta adaptativa se manifiesta como la inducción de enzimas metabolizadoras de xenobióticos. La evidencia de esta respuesta se observó por primera vez a partir de la inducción del citocromo P450, familia 1, subfamilia A, polipéptido 1 (Cyp1a1) resultante de la exposición a TCDD, que se determinó que estaba directamente relacionado con la activación de la vía de señalización Ahr. La búsqueda de otros genes metabolizadores inducidos por ligandos AhR, debido a la presencia de DRE, ha llevado a la identificación de una "batería de genes AhR" de enzimas metabolizantes de fase I y fase II formada por CYP1A1 , CYP1A2 , CYP1B1 , NQO1, ALDH3A1, UGT1A2 y GSTA1. Presumiblemente, los vertebrados tienen esta función para poder detectar una amplia gama de sustancias químicas, indicado por la amplia gama de sustratos que AhR es capaz de unirse y facilitar su biotransformación y eliminación. El AhR también puede indicar la presencia de sustancias químicas tóxicas en los alimentos y causar aversión a dichos alimentos.
La activación de AhR parece ser también importante para las respuestas inmunológicas y la inhibición de la inflamación a través de la regulación positiva de la interleucina 22 y la regulación negativa de la respuesta Th17 . El Knockdown of AHR regula principalmente a la baja la expresión de genes de inmunidad innata en las células THP-1 .
Respuesta tóxica
Las extensiones de la respuesta adaptativa son las respuestas tóxicas provocadas por la activación de AhR. La toxicidad resulta de dos formas diferentes de señalización AhR. El primero es un efecto secundario de la respuesta adaptativa en el que la inducción de enzimas metabolizantes da como resultado la producción de metabolitos tóxicos. Por ejemplo, el hidrocarburo aromático policíclico benzo [ a ] pireno (BaP), un ligando de AhR, induce su propio metabolismo y bioactivación a un metabolito tóxico mediante la inducción de CYP1A1 y CYP1B1 en varios tejidos. El segundo enfoque de la toxicidad es el resultado de cambios aberrantes en la transcripción global de genes más allá de los observados en la "batería de genes AhR". Estos cambios globales en la expresión génica conducen a cambios adversos en los procesos y funciones celulares. El análisis de microarrays ha demostrado ser muy beneficioso para comprender y caracterizar esta respuesta.
Interacciones proteína-proteína
Además de las interacciones de proteínas mencionadas anteriormente, también se ha demostrado que AhR interactúa con:
Referencias
enlaces externos
- Receptor de arilo + hidrocarburo + en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .
- Ubicación del genoma humano AHR y página de detalles del gen AHR en UCSC Genome Browser .
- Ubicación del genoma ARNT humano y página de detalles del gen ARNT en UCSC Genome Browser .





