Isatin - Isatin
|
|

|
|
| Nombres | |
|---|---|
|
Nombre IUPAC preferido
1 H -indol-2,3-diona |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| DrugBank | |
| Tarjeta de información ECHA |
100.001.889 |
| KEGG | |
|
PubChem CID
|
|
| UNII | |
|
Tablero CompTox ( EPA )
|
|
|
|
|
|
| Propiedades | |
| C 8 H 5 NO 2 | |
| Masa molar | 147,1308 g / mol |
| Apariencia | Sólido rojo anaranjado |
| Punto de fusion | 200 ° C (392 ° F; 473 K) |
| Peligros | |
| Dañino ( Xn ) | |
| Frases R (desactualizadas) | R22 R36 R37 R38 |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencias de Infobox | |
La isatina , también conocida como tribulina , es un compuesto orgánico derivado del indol con fórmula C 8 H 5 NO 2 . El compuesto fue obtenido por primera vez por Otto Linné Erdman y Auguste Laurent en 1840 como un producto de la oxidación del tinte índigo por el ácido nítrico y los ácidos crómico .
La isatina es un producto natural muy conocido que se puede encontrar en plantas del género Isatis , en Couroupita guianensis y también en humanos, como derivado metabólico de la adrenalina .
Tiene el aspecto de un polvo rojo anaranjado y generalmente se emplea como componente básico para la síntesis de una amplia variedad de compuestos biológicamente activos , incluidos antitumorales , antivirales , anti-VIH y antituberculosos .
El núcleo de isatina también es responsable del color de los tintes “ azul maya ” y “amarillo maya”.
Síntesis
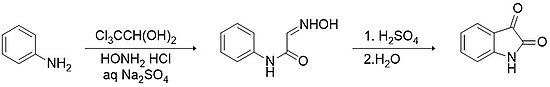
Metodología Sandmeyer
La metodología Sandmeyer es la forma más antigua y sencilla de síntesis de isatina. El método implica la condensación entre hidrato de cloral y una arilamina primaria (por ejemplo, anilina ), en presencia de hidrocloruro de hidroxilamina , en sulfato de sodio acuoso para formar una α-isonitrosoacetanilida. El aislamiento de esta ciclación electrofílica intermedia y posterior promovida por ácidos fuertes (por ejemplo, ácido sulfúrico ) proporciona isatina con un rendimiento> 75%.
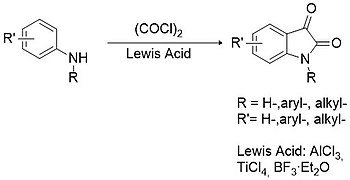
Metodología Stolle
El procedimiento de Stolle se considera la mejor alternativa a la metodología de Sandmeyer para la síntesis de isatinas sustituidas y no sustituidas. En este caso, las arilaminas primarias o secundarias se condensan con cloruro de oxalilo para formar un intermedio de cloroxalilanilida que luego puede ciclar en presencia de un ácido de Lewis (por ejemplo , tricloruro de aluminio , tetracloruro de titanio , trifluoruro de boro , etc. ).
Otros procedimientos
Enfoques más recientes para la síntesis de isatinas N-sustituidas implica la directa oxidación de, indoles sustituidos disponibles en el mercado o oxindoles con diferentes agentes oxidantes tales como TBHP , IBX-SO3K , tBuONO etc .
Reactividad
La presencia de un anillo aromático , una cetona y un resto de γ-lactama , le da a la isatina el raro potencial de ser utilizada tanto como electrófilo como nucleófilo : de hecho, sufre un enorme número de reacciones, tales como sustituciones de N, electrófilo. sustitución aromática en las posiciones C-5 y C-7 del anillo de fenilo, adiciones nucleofílicas al grupo carbonilo C-3 , reducciones quimioselectivas , oxidaciones , expansiones de anillo y espiroanulaciones . Debido a esta reactividad única, la isatina se considera uno de los componentes básicos más valiosos en la síntesis orgánica .
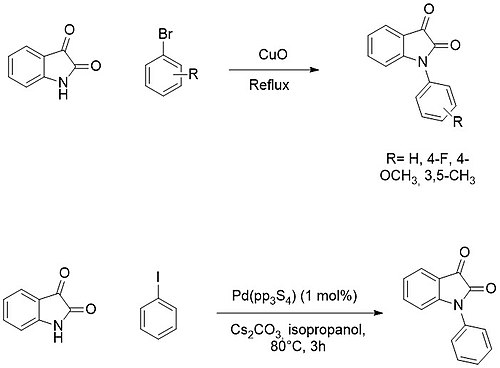
N-sustitución
La funcionalización en N del núcleo de isatina se puede obtener fácilmente mediante la desprotonación del resto amino, formando la sal de sodio o potasio correspondiente y la posterior adición de un electrófilo (por ejemplo, haluros de alquilo o acilo ).
Por otro lado, N-arilación se consigue normalmente por reacciones cruzadas de acoplamiento con haluros de arilo utilizando cobre AL catalizadores de paladio .
Expansión de anillo
En el campo de la síntesis orgánica , las expansiones de anillos se consideran reacciones valiosas ya que permiten la obtención de anillos de tamaño medio (7-9 átomos) que son difíciles de sintetizar mediante métodos "clásicos".
Hasta la fecha, se han publicado pocos artículos sobre la expansión del anillo de derivados de isatina. El primero es una reacción multicomponente de un solo recipiente catalizada por ácido que involucra isatinas, aminouracilos e isooxazolonas para formar isoxazoquinolinas, andamios importantes en la química médica .
En otra reacción multicomponente de un solo recipiente , se ha logrado una expansión única de dos carbonos haciendo reaccionar isatina con indeno-1,3-diona y bromuro de piridinio N-sustituido para formar dibenzo [b, d] azepin-6-onas.
Adición nucleofílica C-2 / C-3
La isatina sufre una adición nucleofílica sobre los carbonilos en las posiciones C-2 y C-3 . La regioselectividad del proceso depende en gran medida tanto del sustrato (propiedades de los sustituyentes en el núcleo de isatina, especialmente los unidos al átomo de nitrógeno) como de las condiciones de reacción ( disolvente , temperatura, etc.). En algunos casos, la adición nucleofílica podría ir seguida de reacciones secundarias ( por ejemplo , ciclación , expansión del anillo , apertura del anillo , etc. )
Oxidación
La oxidación de isatina usando peróxido de hidrógeno o anhídrido crómico produce anhídrido isatoico , un compuesto ampliamente utilizado tanto en productos herbicidas como en química médica .
Dimerización
La dimerización de isatina con KBH 4 en metanol produce indirrubina . Esto representa el componente rojo del pigmento índigo y un compuesto citotóxico altamente efectivo .
Reducción
Obviamente, la reducción del grupo carbonilo no amida se produce para dar oxindol , respectivamente.
Ver también
Referencias
Reseñas
- Popp, Broma D. (1975). "La química de Isatin". Avances en química heterocíclica Volumen 18 . Avances en química heterocíclica. 18 . págs. 1-58. doi : 10.1016 / S0065-2725 (08) 60127-0 . ISBN 9780120206186.
- Silva, Joaquim FM da; Garden, Simon J .; Pinto, Angelo C. (junio de 2001). "La química de las isatinas: una revisión de 1975 a 1999" . Revista de la Sociedad Química Brasileña . 12 (3): 273–324. doi : 10.1590 / S0103-50532001000300002 .
- Mesropyan, EG; Avetisyan, AA (2009). "Nuevos derivados de isatina". Revista rusa de química orgánica . 45 (11): 1583. doi : 10.1134 / S1070428009110013 . S2CID 97341279 .
- Varun, Varun; Sonam, Sonam; Kakkar, Rita (2019). "Isatin y sus derivados: un estudio de síntesis, reacciones y aplicaciones recientes" . MedChemComm . 10 (3): 351–368. doi : 10.1039 / C8MD00585K . PMC 6438150 . PMID 30996856 .
enlaces externos
- . Encyclopædia Britannica . 14 (11ª ed.). 1911. págs. 865–866.