Carbodiimida - Carbodiimide
En química orgánica , una carbodiimida (nombre sistemático IUPAC: metanodiimina ) es un grupo funcional con la fórmula RN = C = NR. Son exclusivamente sintéticos. Una carbodiimida bien conocida es la diciclohexilcarbodiimida , que se utiliza en la síntesis de péptidos . Las dialquilcarbodiimidas son estables. Algunos derivados diarilo tienden a convertirse en dímeros y polímeros al dejarlos reposar a temperatura ambiente, aunque esto ocurre principalmente con carbodiimidas de bajo punto de fusión que son líquidos a temperatura ambiente. Las diaril carbodiimidas sólidas son más estables, pero pueden sufrir hidrólisis lentamente en presencia de agua con el tiempo.
Estructura y vinculación
Desde la perspectiva de la unión, las carbodiimidas son isoelectrónicas con el dióxido de carbono . Tres estructuras de resonancia principales describen las carbodiimidas:
- RN = C = NR ↔ RN + ≡CN - R ↔ RN - -C≡N + R
El núcleo N = C = N es relativamente lineal y los ángulos CN = C se acercan a 120 °. En el caso de C (NCHPh 2 ) 2 , el ángulo central N = C = N es 170 ° y los ángulos CN = C están dentro de 1 ° de 126 °. Las distancias C = N son cortas, casi 120 pm, como es característico de los dobles enlaces. Las carbodiimidas son quirales , poseen simetría C 2 y, por tanto, quiralidad axial . Sin embargo, debido a la barrera de baja energía para que la molécula gire y por lo tanto se convierta rápidamente entre sus isómeros, el aislamiento real de un isómero óptico de una carbodiimida es extremadamente difícil. Se ha demostrado al menos una vez, en el caso de carbodiimidas cíclicas restringidas conformacionalmente ; aunque hay otros informes de carbodiimidas axialmente quirales con una sola mano, su validez ha sido cuestionada desde entonces por motivos experimentales y computacionales.
El compuesto original, metanodiimina, (HN = C = NH), es un tautómero de cianamida .
Síntesis
De tioureas y ureas
Una ruta clásica a las carbodiimidas implica la deshidrosulfuración de tioureas. Un reactivo típico para este proceso es el óxido de mercurio :
- (R (H) N) 2 CS + HgO → (RN) 2 C + HgS + H 2 O
Esta reacción a menudo se puede realizar como se indica, aunque las carbodiimidas reaccionen con agua. En algunos casos, se agrega un agente deshidratante a la mezcla de reacción.
La deshidratación de N, N'-dialquilureas da carbodiimidas:
- (R (H) N) 2 CO → (RN) 2 C + H 2 O
Se han utilizado pentóxido de fósforo y cloruro de p- toluenosulfonilo como agentes deshidratantes.
De isocianatos
Los isocianatos se pueden convertir en carbodiimidas con pérdida de dióxido de carbono:
- 2 RN = C = O → (RN) 2 C + CO 2
La reacción es catalizada por óxidos de fosfina . Esta reacción es reversible.
Reacciones
En comparación con otros heteroalenos, las carbodiimidas son electrófilos muy débiles y solo reaccionan con nucleófilos en presencia de catalizadores, como los ácidos. De esta forma se pueden preparar guanidinas . Como bases débiles, las carbodiimidas se unen a los ácidos de Lewis para dar aductos .
Oxidación de Moffatt
Las carbodiimidas son reactivos para la oxidación Moffatt , un protocolo para la conversión de un alcohol en un carbonilo (cetona o aldehído) utilizando dimetilsulfóxido como agente oxidante:
- (CH 3 ) 2 SO + (CyN) 2 C + R 2 CHOH → (CH 3 ) 2 S + (CyNH) 2 CO + R 2 C = O
Normalmente, el sulfóxido y la diimida se utilizan en exceso. La reacción genera sulfuro de dimetilo y urea como subproductos.
Agentes de acoplamiento
En síntesis orgánica , los compuestos que contienen la funcionalidad carbodiimida se utilizan como agentes de deshidratación. Específicamente, se utilizan a menudo para convertir ácidos carboxílicos en amidas o ésteres . A menudo se añaden aditivos, como N-hidroxibenzotriazol o N-hidroxisuccinimida , para aumentar los rendimientos y disminuir las reacciones secundarias.
Las policarbodiimidas también se pueden utilizar como reticulantes para resinas acuosas, tales como dispersiones de poliuretano o dispersiones acrílicas. Aquí, la policarbodiimida reacciona con ácidos carboxílicos, cuyos grupos funcionales están a menudo presentes en tales resinas acuosas, para formar N-acil urea. El resultado es la formación de enlaces covalentes entre las cadenas de polímero, haciéndolas reticuladas.
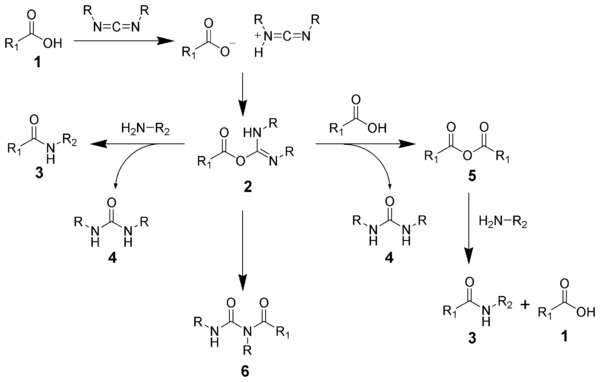
Mecanismo de formación de amidas
La formación de una amida usando una carbodiimida es una reacción común, pero conlleva el riesgo de varias reacciones secundarias. El ácido 1 reaccionará con la carbodiimida para producir el intermedio clave: la O-acilisourea 2 , que puede verse como un éster carboxílico con un grupo saliente activado. La O-acilisourea reaccionará con las aminas para dar la amida 3 y la urea 4 deseadas .
Las posibles reacciones de la O-acilisourea 2 producen productos tanto deseados como no deseados. La O-acilisourea 2 puede reaccionar con un ácido carboxílico 1 adicional para dar un anhídrido de ácido 5 , que puede reaccionar más para dar la amida 3 . La principal vía de reacción no deseada implica la transposición de la O-acilisourea 2 a la N - acilurea 6 estable . El uso de disolventes con constantes dieléctricas bajas, como diclorometano o cloroformo, puede minimizar esta reacción secundaria.
Ejemplos
DCC
DCC (acrónimo de N, N'- diciclohexilcarbodiimida ) fue una de las primeras carbodiimidas desarrolladas como reactivo. Se usa ampliamente para la formación de amidas y ésteres, especialmente para la síntesis de péptidos en fase sólida. DCC ha alcanzado popularidad principalmente debido a sus reacciones de acoplamiento de amidas de alto rendimiento y al hecho de que es bastante económico.
Sin embargo, DCC tiene algunos inconvenientes serios y su uso a menudo se evita por varias razones:
- El subproducto N, N'- diciclohexilurea se elimina principalmente por filtración, pero las trazas de impurezas pueden ser difíciles de eliminar. Es incompatible con la síntesis tradicional de péptidos en fase sólida.
- El DCC es un alérgeno potente y el contacto repetido con la piel aumenta la probabilidad de sensibilización al compuesto. Se han informado informes clínicos de personas que no pueden entrar en habitaciones donde se utilizan agentes de acoplamiento de péptidos.
DIC

A diferencia de DCC, DIC (N, N'-diisopropilcarbodiimida) es un líquido. Su producto de hidrólisis, N, N'-diisopropilurea, es soluble en disolventes orgánicos.
EDC
EDC es un reactivo de carbodiimida soluble en agua que se utiliza para una amplia gama de propósitos. Aparte de usos similares a los de DCC y DIC, también se utiliza para diversos fines bioquímicos como reticulante o sonda química .
CMCT o CMC
El meto- p- toluenosulfonato de 1-ciclohexil- (2-morfolinoetil) carbodiimida es una carbodiimida desarrollada para el sondeo químico de la estructura del ARN en bioquímica.
Ver también
- Diimida de azufre : el análogo del azufre