Compuesto cíclico - Cyclic compound
Un compuesto cíclico (o compuesto de anillo ) es un término para un compuesto en el campo de la química en el que una o más series de átomos en el compuesto están conectados para formar un anillo . Los anillos pueden variar en tamaño de tres a muchos átomos, e incluyen ejemplos en los que todos los átomos son carbono (es decir, carbociclos ), ninguno de los átomos es carbono (compuestos cíclicos inorgánicos) o donde están presentes átomos de carbono y no carbono ( compuestos heterocíclicos ). Dependiendo del tamaño del anillo, el orden de enlace de los enlaces individuales entre los átomos del anillo y sus disposiciones dentro de los anillos, los compuestos carbocíclicos y heterocíclicos pueden ser aromáticos o no aromáticos; en el último caso, pueden variar de estar completamente saturados a tener un número variable de enlaces múltiples entre los átomos del anillo. Debido a la tremenda diversidad permitida, en combinación, por las valencias de los átomos comunes y su capacidad para formar anillos, el número de posibles estructuras cíclicas, incluso de tamaño pequeño (por ejemplo, <17 átomos en total), es de muchos miles de millones.
- Ejemplos de compuestos cíclicos: compuestos totalmente de carbono (carbocíclicos) y compuestos cíclicos naturales más complejos .
Ingenol , un producto natural terpenoide complejo, relacionado pero más simple que el paclitaxel que sigue, que muestra una estructura de anillo compleja que incluye anillos carbocíclicos no aromáticos de 3, 5 y 7 miembros .
Cicloalcanos , los carbociclos más simples , que incluyen ciclopropano , ciclobutano , ciclopentano y ciclohexano . Tenga en cuenta que en otros lugares se usa una abreviatura de química orgánica donde se infiere que los átomos de hidrógeno están presentes para llenar la valencia del carbono de 4 (en lugar de que se muestren explícitamente).
Paclitaxel , otro terpenoide complejo derivado de plantas , también un producto natural, que muestra una estructura compleja de múltiples anillos que incluye anillos de 4, 6 y 8 miembros (carbocíclicos y heterocíclicos , aromáticos y no aromáticos).
Además de su complejidad y número, el cierre de átomos en anillos puede bloquear átomos particulares con sustitución distinta (por grupos funcionales ) de modo que se produzca la estereoquímica y quiralidad del compuesto, incluidas algunas manifestaciones que son exclusivas de los anillos (por ejemplo, isómeros configuracionales ). Además, dependiendo del tamaño del anillo, las formas tridimensionales de estructuras cíclicas particulares, típicamente anillos de cinco átomos y más grandes, pueden variar e interconvertirse de manera que se muestre la isomería conformacional . De hecho, el desarrollo de este importante concepto químico surgió históricamente en referencia a los compuestos cíclicos. Finalmente, los compuestos cíclicos, debido a las formas, reactividades, propiedades y bioactividades únicas que engendran, son la mayoría de todas las moléculas involucradas en la bioquímica, estructura y función de los organismos vivos , y en moléculas artificiales como las drogas, pesticidas, etc.
Introducción estructural
Un compuesto cíclico o compuesto de anillo es un compuesto en el que al menos algunos de sus átomos están conectados para formar un anillo. Los anillos varían en tamaño de tres a muchas decenas o incluso cientos de átomos. Los ejemplos de compuestos de anillo incluyen fácilmente casos en los que:
- todos los átomos son carbono (es decir, carbociclos ),
- ninguno de los átomos es carbono (compuestos cíclicos inorgánicos), o donde
- están presentes átomos de carbono y no carbono ( compuestos heterocíclicos ).
Los átomos comunes pueden (como resultado de sus valencias ) formar un número variable de enlaces, y muchos átomos comunes forman anillos fácilmente. Además, dependiendo del tamaño del anillo, el orden de enlace de los enlaces individuales entre los átomos del anillo y sus disposiciones dentro de los anillos, los compuestos cíclicos pueden ser aromáticos o no aromáticos; en el caso de compuestos cíclicos no aromáticos, pueden variar de estar completamente saturados a tener un número variable de enlaces múltiples. Como consecuencia de la variabilidad constitucional que es termodinámicamente posible en las estructuras cíclicas, el número de posibles estructuras cíclicas, incluso de tamaño pequeño (por ejemplo, <17 átomos), asciende a muchos miles de millones.
Por otra parte, el cierre de los átomos en los anillos se puede bloquear en particular grupo funcional - sustituidos átomos en su lugar, lo que resulta en estereoquímica y quiralidad estando asociados con el compuesto, incluyendo algunas manifestaciones que son exclusivos de anillos (por ejemplo, isómeros de configuración ); Además, dependiendo del tamaño del anillo, las formas tridimensionales de estructuras cíclicas particulares, por lo general anillos de cinco átomos y más grandes, pueden variar e interconvertirse de manera que se muestre la isomería conformacional .
Nomenclatura
La nomenclatura de la IUPAC tiene reglas extensas para cubrir la denominación de estructuras cíclicas, tanto como estructuras centrales como sustituyentes añadidos a estructuras alicíclicas . El término macrociclo se usa cuando un compuesto que contiene un anillo tiene un anillo de 12 o más átomos. El término policíclico se usa cuando aparece más de un anillo en una sola molécula. El naftaleno es formalmente un compuesto policíclico, pero se denomina más específicamente como un compuesto bicíclico. En la galería final a continuación se dan varios ejemplos de estructuras macrocíclicas y policíclicas.
Los átomos que forman parte de la estructura del anillo se denominan átomos anulares.
Carbociclos
La gran mayoría de los compuestos cíclicos son orgánicos , y de estos, una parte significativa y conceptualmente importante está compuesta por anillos hechos solo de átomos de carbono (es decir, son carbociclos).
Compuestos cíclicos inorgánicos
Los átomos inorgánicos también forman compuestos cíclicos. Los ejemplos incluyen azufre , silicio (por ejemplo, en silanos ), fósforo (por ejemplo, en variantes de fosfanos y ácido fosfórico ) y boro (por ejemplo, en ácido tribórico). Cuando el carbono del benceno se "reemplaza" por otros elementos, por ejemplo, como en el borabenceno , silabenceno , germanabenceno , estannabenceno y fosforina , se retiene la aromaticidad, por lo que los compuestos cíclicos inorgánicos aromáticos son conocidos y bien caracterizados.
Compuestos heterocíclicos
Los compuestos cíclicos que tienen átomos de carbono y no carbono presentes se denominan ( compuestos heterocíclicos ); alternativamente, el nombre puede referirse a compuestos cíclicos inorgánicos, como siloxanos y borazinas, que tienen más de un tipo de átomo en sus anillos. La IUPAC recomienda la nomenclatura de Hantzsch-Widman para nombrar heterociclos, pero muchos nombres comunes siguen siendo de uso regular.
Aromaticidad
Los compuestos cíclicos pueden exhibir o no aromaticidad ; el benceno es un ejemplo de un compuesto cíclico aromático, mientras que el ciclohexano no es aromático. En química orgánica, el término aromaticidad se usa para describir una molécula cíclica (en forma de anillo), plana (plana) que exhibe una estabilidad inusual en comparación con otras disposiciones geométricas o conectivas del mismo conjunto de átomos. Como resultado de su estabilidad, es muy difícil hacer que las moléculas aromáticas se rompan y reaccionen con otras sustancias. Los compuestos orgánicos que no son aromáticos se clasifican como compuestos alifáticos; pueden ser cíclicos, pero solo los anillos aromáticos tienen una estabilidad especial (baja reactividad).
Dado que uno de los sistemas aromáticos de compuestos más comunes en la química orgánica se basa en derivados del compuesto aromático prototípico benceno (un hidrocarburo aromático común en el petróleo y sus destilados), la palabra "aromático" se usa ocasionalmente para referirse informalmente a los derivados del benceno. , y así fue como se definió por primera vez. Sin embargo, existen muchos compuestos aromáticos distintos del benceno. En los organismos vivos, por ejemplo, los anillos aromáticos más comunes son las bases de doble anillo en el ARN y el ADN. Un grupo funcional u otro sustituyente aromático se denomina grupo arilo.
El primer uso del término "aromático" fue en un artículo de August Wilhelm Hofmann en 1855. Hofmann usó el término para una clase de compuestos de benceno, muchos de los cuales tienen olores (aromas), a diferencia de los hidrocarburos saturados puros. Hoy en día, no existe una relación general entre la aromaticidad como propiedad química y las propiedades olfativas de dichos compuestos (cómo huelen), aunque en 1855, antes de que se entendiera la estructura del benceno o de los compuestos orgánicos, químicos como Hofmann comenzaban a comprender que los Las moléculas de las plantas, como los terpenos, tenían propiedades químicas que reconocemos hoy en día son similares a los hidrocarburos de petróleo insaturados como el benceno.
En términos de la naturaleza electrónica de la molécula, la aromaticidad describe un sistema conjugado a menudo formado por enlaces simples y dobles alternos en un anillo. Esta configuración permite que los electrones del sistema pi de la molécula se deslocalicen alrededor del anillo, lo que aumenta la estabilidad de la molécula. La molécula no puede estar representada por una estructura, sino por un híbrido de resonancia de diferentes estructuras, como con las dos estructuras de resonancia del benceno. Estas moléculas no se pueden encontrar en ninguna de estas representaciones, con los enlaces simples más largos en una ubicación y el enlace doble más corto en otra (ver teoría a continuación). Más bien, la molécula exhibe longitudes de enlace entre las de los enlaces simples y dobles. Este modelo comúnmente visto de anillos aromáticos, a saber, la idea de que el benceno se formó a partir de un anillo de carbono de seis miembros con enlaces simples y dobles alternos (ciclohexatrieno), fue desarrollado por August Kekulé (ver la sección de Historia a continuación). El modelo para el benceno consta de dos formas de resonancia, que corresponden a los enlaces dobles y sencillos que se superponen para producir seis enlaces uno y medio. El benceno es una molécula más estable de lo que cabría esperar sin tener en cuenta la deslocalización de la carga.
Ejemplos simples y monocíclicos
Los siguientes son ejemplos de carbociclos simples y aromáticos, compuestos cíclicos inorgánicos y heterociclos:
- Compuestos monocíclicos simples: ejemplos carbocíclicos, inorgánicos y heterocíclicos (aromáticos y no aromáticos).
Cicloheptano , un compuesto carbocíclico simple de 7 miembros, se muestran hidrógenos de metileno (no aromáticos).
Benceno , un compuesto carbocíclico de 6 miembros. se muestran los hidrógenos de metino , y los 6 electrones se muestran deslocalizados mediante el dibujo de un círculo (aromático).
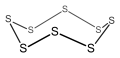
Ciclo - octasulfuro , un compuesto cíclico inorgánico de 8 miembros (no aromático).
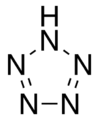
Pentazol , un compuesto cíclico inorgánico de 5 miembros (aromático).
Azetidina , un compuesto heterocíclico de nitrógeno (aza) de 4 miembros , implicados átomos de hidrógeno de metileno , no mostrado (no aromático).
Piridina , un compuesto heterocíclico de 6 miembros, átomos de hidrógeno de metino implícitos, no mostrados, y electrones π deslocalizados mostrados como enlaces discretos (aromáticos).
Estereoquímica
El cierre de átomos en anillos puede bloquear átomos particulares con una sustitución distinta por grupos funcionales de modo que el resultado sea la estereoquímica y quiralidad del compuesto, incluidas algunas manifestaciones que son exclusivas de los anillos (por ejemplo, isómeros configuracionales ).
Isomería conformacional
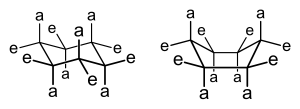
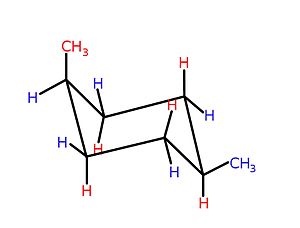
Dependiendo del tamaño del anillo, las formas tridimensionales de estructuras cíclicas particulares, típicamente anillos de 5 átomos y más grandes, pueden variar e interconvertirse de manera que se muestre la isomería conformacional . De hecho, el desarrollo de este importante concepto químico surgió, históricamente, en referencia a los compuestos cíclicos. Por ejemplo, ciclohexanos -Seis miembros que carbociclos sin dobles enlaces, a la que diversos sustituyentes pueden estar unidos, ver la imagen a mostrar un equilibrio entre dos conformaciones, la silla y el barco, como se muestra en la imagen.
La conformación de silla es la configuración favorecida, ya que en esta conformación, la cepa estérico , cepa que eclipsa , y cepa ángulo que son de otra manera posible se reducen al mínimo. Cuál de las posibles conformaciones de silla predomina en los ciclohexanos que llevan uno o más sustituyentes depende de los sustituyentes y de dónde se encuentran en el anillo; Generalmente, "voluminosos" sustituyentes-aquellos grupos con grandes volúmenes , o grupos que son de otra manera repulsiva en sus interacciones -prefer para ocupar una ubicación ecuatorial. Un ejemplo de interacciones dentro de una molécula que conduciría a una tensión estérica , lo que llevaría a un cambio en el equilibrio del bote a la silla, es la interacción entre los dos grupos metilo en cis -1,4-dimetilciclohexano. En esta molécula, los dos grupos metilo están en posiciones opuestas del anillo (1,4-), y su estereoquímica cis proyecta ambos grupos hacia el mismo lado del anillo. Por lo tanto, si se les fuerza a la forma de bote de mayor energía, estos grupos metilo están en contacto estérico, se repelen entre sí y conducen el equilibrio hacia la conformación de silla.
Macrociclos
El término macrociclo se usa para compuestos que tienen anillos de 8 o más átomos. Los macrociclos pueden ser completamente carbocíclicos, heterocíclicos pero con heteroátomos limitados (por ejemplo, en lactonas y lactamas ), o ser ricos en heteroátomos y mostrar una simetría significativa (por ejemplo, en el caso de macrociclos quelantes). Los macrociclos pueden acceder a una serie de conformaciones estables , con preferencia para residir en conformaciones que minimizan las interacciones transanulares no adheridas dentro del anillo (por ejemplo, con la silla y la silla-bote siendo más estables que la conformación bote-bote para ciclooctano, debido a las interacciones representadas por los arcos mostrados). Los anillos medianos (8-11 átomos) son los más tensos, con una energía de deformación entre 9-13 (kcal / mol), y el análisis de factores importantes en las conformaciones de macrociclos más grandes se puede modelar utilizando conformaciones de anillos medianos. El análisis conformacional de los anillos de miembros impares sugiere que tienden a residir en formas menos simétricas con diferencias de energía más pequeñas entre las conformaciones estables.

Usos principales de las estructuras cíclicas
Debido a las formas, reactividades, propiedades y bioactividades únicas que engendran, los compuestos cíclicos son la mayor parte de todas las moléculas involucradas en la bioquímica, estructura y función de los organismos vivos y en las moléculas artificiales (p. Ej., Medicamentos, herbicidas, etc.) a través de los cuales el hombre intenta ejercer control sobre la naturaleza y los sistemas biológicos.
Ejemplos complejos y policíclicos
Los siguientes son ejemplos de compuestos cíclicos que exhiben sistemas de anillos y características estereoquímicas más complejas:
- Compuestos cíclicos complejos: ejemplos macrocíclicos y policíclicos
Naftaleno , técnicamente un compuesto policíclico, más específicamente un compuesto bicíclico, con círculos que muestran la deslocalización de los electrones π (aromáticos).
Decalina (decahidronaftaleno), el derivado completamente saturado de naftaleno , que muestra las dos estereoquímicas posibles para "fusionar" los dos anillos, y cómo esto afecta las formas disponibles para este compuesto bicíclico (no aromático).
Longifoleno , un producto natural terpénico y un ejemplo de molécula tricíclica (no aromática).
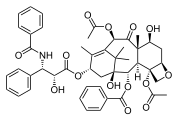
Paclitaxel , un producto natural policíclico con un núcleo tricíclico: con un anillo D heterocíclico de 4 miembros, fusionado con otros anillos carbocíclicos (A / C y B) de 6 y 8 miembros (no aromáticos), y con tres anillos más colgantes anillos de fenilo en su "cola", y unidos a C-2 (abrev. Ph, C 6 H 5 ; aromáticos).
Una forma tridimensional representativa adoptada por paclitaxel , como resultado de su estructura cíclica única.
Colesterol , otro producto natural terpénico, en particular, un esteroide , una clase de moléculas tetracíclicas (no aromáticas).
Benzo [a] pireno , un compuesto pentacíclico tanto natural como artificial, y electrones π deslocalizados que se muestran como enlaces discretos (aromáticos).
Pagodane , un compuesto policíclico artificial (no aromático) complejo, altamente simétrico.
Brevetoxina A , un producto natural con diez anillos, todos fusionados y todos heterocíclicos , y un componente tóxico asociado a los organismos responsables de las mareas rojas . El grupo R de la derecha se refiere a una de varias posibles cadenas laterales de cuatro carbonos (consulte el artículo principal sobre Brevetoxina ; no aromático).
Reacciones sintéticas que alteran los anillos
Reacciones generales importantes para la formación de anillos.
Existe una variedad de reacciones especializadas cuyo uso es únicamente la formación de anillos, y estas se discutirán a continuación. Además de estos, existe una amplia variedad de reacciones orgánicas generales que históricamente han sido cruciales en el desarrollo, primero, de la comprensión de los conceptos de química de anillos, y segundo, de procedimientos confiables para preparar estructuras de anillos con alto rendimiento y con definidas orientación de los sustituyentes del anillo (es decir, estereoquímica definida ). Estas reacciones generales incluyen:
- Condensación de aciloína ;
- Oxidaciones anódicas ; y
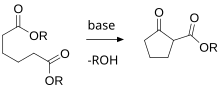
- la condensación de Dieckmann aplicada a la formación de anillos.
Reacciones de cierre de anillo
En química orgánica, una variedad de adquisiciones sintéticas son particularmente útiles para cerrar anillos carbocíclicos y otros; estas se denominan reacciones de cierre de anillo . Ejemplos incluyen:
- trimerización de alquinos ;
- la ciclación de Bergman ;
- las reacciones de Diels-Alder y otras de cicloadición ;
- la reacción de ciclación de Nazarov ;
- varias ciclizaciones de radicales ;
- reacciones de metátesis de cierre de anillo , que también pueden usarse para lograr un tipo específico de polimerización ;
- la síntesis de anillos grandes de Ruzicka ; y
- la síntesis de Wenker de aziridinas .
Reacciones de apertura del anillo
Una variedad de procedimientos sintéticos adicionales son particularmente útiles para abrir anillos carbocíclicos y otros, generalmente que contienen un "mango" de doble enlace u otro grupo funcional para facilitar la química; estos se denominan reacciones de apertura de anillo . Ejemplos incluyen:
- metátesis de apertura de anillo , que también se puede utilizar para lograr un tipo específico de polimerización .
Reacciones de expansión y contracción del anillo.
Las reacciones de expansión y contracción del anillo son comunes en la síntesis orgánica y se encuentran con frecuencia en reacciones pericíclicas . Las expansiones y contracciones del anillo pueden implicar la inserción de un grupo funcional como el caso de la oxidación de cetonas cíclicas de Baeyer-Villiger , reordenamientos de carbociclos cíclicos como se observa en reacciones intramoleculares de Diels-Alder , o colapso o reordenamiento de compuestos bicíclicos como varios ejemplos.
Ver también
Referencias
- ^ Marzo, Jerry (1985), Química orgánica avanzada: reacciones, mecanismos y estructura (3.a ed.), Nueva York: Wiley, ISBN 0-471-85472-7
- ↑ Halduc, I. (1961). "Clasificación de compuestos cíclicos inorgánicos". Revista de química estructural . 2 (3): 350–8. doi : 10.1007 / BF01141802 . S2CID 93804259 .
- ^ Reymond, Jean-Louis (2015). "El Proyecto del Espacio Químico" . Cuentas de Investigación Química . 48 (3): 722-30. doi : 10.1021 / ar500432k . PMID 25687211 .
- ↑ a b c d e f g h William Reusch (2010). "Estereoisómeros Parte I" en el libro de texto virtual de química orgánica. Universidad Estatal de Michigan . Consultado el 7 de abril de 2015 .
- ^ a b Aún así, W.Clark; Galynker, Igor (1981). "Consecuencias químicas de la conformación en compuestos macrocíclicos". Tetraedro . 37 (23): 3981–96. doi : 10.1016 / S0040-4020 (01) 93273-9 .
-
↑ a b J. D. Dunitz (1968). JD Dunitz y JA Ibers (ed.). Perspectivas en química estructural . Vol. 2. Nueva York: Wiley. págs. 1-70.
|volume=tiene texto extra ( ayuda ) - ^ Morris, Christopher G .; Prensa, Academic (1992). Diccionario de Prensa Académica de Ciencia y Tecnología . Publicaciones profesionales del Golfo. pag. 120. ISBN 9780122004001.
- ^ Eliel, EL, Wilen, SH y Mander, LS ( 1994 ) Estereoquímica de compuestos orgánicos, John Wiley and Sons, Inc., Nueva York.
- ^ Anet, FAL; St. Jacques, M .; Henrichs, PM; Cheng, AK; Krane, J .; Wong, L. (1974). "Análisis conformacional de cetonas de anillo medio". Tetraedro . 30 (12): 1629–37. doi : 10.1016 / S0040-4020 (01) 90685-4 .
- ^ Löwe, J; Li, H; Downing, KH; Nogales, E (2001). "Estructura refinada de αβ-tubulina a una resolución de 3,5 Å" . Revista de Biología Molecular . 313 (5): 1045–57. doi : 10.1006 / jmbi.2001.5077 . PMID 11700061 .
Otras lecturas
- Jürgen-Hinrich Fuhrhop & Gustav Penzlin, 1986, "Síntesis orgánica: conceptos, métodos, materiales de partida", Weinheim, BW, DEU: VCH, ISBN 0895732467 , véase [1] , consultado el 19 de junio de 2015.
- Michael B. Smith & Jerry March, 2007, "March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure", 6th Ed., Nueva York, NY, EE.UU .: Wiley & Sons, ISBN 0470084944 , véase [2] , consultado el 19 de junio. 2015.
- Francis A. Carey y Richard J. Sundberg, 2006, "Título de Química Orgánica Avanzada: Parte A: Estructura y Mecanismos", 4ª Ed., Nueva York, NY, EE. UU.: Springer Science & Business Media, ISBN 0306468565 , ver [3] , consultado el 19 de junio de 2015.
- Michael B. Smith, 2011, "Organic Chemistry: An Acid-Base Approach", Boca Raton, FL, EE. UU .: CRC Press, ISBN 1420079212 , véase [4] , consultado el 19 de junio de 2015. [Puede que no sea el material más necesario para este artículo, pero el contenido significativo aquí está disponible en línea.]
- Jonathan Clayden, Nick Greeves & Stuart Warren, 2012, "Organic Chemistry", Oxford, Oxon, GBR: Oxford University Press, ISBN 0199270295 , ver [5] , consultado el 19 de junio de 2015.
- László Kürti & Barbara Czakó, 2005, "Strategic Applications of Named Reactions in Organic Synthesis: Background and Detail Mechanisms, Amsterdam, NH, NLD: Elsevier Academic Press, 2005ISBN 0124297854, ver [6] , consultado el 19 de junio de 2015.
enlaces externos
- Compuestos + policíclicos en la Biblioteca Nacional de Medicina de EE. UU. Encabezados de temas médicos (MeSH)
- Compuestos macrocíclicos + en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .