Síntesis de péptidos - Peptide synthesis

En química orgánica , la síntesis de péptidos es la producción de péptidos , compuestos en los que se unen múltiples aminoácidos mediante enlaces amida, también conocidos como enlaces peptídicos . Los péptidos se sintetizan químicamente mediante la reacción de condensación del grupo carboxilo de un aminoácido al grupo amino de otro. Las estrategias de grupos protectores suelen ser necesarias para evitar reacciones secundarias indeseables con las diversas cadenas laterales de aminoácidos. La síntesis química de péptidos comienza con mayor frecuencia en el extremo carboxilo del péptido (extremo C) y avanza hacia el extremo amino (extremo N). La biosíntesis de proteínas (péptidos largos) en los organismos vivos ocurre en la dirección opuesta.
La síntesis química de péptidos puede llevarse a cabo utilizando técnicas clásicas en fase de solución, aunque estas han sido reemplazadas en la mayoría de los entornos de investigación y desarrollo por métodos de fase sólida (ver más abajo). Sin embargo, la síntesis en fase de solución conserva su utilidad en la producción a gran escala de péptidos con fines industriales.
La síntesis química facilita la producción de péptidos que son difíciles de expresar en bacterias, la incorporación de aminoácidos no naturales, la modificación del esqueleto de péptidos / proteínas y la síntesis de D-proteínas, que consisten en D-aminoácidos .
Síntesis en fase sólida
El método establecido para la producción de péptidos sintéticos en el laboratorio se conoce como síntesis de péptidos en fase sólida (SPPS). Creado por Robert Bruce Merrifield , SPPS permite el rápido ensamblaje de una cadena de péptidos a través de reacciones sucesivas de derivados de aminoácidos sobre un soporte poroso insoluble.
El soporte sólido consta de pequeñas perlas de resina polimérica funcionalizadas con grupos reactivos (como grupos amina o hidroxilo) que se unen a la cadena peptídica naciente. Dado que el péptido permanece unido covalentemente al soporte durante toda la síntesis, el exceso de reactivos y productos secundarios se puede eliminar mediante lavado y filtración. Este enfoque evita el aislamiento comparativamente lento del péptido producto de la solución después de cada paso de reacción, que sería necesario cuando se usa la síntesis en fase de solución convencional.
Cada aminoácido que se va a acoplar al extremo N-terminal de la cadena peptídica debe protegerse en su extremo N-terminal y en la cadena lateral usando grupos protectores apropiados como Boc (lábil en ácido) o Fmoc (lábil en base), dependiendo de la cadena lateral y la estrategia de protección utilizada (ver más abajo).
El procedimiento general de SPPS es uno de ciclos repetidos de reacciones alternas de desprotección y acoplamiento N-terminal. La resina se puede lavar entre cada paso. Primero se acopla un aminoácido a la resina. Posteriormente, la amina se desprotege y luego se acopla con el ácido libre del segundo aminoácido. Este ciclo se repite hasta que se sintetiza la secuencia deseada. Los ciclos de SPPS también pueden incluir etapas de protección que bloquean la reacción de los extremos de los aminoácidos que no han reaccionado. Al final de la síntesis, el péptido crudo se escinde del soporte sólido mientras que simultáneamente se eliminan todos los grupos protectores usando un reactivo de ácidos fuertes como ácido trifluoroacético o un nucleófilo. El péptido crudo puede precipitarse a partir de un disolvente no polar como éter dietílico para eliminar los subproductos orgánicos solubles. El péptido crudo se puede purificar usando HPLC de fase reversa . El proceso de purificación, especialmente de péptidos más largos, puede ser un desafío, porque deben eliminarse pequeñas cantidades de varios subproductos, que son muy similares al producto. Por esta razón, los llamados procesos de cromatografía continua como MCSGP se utilizan cada vez más en entornos comerciales para maximizar el rendimiento sin sacrificar los niveles de pureza.
El SPPS está limitado por los rendimientos de las reacciones y, por lo general, los péptidos y las proteínas en el rango de 70 aminoácidos están empujando los límites de la accesibilidad sintética. La dificultad sintética también depende de la secuencia; típicamente, las secuencias propensas a la agregación, como los amiloides, son difíciles de producir. Se puede acceder a longitudes más largas utilizando enfoques de ligación como la ligación química nativa , donde dos péptidos sintéticos completamente desprotegidos más cortos se pueden unir en solución.
Reactivos de acoplamiento de péptidos
Una característica importante que ha permitido la amplia aplicación de SPPS es la generación de rendimientos extremadamente altos en la etapa de acoplamiento. Se requieren condiciones de formación de enlaces amida altamente eficientes . y agregar un exceso de cada aminoácido (entre 2 y 10 veces). La minimización de la racemización de aminoácidos durante el acoplamiento también es de vital importancia para evitar la epimerización en el producto peptídico final.
La formación de enlaces amida entre una amina y un ácido carboxílico es lenta y, como tal, normalmente requiere "reactivos de acoplamiento" o "activadores". Existe una amplia gama de reactivos de acoplamiento, debido en parte a su eficacia variable para acoplamientos particulares, muchos de estos reactivos están disponibles comercialmente.
Carbodiimidas
Las carbodiimidas tales como diciclohexilcarbodiimida (DCC) y diisopropilcarbodiimida (DIC) se utilizan con frecuencia para la formación de enlaces amida. La reacción procede a través de la formación de un reactivo altamente O -acyliso urea . Este intermedio reactivo es atacado por el péptido amina N-terminal, formando un enlace peptídico. La formación de la O -acyliso urea procede más rápida en disolventes no polares tales como diclorometano.
DIC es particularmente útil para SPPS ya que como líquido se dispensa fácilmente y el subproducto de urea se elimina fácilmente por lavado. A la inversa, la carbodiimida relacionado 1-etil-3- (3-dimetilaminopropil) carbodiimida (EDC) se utiliza a menudo para acoplamientos de péptidos en fase de solución como su subproducto urea puede ser eliminado por lavado durante acuosa trabajo-up .
La activación de carbodiimida abre la posibilidad de racemización del aminoácido activado. La racemización se puede eludir con aditivos que 'suprimen la racemización' como los triazoles 1-hidroxi-benzotriazol (HOBt) y 1-hidroxi-7-aza-benzotriazol (HOAt). Estos reactivos atacan el intermedio O- acilisourea para formar un éster activo , que posteriormente reacciona con el péptido para formar el enlace peptídico deseado. El cianohidroxiiminoacetato de etilo (Oxyma), un aditivo para el acoplamiento de carbodiimida, actúa como una alternativa al HOAt.
Sales de aminio / uronio y fosfonio
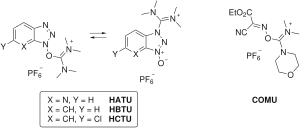
Algunos reactivos de acoplamiento omiten la carbodiimida por completo e incorporan el resto HOAt / HOBt como una sal de aminio / uronio o fosfonio de un anión no nucleófilo ( tetrafluoroborato o hexafluorofosfato ). Ejemplos de reactivos de aminio / uronio incluyen HATU (HOAt), HBTU / TBTU (HOBt) y HCTU (6-ClHOBt). HBTU y TBTU solo se diferencian en la elección del anión. Los reactivos de fosfonio incluyen PyBOP (HOBt) y PyAOP (HOAt).
Estos reactivos forman la misma especie de éster activo que las condiciones de activación de carbodiimida, pero difieren en la velocidad del paso de activación inicial, que está determinada por la naturaleza de la estructura carbonada del reactivo de acoplamiento. Además, los reactivos de aminio / uronio son capaces de reaccionar con el extremo N del péptido para formar un subproducto de guanidino inactivo , mientras que los reactivos de fosfonio no lo son.
Anhídrido del ácido propanofosfónico
Desde finales de la década de 2000, el anhídrido del ácido propanofosfónico , vendido comercialmente con varios nombres como "T3P", se ha convertido en un reactivo útil para la formación de enlaces amida en aplicaciones comerciales. Convierte el oxígeno del ácido carboxílico en un grupo saliente, cuyos subproductos de acoplamiento de péptidos son solubles en agua y se pueden lavar fácilmente. En una comparación del rendimiento entre el anhídrido del ácido propanofosfónico y otros reactivos de acoplamiento de péptidos para la preparación de un fármaco no peptídico, se encontró que este reactivo era superior a otros reactivos en cuanto a rendimiento y baja epimerización.
Soportes sólidos
Los soportes sólidos para la síntesis de péptidos se seleccionan por su estabilidad física, para permitir la rápida filtración de líquidos. Los soportes adecuados son inertes a los reactivos y disolventes utilizados durante la SPPS, aunque deben hincharse en los disolventes utilizados para permitir la penetración de los reactivos y permitir la unión del primer aminoácido.
Los tres tipos principales de soportes sólidos son: soportes tipo gel, soportes tipo superficie y compuestos. Las mejoras en los soportes sólidos utilizados para la síntesis de péptidos mejoran su capacidad para resistir el uso repetido de TFA durante la etapa de desprotección de SPPS. Se utilizan dos resinas primarias, en función de si se desea un ácido carboxílico C-terminal o una amida. La resina de Wang fue, a partir de 1996, la resina más utilizada para péptidos con ácidos carboxílicos C-terminales.
Esquemas de grupos protectores
Como se describió anteriormente, el uso de grupos protectores de cadena lateral y N-terminal es esencial durante la síntesis de péptidos para evitar reacciones secundarias indeseables, tales como el autoacoplamiento del aminoácido activado que conduce a ( polimerización ). Esto competiría con la reacción de acoplamiento del péptido pretendida, dando como resultado un bajo rendimiento o incluso un fracaso total para sintetizar el péptido deseado.
Existen dos esquemas principales de grupos protectores ortogonales para su uso en la síntesis de péptidos en fase sólida: los llamados enfoques Boc / Bzl y Fmoc / t Bu. La estrategia Boc / Bzl utiliza la protección de Boc N-terminal lábil a TFA junto con la protección de la cadena lateral que se elimina utilizando fluoruro de hidrógeno anhidro durante la etapa de escisión final (con escisión simultánea del péptido del soporte sólido). Fmoc / tBu SPPS usa protección Fmoc N-terminal lábil en base , con protección de cadena lateral y un enlace de resina que es lábil en ácido (la escisión ácida final se lleva a cabo mediante tratamiento con TFA).
Ambos enfoques, incluidas las ventajas y desventajas de cada uno, se describen con más detalle a continuación.
Boc / Bzl SPPS
Los métodos más antiguos para la síntesis de péptidos antes del advenimiento de SPSS se basaban en terc- butiloxicarbonilo (abreviado 'Boc') como un grupo protector temporal de α-amino N-terminal. El grupo Boc se elimina con ácido, como ácido trifluoroacético (TFA). Esto forma un grupo amino cargado positivamente en presencia de un exceso de TFA (tenga en cuenta que el grupo amino no está protonado en la imagen de la derecha), que se neutraliza y se acopla al aminoácido activado entrante. La neutralización puede ocurrir antes del acoplamiento o in situ durante la reacción de acoplamiento básica.
El enfoque de Boc / Bzl conserva su utilidad para reducir la agregación de péptidos durante la síntesis. Además, se puede preferir Boc / Bzl SPPS sobre el enfoque de Fmoc / t Bu cuando se sintetizan péptidos que contienen restos sensibles a bases (tales como depsipéptidos ), ya que se requiere tratamiento con base durante la etapa de desprotección de Fmoc (ver más abajo).
Los grupos protectores de cadena lateral permanentes usados durante Boc / Bzl SPPS son típicamente grupos bencilo o basados en bencilo. La eliminación final del péptido del soporte sólido se produce simultáneamente con la desprotección de la cadena lateral utilizando fluoruro de hidrógeno anhidro mediante escisión hidrolítica. El producto final es una sal de fluoruro que es relativamente fácil de solubilizar. Deben añadirse eliminadores como el cresol al HF para evitar que los cationes t -butilo reactivos generen productos no deseados. Una desventaja de este enfoque es el potencial de degradación del péptido por el fluoruro de hidrógeno.
Fmoc / t Bu SPPS

El uso de protección Fmoc N-terminal permite un esquema de desprotección más suave que el utilizado para Boc / Bzl SPPS, y este esquema de protección es verdaderamente ortogonal en condiciones SPPS. La desprotección de Fmoc utiliza una base, típicamente 20 a 50% de piperidina en DMF . Por lo tanto, la amina expuesta es neutra y, en consecuencia, no se requiere neutralización del péptido-resina, como en el caso del enfoque Boc / Bzl. Sin embargo, la falta de repulsión electrostática entre las cadenas de péptidos puede conducir a un mayor riesgo de agregación con Fmoc / t Bu SPPS. Debido a que el grupo fluorenilo liberado es un cromóforo, la desprotección de Fmoc puede controlarse mediante la absorbancia UV de la mezcla de reacción, una estrategia que se emplea en sintetizadores de péptidos automatizados.
La capacidad del grupo Fmoc para escindirse en condiciones básicas relativamente suaves mientras es estable al ácido permite el uso de grupos protectores de cadena lateral como Boc y t Bu que se pueden eliminar en condiciones de escisión final ácida (TFA) más suaves que las utilizadas para escisión final en Boc / Bzl SPPS (HF). Se añaden captadores como agua y triisopropilsilano (TIPS) durante la escisión final para evitar reacciones secundarias con especies catiónicas reactivas liberadas como resultado de la desprotección de la cadena lateral. El péptido bruto resultante se obtiene como una sal de TFA, que es potencialmente más difícil de solubilizar que las sales de fluoruro generadas en Boc SPPS.
Fmoc / t Bu SPPS es menos económico en términos de átomos , ya que el grupo fluorenilo es mucho más grande que el grupo Boc. En consecuencia, los precios de los aminoácidos Fmoc eran altos hasta que en la década de 1990 comenzó el pilotaje a gran escala de uno de los primeros fármacos peptídicos sintetizados, enfuvirtida , cuando la demanda del mercado ajustó los precios relativos de los aminoácidos Fmoc vs Boc.
Otros grupos protectores
Benciloxicarbonilo
El grupo (Z) es otro grupo protector de amina de tipo carbamato, descubierto por Leonidas Zervas a principios de la década de 1930 y generalmente añadido mediante reacción con cloroformiato de bencilo .
Se elimina en condiciones severas usando HBr en ácido acético , o condiciones más suaves de hidrogenación catalítica .
Esta metodología fue utilizada por primera vez en la síntesis de oligopéptidos por Zervas y Max Bergmann en 1932. Por lo tanto, esto se conoció como la síntesis de Bergmann-Zervas, que se caracterizó como "marca de época" y ayudó a establecer la química de péptidos sintéticos como un campo distinto. Constituyó el primer método de laboratorio útil para la síntesis controlada de péptidos, permitiendo la síntesis de péptidos previamente inalcanzables con cadenas laterales reactivas, mientras que los aminoácidos protegidos con Z también se previenen de la racemización .
El uso del método de Bergmann-Zervas siguió siendo la práctica estándar en la química de péptidos durante dos décadas completas después de su publicación, reemplazado por métodos más nuevos (como el grupo protector Boc) a principios de la década de 1950. Hoy en día, aunque se ha utilizado periódicamente para la protección de α-amina, se utiliza mucho más comúnmente para la protección de la cadena lateral.
Alloc y grupos misceláneos
El grupo protector aliloxicarbonilo (aloc) se usa a veces para proteger un grupo amino (o un grupo ácido carboxílico o alcohol) cuando se requiere un esquema de desprotección ortogonal . También se usa a veces cuando se lleva a cabo la formación de péptidos cíclicos sobre resina, donde el péptido está unido a la resina por un grupo funcional de cadena lateral. El grupo Alloc se puede eliminar usando tetraquis (trifenilfosfina) paladio (0) .
Para aplicaciones especiales como pasos sintéticos que implican micromatrices de proteínas , se utilizan grupos protectores a veces denominados "litográficos", que son susceptibles de fotoquímica en una longitud de onda de luz particular y, por lo tanto, pueden eliminarse durante tipos de operaciones litográficas .
Formación de enlaces disulfuro regioselectivos
La formación de múltiples disulfuros nativos sigue siendo un desafío para la síntesis de péptidos nativos mediante métodos en fase sólida. La combinación de cadenas al azar normalmente da como resultado varios productos con enlaces disulfuro no nativos. La formación escalonada de enlaces disulfuro es típicamente el método preferido y se realiza con grupos protectores de tiol. Los diferentes grupos protectores de tiol proporcionan múltiples dimensiones de protección ortogonal. Estas cisteínas protegidas ortogonalmente se incorporan durante la síntesis en fase sólida del péptido. La eliminación sucesiva de estos grupos, para permitir la exposición selectiva de los grupos tiol libres, conduce a la formación de disulfuro de manera escalonada. Se debe considerar el orden de eliminación de los grupos de modo que solo se elimine un grupo a la vez.
Los grupos protectores de tiol usados en la síntesis de péptidos que requieren la formación posterior de un enlace disulfuro regioselectivo deben poseer múltiples características. Primero, deben ser reversibles con condiciones que no afecten a las cadenas laterales desprotegidas. En segundo lugar, el grupo protector debe poder resistir las condiciones de síntesis en fase sólida. En tercer lugar, la eliminación del grupo protector de tiol debe ser tal que deje intactos otros grupos protectores de tiol, si se desea una protección ortogonal. Es decir, la eliminación de PG A no debería afectar a PG B. Algunos de los grupos protectores de tiol comúnmente usados incluyen el acetamidometil (Acm), terc-butil (But), 3-nitro-2-piridina sulfenil (NPYS), 2- grupos piridina-sulfenilo (Pyr) y tritilo (Trt). Es importante destacar que el grupo NPYS puede reemplazar el Acm PG para producir un tiol activado.
Usando este método, Kiso y colaboradores informaron la primera síntesis total de insulina en 1993. En este trabajo, la cadena A de la insulina se preparó con los siguientes grupos protectores en sus cisteínas: CysA6 (But), CysA7 (Acm) y CysA11 (But), dejando a CysA20 desprotegida.
Síntesis de péptidos asistida por microondas
La síntesis de péptidos asistida por microondas se ha utilizado para completar largas secuencias de péptidos con altos grados de rendimiento y bajos grados de racemización.
Sintetizando péptidos largos
El alargamiento escalonado, en el que los aminoácidos se conectan paso a paso a su vez, es ideal para péptidos pequeños que contienen entre 2 y 100 residuos de aminoácidos. Otro método es la condensación de fragmentos , en la que se acoplan fragmentos de péptidos. Aunque el primero puede alargar la cadena peptídica sin racemización , el rendimiento cae si solo se usa en la creación de péptidos largos o muy polares. La condensación de fragmentos es mejor que el alargamiento escalonado para sintetizar péptidos largos sofisticados, pero su uso debe restringirse para proteger contra la racemización. La condensación del fragmento tampoco es deseable ya que el fragmento acoplado debe estar en exceso, lo que puede ser una limitación dependiendo de la longitud del fragmento.
Un nuevo desarrollo para producir cadenas de péptidos más largas es la ligadura química : las cadenas de péptidos no protegidas reaccionan quimioselectivamente en solución acuosa. Un primer producto controlado cinéticamente se reordena para formar el enlace amida. La forma más común de ligadura química nativa utiliza un tioéster de péptido que reacciona con un residuo de cisteína terminal.
Otros métodos aplicables para unir polipéptidos covalentemente en solución acuosa incluyen el uso de inteínas divididas , formación espontánea de enlaces isopeptídicos y ligadura con sortasa .
Con el fin de optimizar la síntesis de péptidos largos , se desarrolló un método en Medicon Valley para convertir secuencias de péptidos . La secuencia previa simple (por ejemplo, lisina (Lysn); ácido glutámico (Glun); (LysGlu) n) que se incorpora en el extremo C-terminal del péptido para inducir una estructura similar a una hélice alfa . Esto puede aumentar potencialmente la vida media biológica , mejorar la estabilidad de los péptidos e inhibir la degradación enzimática sin alterar la actividad farmacológica o el perfil de acción.
Péptidos cíclicos
Sobre ciclación de resina
Los péptidos se pueden ciclar sobre un soporte sólido. Se puede utilizar una variedad de reactivos de ciclación como HBTU / HOBt / DIEA, PyBop / DIEA, PyClock / DIEA. Los péptidos de la cabeza a la cola se pueden preparar sobre el soporte sólido. La desprotección del extremo C-terminal en algún punto adecuado permite la ciclación en resina mediante la formación de un enlace amida con el extremo N desprotegido. Una vez que ha tenido lugar la ciclación, el péptido se escinde de la resina mediante acidólisis y se purifica.
La estrategia para la síntesis en fase sólida de péptidos cíclicos no se limita a la unión a través de cadenas laterales Asp, Glu o Lys. La cisteína tiene un grupo sulfhidrilo muy reactivo en su cadena lateral. Se crea un puente disulfuro cuando un átomo de azufre de una cisteína forma un enlace covalente simple con otro átomo de azufre de una segunda cisteína en una parte diferente de la proteína. Estos puentes ayudan a estabilizar las proteínas, especialmente las secretadas por las células. Algunos investigadores utilizan cisteínas modificadas que utilizan S-acetomidometil (Acm) para bloquear la formación del enlace disulfuro pero preservan la cisteína y la estructura primaria original de la proteína.
Ciclación sin resina
La ciclación fuera de la resina es una síntesis en fase sólida de intermedios clave, seguida de la ciclación clave en la fase de solución, la desprotección final de cualquier cadena lateral enmascarada también se lleva a cabo en la fase de solución. Esto tiene las desventajas de que las eficiencias de la síntesis en fase sólida se pierden en las etapas de la fase de solución, que se requiere la purificación de subproductos, reactivos y material no convertido, y que se pueden formar oligómeros no deseados si está involucrada la formación de macrociclo .
El uso de ésteres de pentafluorofenilo (FDPP, PFPOH) y BOP-Cl son útiles para ciclar péptidos.
Ver también
Referencias
Otras lecturas
- Stewart JM, Young JD (1984). Síntesis de péptidos en fase sólida (2ª ed.). Rockford, IL: Pierce Chemical Company. pag. 91. ISBN 978-0-935940-03-9.
- Kent, Stephen BH (1988). "Síntesis química de péptidos y proteínas". Revisión anual de bioquímica . 57 . Palo Alto, CA: Revisiones anuales. págs. 957–989. doi : 10.1146 / annurev.bi.57.070188.004521 . PMID 3052294 .
- Atherton E, Sheppard RC (1989). Síntesis de péptidos en fase sólida: un enfoque práctico . Oxford, Inglaterra: IRL Press. ISBN 978-0-19-963067-7.
- Chan W, White P, eds. (2000). Síntesis de péptidos en fase sólida Fmoc: un enfoque práctico . Serie de Enfoque Práctico, Número 222. Oxford, Reino Unido: Oxford University Press. ISBN 0199637245. Consultado el 12 de noviembre de 2016 .
- Fields GB (febrero de 2002). "Introducción a la síntesis de péptidos" . Protocolos actuales en la ciencia de las proteínas . Capítulo 18: 18.1.1–18.1.9. doi : 10.1002 / 0471140864.ps1801s26 . ISBN 978-0-471-14086-3. PMC 3564544 . PMID 18429226 .
- Bodanszky, M. (2012). Principios de síntesis de péptidos . Reactividad y estructura: conceptos de química orgánica, volumen 16. Nueva York, NY: Springer Science & Business Media. ISBN 978-3642967634. Consultado el 12 de noviembre de 2016 .
- Bodanszky M, Bodanszky A (2013). La práctica de la síntesis de péptidos . Reactividad y estructura: conceptos de química orgánica, volumen 21. Nueva York, NY: Springer Science & Business Media. ISBN 978-3-642-96835-8. Consultado el 12 de noviembre de 2016 .
- Benoiton NL (2016). Química de la síntesis de péptidos . Boca Raton, FL: CRC Press / Taylor & Frances. ISBN 978-1-4200-2769-3. Consultado el 12 de noviembre de 2016 .
- Laconde G, Desroses M (2016). Protocolos sintéticos Reactivos de acoplamiento en síntesis de amidas . Montpellier, Francia: Helixem. ISBN 978-1-4200-2769-3. Archivado desde el original (blog comercial) el 26 de octubre de 2013 . Consultado el 12 de noviembre de 2016 .