Reacción adversa al medicamento - Adverse drug reaction
| Reacción adversa al medicamento | |
|---|---|
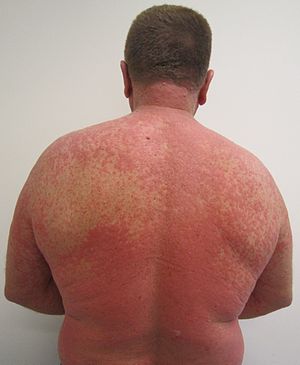 | |
| Un sarpullido debido a una reacción a un medicamento. |
Una reacción adversa a un medicamento ( RAM ) es una lesión causada por la ingesta de medicamentos . Las reacciones adversas pueden ocurrir después de una dosis única o la administración prolongada de un fármaco o como resultado de la combinación de dos o más fármacos. El significado de este término difiere del término " efecto secundario " porque los efectos secundarios pueden ser tanto beneficiosos como perjudiciales. El estudio de las RAM es una preocupación del campo conocido como farmacovigilancia . Un evento adverso por medicamentos ( EAM ) se refiere a cualquier lesión que ocurre en el momento en que se usa un medicamento, ya sea que se identifique o no como la causa de la lesión. Una ADR es un tipo especial de ADE en el que se puede demostrar una relación causal. Las RAM son solo un tipo de daño relacionado con la medicación, ya que también se puede causar daño al omitir la toma de los medicamentos indicados.
Clasificación
Las RAM pueden clasificarse, por ejemplo, por causa y gravedad.
Causa
- Tipo A: efectos farmacológicos aumentados, dependientes de la dosis y predecibles
- Las reacciones de tipo A, que constituyen aproximadamente el 80% de las reacciones adversas al fármaco, suelen ser consecuencia del efecto farmacológico primario del fármaco (p. Ej., Hemorragia cuando se utiliza el anticoagulante warfarina ) o un índice terapéutico bajo del fármaco (p. Ej., Náuseas por digoxina ), y son por tanto predecibles. Están relacionados con la dosis y suelen ser leves, aunque pueden ser graves o incluso mortales (por ejemplo, hemorragia intracraneal por warfarina). Estas reacciones suelen deberse a una dosis inapropiada, especialmente cuando se altera la eliminación del fármaco. El término "efectos secundarios" se aplica a menudo a reacciones menores de tipo A.
- Tipo B : Idiosincrásico
Los tipos A y B se propusieron en la década de 1970, y los otros tipos se propusieron posteriormente cuando los dos primeros resultaron insuficientes para clasificar las RAM.
Gravedad
La Administración de Drogas y Alimentos de EE. UU . Define un evento adverso grave como aquel en el que el resultado del paciente es uno de los siguientes:
- Muerte
- Potencialmente mortal
- Hospitalización (inicial o prolongada)
- Discapacidad: cambio, deterioro, daño o alteración importante, persistente o permanente en la función / estructura corporal, las actividades físicas o la calidad de vida del paciente.
- Anomalía congénita
- Requiere intervención para prevenir deterioro o daño permanente
La gravedad es un punto en una escala arbitraria de intensidad del evento adverso en cuestión. Los términos "grave" y "grave", cuando se aplican a eventos adversos, son técnicamente muy diferentes. Se confunden fácilmente pero no se pueden usar indistintamente, por lo que requieren cuidado al usarlos.
Un dolor de cabeza es severo si causa un dolor intenso. Existen escalas como la "escala analógica visual" que ayudan a los médicos a evaluar la gravedad. Por otro lado, un dolor de cabeza no suele ser grave (pero puede ser en caso de hemorragia subaracnoidea, hemorragia subdural, incluso una migraña puede ajustarse temporalmente a los criterios), a menos que también satisfaga los criterios de gravedad enumerados anteriormente.
Localización
Los efectos adversos pueden ser locales, es decir, limitados a una determinada ubicación, o sistémicos, donde la medicación ha provocado efectos adversos en toda la circulación sistémica .
Por ejemplo, algunos antihipertensivos oculares provocan efectos sistémicos, aunque se administran localmente en forma de colirio , ya que una fracción se escapa a la circulación sistémica.
Mecanismos
A medida que la investigación explica mejor la bioquímica del uso de drogas, menos RAM son de tipo B y más son de tipo A. Los mecanismos comunes son:
- Farmacocinética anormal debido a
- factores genéticos
- estados de enfermedad comórbidos
-
Efectos sinérgicos entre cualquiera
- una droga y una enfermedad
- dos drogas
-
Efectos de antagonismo entre
- una droga y una enfermedad
- dos drogas
Farmacocinética anormal
Estados de enfermedad comórbidos
Varias enfermedades, especialmente las que causan insuficiencia renal o hepática , pueden alterar el metabolismo de los fármacos. Hay recursos disponibles que informan sobre cambios en el metabolismo de un fármaco debido a estados patológicos.
Los criterios de la Herramienta de Adecuación de Medicamentos para Condiciones de Salud Comórbidas en la Demencia ( MATCH-D ) advierten que las personas con demencia tienen más probabilidades de experimentar efectos adversos y que es menos probable que puedan informar los síntomas de manera confiable.
Factores genéticos
El metabolismo anormal de los fármacos puede deberse a factores hereditarios de la oxidación de la fase I o de la conjugación de la fase II. La farmacogenómica es el estudio de la base hereditaria de las reacciones farmacológicas anormales.
Reacciones de fase I
La herencia de alelos anormales del citocromo P450 puede alterar el metabolismo de los fármacos. Hay tablas disponibles para verificar las interacciones de medicamentos debido a las interacciones de P450.
Heredar butirilcolinesterasa anormal ( pseudocolinesterasa ) puede afectar el metabolismo de fármacos como la succinilcolina
Reacciones de fase II
La herencia de N- acetiltransferasa anormal que conjugó algunos fármacos para facilitar la excreción puede afectar el metabolismo de fármacos como isoniazida , hidralazina y procainamida .
La herencia anormal de tiopurina S -metiltransferasa puede afectar el metabolismo de los fármacos tiopurínicos mercaptopurina y azatioprina .
Interacciones con otras drogas
El riesgo de interacciones medicamentosas aumenta con la polifarmacia .
Enlace proteico
Estas interacciones suelen ser transitorias y leves hasta que se alcanza un nuevo estado estable. Estos son principalmente para fármacos sin mucho metabolismo hepático de primer paso. Las principales proteínas plasmáticas para la unión a fármacos son:
- albúmina
- glicoproteína ácida α1
- lipoproteínas
Algunas interacciones farmacológicas con warfarina se deben a cambios en la unión a proteínas.
Citocromo P450
Los pacientes tienen un metabolismo anormal por el citocromo P450 debido a la herencia de alelos anormales o debido a interacciones farmacológicas. Hay tablas disponibles para verificar las interacciones de medicamentos debido a las interacciones de P450.
Efectos sinérgicos
Un ejemplo de sinergismo son dos fármacos que prolongan el intervalo QT .
Evaluar la causalidad
La evaluación de la causalidad se utiliza para determinar la probabilidad de que un fármaco haya causado una sospecha de RAM. Hay varios métodos diferentes utilizados para juzgar la causalidad, incluido el algoritmo de Naranjo , el algoritmo de Venulet y los criterios de evaluación del término de causalidad de la OMS. Cada uno tiene pros y contras asociados con su uso y la mayoría requiere cierto nivel de juicio experto para aplicarse. Una ADR no debe etiquetarse como "segura" a menos que la ADR disminuya con un protocolo de desafío-desafío-desafío (detener y comenzar el agente en cuestión). La cronología del inicio de la sospecha de RAM es importante, ya que otra sustancia o factor puede estar implicado como causa; Los medicamentos recetados conjuntamente y las condiciones psiquiátricas subyacentes pueden ser factores en la RAM.
La asignación de causalidad a un agente específico a menudo resulta difícil, a menos que el evento se encuentre durante un estudio clínico o se utilicen grandes bases de datos. Ambos métodos presentan dificultades y pueden estar plagados de errores. Incluso en los estudios clínicos, es posible que se pasen por alto algunas reacciones adversas, ya que se requiere un gran número de personas de prueba para encontrar esa reacción adversa al fármaco. Las reacciones adversas psiquiátricas a menudo se pasan por alto, ya que se agrupan en los cuestionarios que se utilizan para evaluar a la población.
Órganos de seguimiento
Muchos países tienen organismos oficiales que controlan la seguridad y las reacciones de los medicamentos. A nivel internacional, la OMS dirige el Centro de Monitoreo de Uppsala y la Unión Europea dirige la Agencia Europea de Medicamentos (EMA). En los Estados Unidos , la Administración de Alimentos y Medicamentos (FDA) es responsable de monitorear los estudios posteriores a la comercialización. En Canadá, la Dirección de Productos Sanitarios Comercializados de Health Canada es responsable de la vigilancia de los productos sanitarios comercializados. En Australia , la Administración de Productos Terapéuticos (TGA) realiza un seguimiento posterior a la comercialización de los productos terapéuticos. En el Reino Unido, el sistema de tarjetas amarillas se estableció en 1963.
Epidemiología
Un estudio de la Agencia para la Investigación y la Calidad de la Atención Médica (AHRQ) encontró que en 2011, los sedantes y los hipnóticos fueron una fuente principal de eventos adversos relacionados con los medicamentos en el entorno hospitalario. Aproximadamente el 2,8% de todos los AAM presentes al ingreso y el 4,4% de los que se originaron durante la estancia hospitalaria fueron causados por un sedante o hipnótico. Un segundo estudio realizado por la AHRQ encontró que en 2011, las causas identificadas específicamente más comunes de eventos adversos de medicamentos que se originaron durante las estadías en el hospital en los EE. UU. Fueron los esteroides, antibióticos, opiáceos / narcóticos y anticoagulantes. Los pacientes tratados en hospitales universitarios urbanos tenían tasas más altas de AAM con antibióticos y opiáceos / narcóticos en comparación con los tratados en hospitales urbanos no docentes. Aquellos tratados en hospitales privados sin fines de lucro tuvieron tasas más altas de la mayoría de las causas de EAM en comparación con los pacientes tratados en hospitales públicos o privados con fines de lucro.
En los EE. UU., Las mujeres tuvieron una mayor tasa de efectos adversos adversos relacionados con opiáceos y narcóticos que los hombres en 2011, mientras que los pacientes masculinos tuvieron una mayor tasa de efectos adversos anticoagulantes. Casi 8 de cada 1000 adultos de 65 años o más experimentaron uno de los cuatro AAM más comunes (esteroides, antibióticos, opiáceos / narcóticos y anticoagulantes) durante la hospitalización. Un estudio mostró que el 48% de los pacientes tuvo una reacción adversa a un fármaco a al menos un fármaco, y la participación del farmacéutico ayuda a detectar reacciones adversas al fármaco.
En 2012 McKinsey & Co. llegó a la conclusión de que el costo de los 35 millones de eventos farmacológicos adversos evitables ascendería a 115.000 millones de dólares.
Ver también
- Presuntos problemas en el proceso de aprobación de medicamentos
- Clasificación de referencias farmacoterapéuticas
- Problemas de farmacoterapia
- EudraVigilance ( Unión Europea )
- Historia de la farmacia
- Iatrogénesis
- Dosis letal
- Lista de medicamentos retirados
- Reacción paradójica
- Polifarmacia
- Toxicidad
- Toxicología
- La Carta Médica sobre Medicamentos y Terapéutica
- Régimen de tarjetas amarillas (Reino Unido)
Referencias
Otras lecturas
- Incidencia de reacciones adversas a medicamentos en pacientes positivos al virus de la inmunodeficiencia humana que utilizan terapia antirretroviral de gran actividad PMC 3312730
enlaces externos
| Clasificación |
|---|
