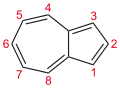
Azuleno - Azulene
|
|
|||
| Nombres | |||
|---|---|---|---|
|
Nombre IUPAC preferido
Azuleno |
|||
|
Nombre IUPAC sistemático
Biciclo [5.3.0] decapentaeno |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| CHEBI | |||
| ChemSpider | |||
| Tarjeta de información ECHA |
100.005.449 |
||
| KEGG | |||
|
PubChem CID
|
|||
| UNII | |||
|
Tablero CompTox ( EPA )
|
|||
|
|||
|
|||
| Propiedades | |||
| C 10 H 8 | |||
| Masa molar | 128,174 g · mol −1 | ||
| Punto de fusion | 99 a 100 ° C (210 a 212 ° F; 372 a 373 K) | ||
| Punto de ebullición | 242 ° C (468 ° F; 515 K) | ||
| -98,5 · 10 −6 cm 3 / mol
g / l |
|||
| Termoquímica | |||
| −1266,5 kcal / mol | |||
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referencias de Infobox | |||
El azuleno es un compuesto orgánico y un isómero de naftaleno . Mientras que el naftaleno es incoloro, el azuleno es azul oscuro. Dos terpenoides, vetivazuleno (4,8-dimetil-2-isopropilazuleno) y guaiazuleno (1,4-dimetil-7-isopropilazuleno), que presentan el esqueleto de azuleno, se encuentran en la naturaleza como componentes de pigmentos en hongos, aceite de madera de guayaco y algunos invertebrados marinos.
Azulene tiene una larga historia, que se remonta al siglo XV como el cromóforo azul celeste obtenido por destilación al vapor de la manzanilla alemana . El cromóforo fue descubierto en milenrama y ajenjo y fue nombrado en 1863 por Septimus Piesse. Su estructura fue reportada por primera vez por Lavoslav Ružička , seguida de su síntesis orgánica en 1937 por Placidus Plattner.
Estructura y vinculación

El azuleno generalmente se considera el resultado de la fusión de los anillos de ciclopentadieno y cicloheptatrieno . Al igual que el naftaleno y el ciclodecapentaeno , es un sistema de electrones de 10 pi . Presenta propiedades aromáticas : (i) los enlaces periféricos tienen longitudes similares y (ii) sufre sustituciones similares a Friedel-Crafts . Se estima que la ganancia de estabilidad de la aromaticidad es la mitad que la del naftaleno.
Su momento dipolar es 1.08 D , en contraste con la naftaleno, que tiene un momento dipolar de cero. Esta polaridad puede explicarse por respecto azuleno como la fusión de un 6 π-electrones anión ciclopentadienilo y un 6 π-electrones tropilio catión : un electrón del anillo de siete miembros se transfiere al anillo de cinco miembros para dar a cada anillo de estabilidad aromático por la regla de Hückel . Los estudios de reactividad confirman que el anillo de siete miembros es electrofílico y el anillo de cinco miembros es nucleofílico .
La naturaleza dipolar del estado fundamental se refleja en su color profundo, que es inusual para pequeños compuestos aromáticos insaturados. Otra característica notable del azuleno es que viola la regla de Kasha al exhibir fluorescencia desde un estado de excitación superior (S 2 → S 0 ).
Síntesis orgánica
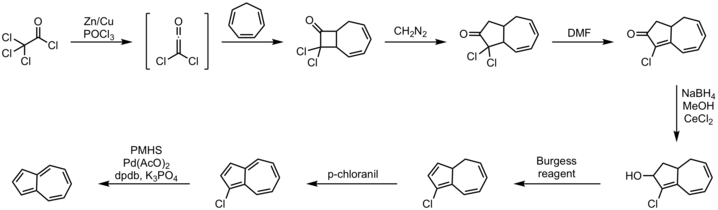
Las rutas sintéticas al azuleno han sido de interés durante mucho tiempo debido a su estructura inusual. En 1939, St. Pfau y Plattner informaron sobre el primer método a partir de indano y diazoacetato de etilo .
Un eficiente de un solo recipiente ruta implica anulación de ciclopentadieno con C insaturado 5 - sintones . El enfoque alternativo del cicloheptatrieno se conoce desde hace mucho tiempo, y a continuación se muestra un método ilustrativo.
Procedimiento:
- cicloheptatrieno 2 + 2 cicloadición con dicloro cetena
- reacción de inserción de diazometano
- reacción de deshidrohalogenación con DMF
- Luche reducción a alcohol con borohidruro de sodio
- reacción de eliminación con reactivo de Burgess
- oxidación con p-cloranil
- deshalogenación con polimetilhidrosiloxano , acetato de paladio (II) , fosfato de potasio y el ligando DPDB
Complejos organometálicos
En la química organometálica , el azuleno sirve como ligando para los centros metálicos de baja valencia, que de otro modo se sabe que forman complejos π con ligandos de ciclopentadienilo y cicloheptatrienilo. Los complejos ilustrativos son (azuleno) Mo 2 (CO) 6 y (azuleno) Fe 2 (CO) 5 .
Compuestos relacionados
El 1-hidroxiazuleno es un aceite verde inestable y no muestra tautomería ceto-enólica . El 2-hidroxiazuleno se obtiene por hidrólisis de 2-metoxiazuleno con ácido bromhídrico. Es estable y muestra tautomería ceto-enólica. El p K a del 2-hidroxiazuleno en agua es 8,71. Es más ácido que el fenol o el naftol . El p K a de los 6-hidroxiazulenos en el agua es de 7,38, lo que lo hace también más ácido que el fenol o el naftol.
En el naft [ a ] azuleno, se condensa un anillo de naftaleno en las posiciones 1,2 del azuleno. En uno de estos sistemas, la deformación por planicidad se encuentra similar a la del tetrahelicene .
El guaiazuleno (1,4-dimetil-7-isopropilazuleno) es un derivado alquilado del azuleno con un color azul intenso casi idéntico. Está disponible comercialmente para la industria cosmética donde funciona como agente acondicionador de la piel.