Ciclodecapentaeno - Cyclodecapentaene
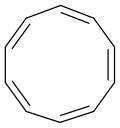 isómero todo cis de ciclodecapentaeno
|
|
| Nombres | |
|---|---|
|
Nombre IUPAC preferido
Ciclodeca-1,3,5,7,9-pentaeno |
|
| Otros nombres
[10] Anuleno
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
|
PubChem CID
|
|
|
|
|
|
| Propiedades | |
| C 10 H 10 | |
| Masa molar | 130.190 g · mol −1 |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
| Referencias de Infobox | |
El ciclodecapentaeno o [10] anuleno es un anuleno con fórmula molecular C 10 H 10 . Este compuesto orgánico es un sistema cíclico conjugado de 10 electrones pi y, de acuerdo con la regla de Huckel, debería mostrar aromaticidad . Sin embargo, no es aromático porque varios tipos de tensión de anillo desestabilizan una geometría totalmente plana. El isómero todo cis ( 1 ), un decágono completamente convexo , tendría ángulos de enlace de 144 °, lo que crea grandes cantidades de deformación angular en relación con los 120 ° ideales para la hibridación atómica sp 2 . En cambio, el isómero todo cis puede adoptar una conformación plana parecida a un barco ( 2 ) para aliviar la deformación del ángulo. Esto todavía es inestable debido a la tensión relativamente más alta en forma de bote en comparación con el siguiente isómero trans, cis, trans, cis, cis planar ( 3 ). Sin embargo, incluso este isómero también es inestable y sufre de repulsión estérica entre los dos átomos de hidrógeno internos. El isómero trans, cis, cis, cis, cis no plano ( 4 ) es el más estable de todos los isómeros posibles.
El compuesto de [10] anuleno se puede obtener mediante fotólisis de cis -9,10-dihidronaftaleno como una mezcla de isómeros. Debido a su falta de estabilidad incluso a bajas temperaturas, los productos de reacción vuelven al dihidronaftaleno original.
La aromaticidad se puede inducir en compuestos que tienen un núcleo de tipo anuleno mediante la fijación de las geometrías planas. Existen dos métodos para lograrlo. Una forma es reemplazar dos átomos de hidrógeno por un puente de metileno (- CH
2 -) da el 1,6-metano [10] anuleno bicíclico planar ( 5 ). Este compuesto es aromático, como lo indica la falta de alternancia de la longitud del enlace observada en su estructura de rayos X y la evidencia de una corriente de anillo diamagnético reveladora en su espectro de RMN .
Una síntesis orgánica clásica de este compuesto comienza con una reducción de Birch de naftaleno a tetrahidronaftaleno (o isotetralina), seguida de la adición de carbeno de diclorocarbeno (preparado in situ a partir de cloroformo y la sal de potasio de terc- butanol ) seguida de una segunda reducción orgánica. que elimina los sustituyentes cloruro y concluye con la oxidación orgánica por 2,3-dicloro-5,6-diciano-1,4-benzoquinona (DDQ).
Otra forma de restaurar la planicidad, y por lo tanto la aromaticidad, en los anillos de [10] anuleno es la incorporación de un puente de metino a una estructura del núcleo de [10] anuleno tricíclico ( 6 ). Cuando se desprotona para formar el anión, este tipo de compuesto se estabiliza aún más. El carbanión central hace que la molécula sea aún más plana y el número de estructuras de resonancia que se pueden dibujar se amplía a 7 incluidas dos formas de resonancia con un anillo de benceno completo. Por química computacional se demuestra que la tricíclico [10] anuleno derivado con un annulated anillo de benceno y un conjunto completo de ciano sustituyentes ( 7 ) es uno de los más compuestos ácidos conocidos con un computarizada p K una en DMSO de -30,4 (comparado a, por ejemplo, -20 para ácido mágico ).
El azuleno es también un sistema de 10 electrones π en el que la aromaticidad se mantiene mediante un enlace transanular directo para formar una molécula bicíclica 7-5 fusionada .

![[10] anulenos](https://upload.wikimedia.org/wikipedia/commons/thumb/4/46/10-annulene.svg/600px-10-annulene.svg.png)
