Transaminación - Transamination
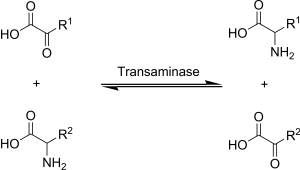
Transaminación , una reacción química que transfiere un grupo amino a un cetoácido para formar nuevos aminoácidos. Esta vía es responsable de la desaminación de la mayoría de los aminoácidos. Esta es una de las principales vías de degradación que convierten aminoácidos esenciales a aminoácidos no esenciales (amino ácidos que pueden ser sintetizados de novo por el organismo).
La transaminación en bioquímica se logra mediante enzimas llamadas transaminasas o aminotransferasas. El α-cetoglutarato actúa como el aceptor de grupos amino predominante y produce glutamato como el nuevo aminoácido.
- Aminoácido + α-cetoglutarato ↔ α-cetoácido + glutamato
El grupo amino del glutamato, a su vez, se transfiere a oxaloacetato en una segunda reacción de transaminación que produce aspartato.
Mecanismo de acción
La transaminación catalizada por aminotransferasa ocurre en dos etapas. En el primer paso, el grupo α amino de un aminoácido se transfiere a la enzima, produciendo el α-cetoácido correspondiente y la enzima aminada. Durante la segunda etapa, el grupo amino se transfiere al aceptor de cetoácido, formando el producto de aminoácido mientras se regenera la enzima. La quiralidad de un aminoácido se determina durante la transaminación. Para que la reacción se complete, las aminotransferasas requieren la participación de la coenzima que contiene aldehído, piridoxal-5'-fosfato (PLP) , un derivado de la piridoxina ( vitamina B 6 ). El grupo amino se aloja mediante la conversión de esta coenzima en piridoxamina-5'-fosfato (PMP). El PLP se une covalentemente a la enzima a través de un enlace de base de Schiff formado por la condensación de su grupo aldehído con el grupo ε-amino de un residuo Lys enzimático . La base de Schiff, que está conjugada con el anillo de piridinio de las enzimas, es el foco de la actividad de la coenzima.
-
El producto de las reacciones de transaminación depende de la disponibilidad de α-cetoácidos. Los productos suelen ser alanina , aspartato o glutamato , ya que sus alfa-cetoácidos correspondientes se producen mediante el metabolismo de los combustibles. Al ser una de las principales vías de degradación de los aminoácidos, la lisina , la prolina y la treonina son los únicos tres aminoácidos que no siempre se someten a transaminación y utilizan la deshidrogenasa respectiva.
 Ping Pong Bi Bi mecanismo de transaminación catalizada por enzimas dependientes de PLP. La reacción de las aminotransferasas se produce en dos etapas que constan de tres pasos: transiminación, tautomerización e hidrólisis. En la primera etapa, el grupo alfa amino del aminoácido se transfiere a PLP produciendo un alfa cetoácido y PMP. En la segunda etapa de la reacción, en la que el grupo amino de PMP se transfiere a un alfa cetoácido diferente para producir un nuevo alfa aminoácido y PLP.
Ping Pong Bi Bi mecanismo de transaminación catalizada por enzimas dependientes de PLP. La reacción de las aminotransferasas se produce en dos etapas que constan de tres pasos: transiminación, tautomerización e hidrólisis. En la primera etapa, el grupo alfa amino del aminoácido se transfiere a PLP produciendo un alfa cetoácido y PMP. En la segunda etapa de la reacción, en la que el grupo amino de PMP se transfiere a un alfa cetoácido diferente para producir un nuevo alfa aminoácido y PLP. - Mecanismo alternativo
- Un segundo tipo de reacción de transaminación puede describirse como una sustitución nucleófila de un anión amina o amida en una amina o sal de amonio. Por ejemplo, el ataque de una amina primaria por un anión de amida primaria se puede utilizar para preparar aminas secundarias:
- RNH 2 + R'NH - → RR'NH + NH 2 -
- Se pueden preparar aminas secundarias simétricas usando níquel Raney (2RNH 2 → R 2 NH + NH 3 ). Y finalmente, las sales de amonio cuaternario se pueden desalquilar utilizando etanolamina:
- R 4 N + + NH 2 CH 2 CH 2 OH → R 3 N + RN + H 2 CH 2 CH 2 OH
- Los aminonaftalenos también se someten a transaminaciones. [2]
Tipos de aminotransferasa
La transaminación está mediada por varias enzimas aminotransferasas diferentes. Estos pueden ser específicos para aminoácidos individuales o pueden procesar un grupo de otros químicamente similares. Esto último se aplica al grupo de los aminoácidos de cadena ramificada, que comprende leucina, isoleucina y valina. Los dos tipos comunes de aminotransferasas son la alanina aminotransferasa (ALT) y la aspartato aminotransferasa (AST).
Referencias
• Smith, MB y March, J. Química orgánica avanzada: reacciones, mecanismos y estructura, 5ª ed. Wiley, 2001, pág. 503. ISBN 0-471-58589-0 • Gerald Booth "Derivados de naftaleno" en la Enciclopedia de Química Industrial de Ullmann, 2005, Wiley-VCH, Weinheim. doi: 10.1002 / 14356007.a17_009
Voet y Voet. "Bioquímica" Cuarta edición
