Síndrome de Kearns-Sayre - Kearns–Sayre syndrome
| Síndrome de Kearns-Sayre | |
|---|---|
| Otros nombres | Trastorno oculocraniosomático o trastorno neuromuscular oculocraniosomático con fibras rojas rasgadas |
| Especialidad |
Oftalmología |
El síndrome de Kearns-Sayre ( KSS), trastorno oculocraniosomático o trastorno neuromuscular oculocranionsomático con fibras rojas rasgadas , es una miopatía mitocondrial con un inicio típico antes de los 20 años de edad. El KSS es una variante sindrómica más grave de la oftalmoplejía externa progresiva crónica (abreviado CPEO), un síndrome que se caracteriza por la afectación aislada de los músculos que controlan el movimiento del párpado (elevador palpebral, orbicular de los párpados) y del ojo (músculos extraoculares). Esto resulta en ptosis y oftalmoplejía respectivamente. KSS implica una combinación del CPEO ya descrito, así como retinopatía pigmentaria en ambos ojos y anomalías de la conducción cardíaca . Otros síntomas pueden incluir ataxia cerebelosa , debilidad muscular proximal, sordera , diabetes mellitus , deficiencia de la hormona del crecimiento , hipoparatiroidismo y otras endocrinopatías . En ambas enfermedades, la afectación muscular puede comenzar de forma unilateral, pero siempre se convierte en un déficit bilateral y el curso es progresivo. Esta discusión se limita específicamente a la variante más severa y sistémicamente involucrada.
Signos y síntomas
Los individuos con KSS se presentan inicialmente de manera similar a aquellos con CPEO típico. El inicio es en la primera y segunda décadas de la vida.
El primer síntoma de esta enfermedad es una ptosis unilateral , o dificultad para abrir los párpados, que progresa gradualmente a una ptosis bilateral. A medida que la ptosis empeora, el individuo suele extender el cuello y elevar el mentón en un intento de evitar que los párpados ocluyan el eje visual. Junto con el desarrollo insidioso de la ptosis, los movimientos oculares eventualmente se vuelven limitados, lo que hace que la persona dependa más de girar la cabeza de lado a lado o hacia arriba y hacia abajo para ver objetos en el campo visual periférico .
Retinopatía pigmentaria
KSS da como resultado una pigmentación de la retina , principalmente en el fondo de ojo posterior . La apariencia se describe como una apariencia de "sal y pimienta". Hay despigmentación difusa del epitelio pigmentario de la retina y el mayor efecto se produce en la mácula . Esto contrasta con la retinosis pigmentaria, donde la pigmentación es periférica. La apariencia de la retina en KSS es similar a la que se observa en la distrofia miotónica tipo 1 (abreviada DM1). Se puede observar ceguera nocturna moderada en pacientes con KSS. La pérdida de agudeza visual suele ser leve y solo ocurre en 40 a 50% de los pacientes.
Anomalías de la conducción cardíaca
Estos ocurren con mayor frecuencia años después del desarrollo de ptosis y oftalmoplejía. El bloqueo auriculoventricular (abreviado "AV") es el déficit de conducción cardíaca más común. Esto a menudo progresa a un bloqueo auriculoventricular de tercer grado , que es un bloqueo completo de la conducción eléctrica desde la aurícula hasta el ventrículo. Los síntomas del bloqueo cardíaco incluyen síncope , intolerancia al ejercicio y bradicardia .
Deficiencia de folato cerebral
Los pacientes de Kearns-Sayre presentan de manera constante una deficiencia de folato cerebral , un síndrome en el que los niveles de 5-MTHF disminuyen en el líquido cefalorraquídeo a pesar de ser normales en suero. En algunos casos, el tratamiento con ácido folínico puede aliviar los síntomas asociados y corregir parcialmente las anomalías cerebrales asociadas, especialmente si se inicia al principio de la enfermedad. La causa propuesta de la deficiencia de folato cerebral en el síndrome de Kearns-Sayre es la falla de los mecanismos en el plexo coroideo que son responsables del paso de folatos del suero al líquido cefalorraquídeo.
Causa y prevalencia
Como se caracteriza en la publicación original de Kearns en 1965 y en publicaciones posteriores, las características inconsistentes de KSS que pueden ocurrir son debilidad de los músculos faciales, faríngeos, del tronco y de las extremidades, pérdida de audición , baja estatura, cambios electroencefalográficos, ataxia cerebelosa y niveles elevados de sangre cerebroespinal. proteína fluida .
El síndrome de Kearns-Sayre se produce de forma espontánea en la mayoría de los casos. En algunos casos, se ha demostrado que se hereda mediante herencia mitocondrial, autosómica dominante o autosómica recesiva. No hay predilección por la raza o el sexo, y no se conocen factores de riesgo. En 1992, solo se informaron 226 casos en la literatura publicada. Aunque los NIH y otros estudios estiman que la ocurrencia en la población es de 1 a 3 y algunos tan altos como 9 de cada 100,000 personas, es común que no se lo derive a los centros especializados y no se reconozcan los síntomas de la enfermedad.
Genética
KSS es el resultado de deleciones en el ADN mitocondrial (ADNmt) que causan una constelación particular de signos y síntomas médicos . El mtDNA se transmite exclusivamente a partir del óvulo de la madre. El ADN mitocondrial está compuesto por 37 genes que se encuentran en el cromosoma circular único que mide 16,569 pares de bases de longitud. Entre estos, 13 genes codifican proteínas de la cadena de transporte de electrones (abreviado "ETC"), 22 codifican ARN de transferencia (ARNt) y dos codifican las subunidades grandes y pequeñas que forman el ARN ribosómico (ARNr). Las 13 proteínas implicadas en la ETC de la mitocondria son necesarias para la fosforilación oxidativa . Las mutaciones en estas proteínas dan como resultado una producción de energía deficiente por parte de las mitocondrias. Este déficit de energía celular se manifiesta más fácilmente en tejidos que dependen en gran medida del metabolismo aeróbico, como el cerebro, los músculos esqueléticos y cardíacos, los órganos sensoriales y los riñones. Este es un factor involucrado en la presentación de enfermedades mitocondriales.
Hay otros factores involucrados en la manifestación de una enfermedad mitocondrial además del tamaño y la ubicación de una mutación. Las mitocondrias se replican durante cada división celular durante la gestación y durante toda la vida. Debido a que la mutación en la enfermedad mitocondrial ocurre con mayor frecuencia al comienzo de la gestación en estas enfermedades, solo las mitocondrias en el linaje mutado son defectuosas. Esto da como resultado una distribución desigual de mitocondrias disfuncionales dentro de cada célula y entre diferentes tejidos del cuerpo. Esto describe el término heteroplasmático que es característico de las enfermedades mitocondriales, incluido el KSS. La distribución del ADNmt mutado en cada célula, tejido y órgano depende de cuándo y dónde ocurre la mutación. Esto puede explicar por qué dos pacientes con una mutación idéntica en el mtDNA pueden presentar fenotipos completamente diferentes y, a su vez, síndromes diferentes. Una publicación de 1992 de Fischel-Ghodsian et al. identificaron la misma deleción de 4.977 pb en el ADNmt en dos pacientes que presentaban dos enfermedades completamente diferentes. Uno de los pacientes tenía KSS característico, mientras que el otro paciente tenía una enfermedad muy diferente conocida como síndrome del páncreas medular de Pearson . Para complicar el asunto, en algunos casos se ha demostrado que el síndrome de Pearson progresa a KSS más adelante en la vida.
Estudios más recientes han concluido que las duplicaciones de mtDNA también pueden desempeñar un papel importante en la determinación de qué fenotipo está presente. Las duplicaciones de mtDNA parecen ser características de todos los casos de KSS y síndrome de Pearson, mientras que están ausentes en CPEO.
Las deleciones de mtDNA en KSS varían en tamaño (1,3 a 8 kb), así como en su posición en el genoma mitocondrial . La deleción más común es de 4,9 kb y se extiende desde la posición 8469 hasta la posición 13147 en el genoma . Esta eliminación está presente en aproximadamente ⅓ de las personas con KSS {{}}
Diagnóstico
Un neurooftalmólogo generalmente está involucrado en el diagnóstico y manejo del KSS. Se debe sospechar que un individuo tiene KSS según los hallazgos del examen clínico. La sospecha de miopatías debe aumentar en pacientes cuya oftalmoplejía no se corresponde con un conjunto particular de parálisis de pares craneales (parálisis del nervio motor ocular común , parálisis del cuarto par , parálisis del sexto par ). Inicialmente, a menudo se realizan estudios de imagen para descartar patologías más comunes. El diagnóstico se puede confirmar con una biopsia muscular y se puede complementar con la determinación por PCR de las mutaciones del mtDNA.
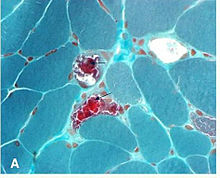
Hallazgos de biopsia
No es necesario realizar una biopsia de un músculo ocular para demostrar anomalías histopatológicas. La sección transversal de las fibras musculares teñidas con la tinción tricrómica de Gömöri se observa mediante microscopía óptica . En las fibras musculares que contienen proporciones elevadas de mitocondrias mutadas, existe una mayor concentración de mitocondrias. Esto le da a estas fibras un color rojo más oscuro, lo que hace que el aspecto general de la biopsia se describa como " fibras rojas irregulares . También se pueden demostrar anomalías en muestras de biopsia muscular mediante otros estudios histoquímicos, como tinciones de enzimas mitocondriales, por microscopía electrónica, análisis bioquímicos del tejido muscular (es decir, actividades enzimáticas de la cadena de transporte de electrones) y mediante el análisis del ADN mitocondrial del músculo ".
Estudios de laboratorio
Los niveles de lactato y piruvato en sangre suelen estar elevados como resultado del aumento del metabolismo anaeróbico y una disminución de la relación ATP : ADP . El análisis del LCR muestra un nivel elevado de proteínas, por lo general> 100 mg / dl, así como un nivel elevado de lactato.
Gestión
Actualmente no existe un tratamiento curativo para KSS. Debido a que es una afección poco común, solo hay informes de casos de tratamientos con muy pocos datos que respalden su efectividad. Se han informado varios descubrimientos prometedores que pueden respaldar el descubrimiento de nuevos tratamientos con más investigación. Las células satélite son responsables de la regeneración de las fibras musculares. Se ha observado que el mtDNA mutante es raro o indetectable en células satélite cultivadas de pacientes con KSS. Shoubridge y col. (1997) plantearon la cuestión de si el mtDNA de tipo salvaje podría restaurarse en el tejido muscular fomentando la regeneración muscular. En el estudio antes mencionado, se tomaron muestras de fibras musculares en regeneración en el sitio de la biopsia original y se encontró que eran esencialmente homoplásmicas para el ADNmt de tipo salvaje. Quizás con las futuras técnicas de promoción de la regeneración de las células musculares y la proliferación de las células satélite, el estado funcional de los pacientes con KSS podría mejorarse enormemente.
Un estudio describió a un paciente con KSS que tenía niveles séricos reducidos de coenzima Q10 . La administración de 60 a 120 mg de coenzima Q10 durante 3 meses dio como resultado la normalización de los niveles de lactato y piruvato , mejoría del bloqueo AV de primer grado diagnosticado previamente y mejoría de los movimientos oculares.
Se recomienda un ECG de detección en todos los pacientes que presentan CPEO. En KSS, se recomienda la implantación de marcapasos tras el desarrollo de una enfermedad de conducción significativa, incluso en pacientes asintomáticos.
Se deben realizar pruebas de detección de trastornos endocrinológicos, incluida la medición de los niveles de glucosa en suero , pruebas de función tiroidea , niveles de calcio y magnesio y niveles de electrolitos en suero . El hiperaldosteronismo se observa en el 3% de los pacientes con SK.
Historia
La tríada de CPEO, retinopatía pigmentaria bilateral y anomalías de la conducción cardíaca fue descrita por primera vez en un informe de caso de dos pacientes en 1958 por Thomas P. Kearns (1922-2011), MD., Y George Pomeroy Sayre (1911-1992), MD. . Un segundo caso fue publicado en 1960 por Jager y sus coautores que informaron sobre estos síntomas en un niño de 13 años. Se habían publicado casos previos de pacientes con CPEO que fallecían repentinamente, ocasionalmente documentados como por una arritmia cardíaca. Otros casos habían notado una pigmentación peculiar de la retina, pero ninguna de estas publicaciones había documentado que estas tres patologías ocurrieran juntas como un síndrome genético. Kearns publicó un caso definitorio en 1965 que describe 9 casos no relacionados con esta tríada. En 1988, se hizo la primera conexión entre KSS y deleciones a gran escala del ADN mitocondrial del músculo (mtDNA abreviado). Desde este descubrimiento, numerosas deleciones en el ADN mitocondrial se han relacionado con el desarrollo de KSS.
Referencias
enlaces externos
- kearns_sayre en NINDS
- Síndrome de Kearns Sayre en la Oficina de Enfermedades Raras de los NIH
| Clasificación | |
|---|---|
| Recursos externos |