Síndrome del corazón izquierdo hipoplásico - Hypoplastic left heart syndrome
| Síndrome del corazón izquierdo hipoplásico | |
|---|---|
| Otros nombres | Enfermedad cardíaca cianótica: corazón izquierdo hipoplásico |
 | |
| Ilustración del corazón que sufre de síndrome del corazón izquierdo hipoplásico | |
| Especialidad |
Cardiología |
El síndrome del corazón izquierdo hipoplásico ( HLHS ) es un defecto cardíaco congénito poco común en el que el lado izquierdo del corazón está gravemente subdesarrollado. Puede afectar el ventrículo izquierdo , la aorta , la válvula aórtica o la válvula mitral .
Signos y síntomas
El cierre del conducto arterioso en un corazón que está severamente subdesarrollado en el lado izquierdo da como resultado cianosis y dificultad respiratoria que pueden progresar a choque cardiogénico y muerte. Los primeros síntomas son la cianosis que no responde a la administración de oxígeno o la mala alimentación. Los pulsos periféricos pueden ser débiles y las extremidades frías al tacto.
El HLHS a menudo coexiste con el bajo peso al nacer y el nacimiento prematuro.
En los recién nacidos con un pequeño defecto del tabique auricular, denominado "restrictivo", hay una mezcla inadecuada de sangre oxigenada y desoxigenada. Estos recién nacidos se descompensan rápidamente y desarrollan acidosis y cianosis.
En el electrocardiograma, la desviación del eje a la derecha y la hipertrofia ventricular derecha son comunes, pero no indicativos de HLHS. La radiografía de tórax puede mostrar un corazón grande ( cardiomegalia ) o aumento de la vasculatura pulmonar. Los recién nacidos con HLHS no suelen tener un soplo cardíaco , pero en algunos casos, puede ser audible un soplo de flujo pulmonar o un soplo de regurgitación tricuspídea .
La insuficiencia tricuspídea concurrente o la disfunción del ventrículo derecho pueden provocar el desarrollo de hepatomegalia .
Causas
No hay una causa conocida en la mayoría de los casos de HLHS. Algunos casos pueden tener un componente genético, ya que se ha demostrado que el HLHS es hereditario y está asociado con mutaciones genéticas específicas.
No todos, pero algunos, los casos de estenosis aórtica en un feto pueden ejercer presión sobre el ventrículo izquierdo en el útero, lo que eventualmente puede conducir a una disminución de la perfusión y detener el crecimiento del ventrículo izquierdo.
Causas ambientales
En un análisis retrospectivo de más de 1300 recién nacidos (nacidos entre 1996 y 2006) de 24 hospitales de niños en los Estados Unidos, los investigadores del Hospital de Niños de Cincinnati en Ohio encontraron que los bebés nacidos en los meses de verano tenían más probabilidades de desarrollar HLHS, lo que sugiere que la estacionalidad y el entorno los factores pueden jugar un papel importante en la causalidad.
Genética
Los loci genéticos asociados con HLHS incluyen GJA1 (conexina 43) , HAND1 , NKX2.5 , 10q22 y 6q23. Existe un ligero riesgo de recurrencia en embarazos futuros, estimado en 2-4%, que aumenta al 25% en familias con dos hijos afectados. Se cree que esto está mediado por mutaciones genéticas con penetrancia incompleta .
HLHS también se asocia con varios síndromes genéticos, que incluyen trisomía 13 (síndrome de Patau) , trisomía 18 (síndrome de Edwards) , trisomía parcial 9 , síndrome de Turner (XO) , síndrome de Jacobsen (síndrome de deleción 11q) , síndrome de Holt-Oram y Smith- Síndrome de Lemli-Opitz .
Factores de riesgo
La presencia de un higroma quístico aumenta el riesgo de HLHS en un feto.
Fisiopatología
Al nacer, el conducto arterioso todavía está abierto y hay una resistencia al flujo sanguíneo en los pulmones más alta de lo normal. Esto permite una oxigenación adecuada mediante la mezcla entre las aurículas y una apariencia normal al nacer. Cuando el conducto comienza a cerrarse y la resistencia vascular pulmonar disminuye, el flujo sanguíneo a través del conducto se restringe y aumenta el flujo a los pulmones.
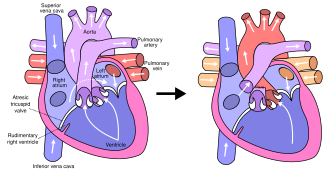
En la anatomía típica, el lado izquierdo del corazón recibe sangre rica en oxígeno de los pulmones y la bombea al resto del cuerpo. En las personas con HLHS, la aorta y el ventrículo izquierdo están subdesarrollados (comienzan en el útero ) y las válvulas aórtica y mitral son demasiado pequeñas para permitir un flujo sanguíneo suficiente o están atrésicas (cerradas) por completo. A medida que la sangre regresa de los pulmones a la aurícula izquierda , el ventrículo izquierdo no puede bombearla al resto del cuerpo. El recién nacido depende del flujo de sangre a través de un defecto del tabique auricular para mezclar sangre oxigenada y desoxigenada, y de un conducto arterioso persistente para permitir que la sangre llegue a la aorta y la circulación sistémica a través del ventrículo derecho. Esto es lo que define al HLHS como un defecto de "un solo ventrículo".
Debido al subdesarrollo del lado izquierdo del corazón en el útero , la poscarga aumentada causa hipertensión de la aurícula izquierda, edema pulmonar y, por lo tanto, daño pulmonar al feto antes del nacimiento.
Diagnóstico
El síndrome del corazón izquierdo hipoplásico se puede diagnosticar antes del nacimiento o después del nacimiento mediante ecocardiografía. Los hallazgos típicos incluyen un ventrículo izquierdo y una aorta pequeños, anomalías de las válvulas mitral y aórtica, flujo retrógrado en el arco transverso de la aorta y flujo de izquierda a derecha entre las aurículas. A menudo se reconoce durante el segundo trimestre del embarazo, entre las 18 y las 24 semanas de gestación.
administración
Médico
Sin intervenciones para prolongar la vida, HLHS es fatal, pero con la intervención, un bebé puede sobrevivir. Un cirujano cardiotorácico puede realizar una serie de operaciones o un trasplante de corazón completo . Si bien la intervención quirúrgica se ha convertido en el estándar de atención en los Estados Unidos, otros sistemas nacionales de salud, especialmente en Francia, abordan el diagnóstico de HLHS de una manera más conservadora, con énfasis en la interrupción del embarazo o la atención compasiva después del parto.
Antes de la cirugía, el conducto debe mantenerse abierto para permitir el flujo sanguíneo con medicamentos que contienen prostaglandina . Se usa aire con menos oxígeno de lo normal para los bebés con síndrome del corazón izquierdo hipoplásico. Estos bajos niveles de oxígeno aumentan la resistencia vascular pulmonar (PVR) y así mejoran el flujo sanguíneo al resto del cuerpo debido a la mayor diferencia de presión entre los pulmones y el cuerpo. Alcanzar niveles de oxígeno por debajo de la atmósfera requiere el uso de nitrógeno inhalado. El óxido nítrico es un potente vasodilatador pulmonar y, por tanto, reduce la RVP y mejora el retorno venoso. Cualquier factor que aumente el PVR impedirá el flujo del lado derecho.
Quirúrgico
Las operaciones quirúrgicas para ayudar con el corazón izquierdo hipoplásico son complejas y deben individualizarse para cada paciente. Un cardiólogo debe evaluar todas las opciones médicas y quirúrgicas caso por caso.
Actualmente, los bebés se someten a la cirugía reconstructiva por etapas ( procedimiento de Norwood o Sano a los pocos días del nacimiento, procedimiento de Glenn o Hemi-Fontan entre los 3 y 6 meses de edad y el procedimiento de Fontan entre los 1 1/2 y 5 años de edad) o trasplante cardíaco. Las expectativas actuales son que el 70% de las personas con HLHS puedan llegar a la edad adulta. Muchos estudios muestran que cuanto mayor es el volumen (número de cirugías realizadas) en un hospital, menor es la tasa de mortalidad (muerte). Los factores que aumentan el riesgo de un bebé incluyen bajo peso al nacer, anomalías congénitas adicionales, un síndrome genético o aquellos con un tabique auricular muy restrictivo). Para los pacientes sin estos factores de riesgo adicionales, la supervivencia a 5 años ahora se acerca al 80%. Los estudios muestran que alrededor del 75% de los niños que sobreviven a la cirugía muestran retrasos en el desarrollo en una o más áreas, como deficiencias motoras, cognitivas o del lenguaje, y alrededor de un tercio de los niños con un solo ventrículo sin síndrome genético tienen deficiencias significativas. La investigación actual se centra en trazar las conexiones entre las lesiones del neurodesarrollo, los procedimientos quirúrgicos y de cuidados intensivos y la susceptibilidad genética con el objetivo de modificar las intervenciones que afectan los resultados del neurodesarrollo y psicosociales. Una alternativa al Norwood tradicional es el procedimiento híbrido.
Algunos médicos ofrecen atención compasiva, en lugar de las cirugías, que resultan en la muerte del niño, generalmente dentro de las 2 semanas posteriores al nacimiento. La atención compasiva es supervisada por un médico y puede llevarse a cabo en el hospital o en el hogar. Sin embargo, debido a la gran mejora de la intervención quirúrgica, con muchos hospitales que logran una supervivencia superior al 90%, existe un debate sobre si aún se debe ofrecer atención compasiva a las familias. Un estudio realizado en 2003 concluyó que una selección de médicos expertos en el cuidado de niños con HLHS se dividió en partes iguales cuando se les preguntó qué harían si sus propios hijos nacieran con HLHS, y 1/3 afirmó que elegirían la cirugía, 1 / 3 afirma que elegiría un tratamiento paliativo (compasivo) sin cirugía, y 1/3 afirma que no está seguro de qué elección tomaría.
El procedimiento de tres etapas es un procedimiento paliativo (no una cura), ya que se hace que la circulación del niño funcione con solo dos de las cuatro cámaras del corazón.
Procedimiento Norwood
El primer paso es el procedimiento Norwood . En este procedimiento, el ventrículo derecho se utiliza para bombear sangre a la circulación sistémica. Dado que el ventrículo derecho ya no bombea sangre directamente a los pulmones, se requiere una derivación para que la sangre desoxigenada pase a través de los pulmones. La arteria subclavia se puede conectar a la circulación pulmonar ( derivación de Blalock-Taussig ) o se realiza una derivación directamente desde el ventrículo derecho a la circulación pulmonar ( derivación de Sano ). La aorta estrecha se agranda con un parche para mejorar el flujo sanguíneo al cuerpo.
Durante este tiempo, el bebé puede estar médicamente frágil y tener problemas para alimentarse porque el corazón está trabajando muy duro. Existe un grado considerable de mezcla venosa en el ventrículo derecho, lo que conduce a una menor saturación de oxigenación. Además, tanto las derivaciones Blalock-Taussig como las de Sano exponen los pulmones a presiones arteriales sistémicas, lo que provoca hipertensión pulmonar a largo plazo y, finalmente, insuficiencia cardíaca.
Procedimiento híbrido
El procedimiento híbrido se puede utilizar en lugar del Norwood. El procedimiento híbrido no requiere el uso de una derivación cardiopulmonar ni la realización de una esternotomía . En lugar de una cirugía de seis horas, el híbrido suele tardar de una a dos horas. En este procedimiento, se coloca un stent en el conducto arterioso para mantener su permeabilidad, y se colocan bandas sobre las ramas de la arteria pulmonar izquierda y derecha para limitar la presión y la circulación excesiva a los pulmones. Los resultados con el enfoque híbrido son comparables a los del Norwood.
Procedimiento de Glenn
La segunda etapa, el Glenn bidireccional o Hemi-Fontan (véase también el procedimiento de Kawashima ), alivia algunos de los problemas introducidos por la paliación de la etapa I. En esta operación, la vena cava superior se liga desde el corazón y se conecta a la circulación pulmonar. En este momento, se retira la derivación Blalock-Taussig o Sano. Los pulmones ya no están expuestos a presiones arteriales sistémicas, sino a presiones venosas mucho más bajas. Aunque la sangre venosa de la mitad superior del cuerpo ya no se mezcla con la sangre oxigenada en el ventrículo derecho, todavía hay una mezcla venosa de la mitad inferior del cuerpo, lo que lleva a cierto grado de desaturación de oxígeno.
Procedimiento de Fontan
El procedimiento final, el procedimiento de Fontan , completa la reparación del corazón izquierdo hipoplásico. Aunque existen varias variaciones, el efecto funcional es redirigir la sangre venosa desde la parte inferior del cuerpo (a través de la vena cava inferior) desde la aurícula derecha hacia la arteria pulmonar. Esto debería eliminar cualquier mezcla de sangre oxigenada y desoxigenada en el ventrículo derecho. El ventrículo derecho realiza el trabajo tradicional del izquierdo, suministrando al cuerpo sangre oxigenada, mientras que la presión venosa sistémica pasiva realiza el trabajo tradicional del derecho, pasando sangre desoxigenada a los pulmones.
Cirugía fetal
Se están investigando las intervenciones realizadas durante el desarrollo fetal. En fetos con ventrículos izquierdos hipoplásicos y un tabique interauricular intacto, se ha intentado una septostomía auricular percutánea .
Pronóstico
El 95% de los bebés con HLHS no tratados mueren en las primeras semanas de vida.
La supervivencia temprana ha mejorado desde la introducción del procedimiento de Norwood. Dado que no hay estudios a largo plazo de adultos con HLHS, las estadísticas generalmente se derivan de pacientes post-Fontan; se estima que el 70% de los pacientes con HLHS pueden llegar a la edad adulta.
El pronóstico depende de la salud del niño, ya que existe una mayor demanda de frecuencia respiratoria y cardíaca en los bebés durante las enfermedades comunes de la infancia. Esta frágil población tiene poca reserva cardíaca para adaptarse a estas demandas y proporcionar estabilidad hemodinámica durante las enfermedades.
Los niños con HLHS y otras afecciones comparables de un solo ventrículo, como grupo, tienen peores resultados de desarrollo neurológico que sus compañeros sanos. Se han demostrado deficiencias en el lenguaje, el funcionamiento ejecutivo y tasas más altas de trastornos de ansiedad y depresión . Algunos de estos resultados pueden ser una consecuencia de factores genéticos asociados con HLHS, y otros pueden modificarse mediante cambios en los procedimientos y en el entorno de la atención médica. Existe un consenso clínico emergente en torno a la importancia de la vigilancia continua del desarrollo neurológico desde los primeros años hasta la edad adulta.
Como ocurre con los pacientes con otros tipos de defectos cardíacos que involucran válvulas malformadas, los pacientes con HLHS corren un alto riesgo de endocarditis y deben ser monitoreados por un cardiólogo por el resto de sus vidas para controlar su función cardíaca.
El trasplante de corazón puede estar indicado, generalmente después de la finalización de Fontan. Un estudio multicéntrico (de pacientes sometidos al Fontan entre 1993 y 2001) informó una tasa de supervivencia a 1 año del 76% en pacientes que sobrevivieron al trasplante.
Epidemiología
El HLHS ocurre en aproximadamente 1 de cada 4,300 nacidos vivos en los Estados Unidos, o un total estimado de 960 nacidos vivos por año en ese país. En general, se estima que representa el 2-3% de todos los casos de cardiopatía congénita y es el defecto de un solo ventrículo más común. Se cree que es más común en los bebés varones, 1,5 veces más común que en las niñas.
Referencias
enlaces externos
- Información sobre el síndrome del corazón izquierdo hipoplásico para los padres.
| Clasificación | |
|---|---|
| Recursos externos |