Quinasa 5 dependiente de ciclina - Cyclin-dependent kinase 5
La quinasa 5 dependiente de ciclina es una proteína, y más específicamente una enzima, que está codificada por el gen Cdk5. Fue descubierto hace 15 años y se expresa de forma destacada en neuronas del sistema nervioso central (SNC) posmitóticas.
La molécula pertenece a la familia de las quinasas dependientes de ciclina . Las quinasas son enzimas que catalizan reacciones de fosforilación, un proceso que permite que el sustrato adquiera un grupo fosfato donado por un compuesto orgánico conocido como ATP. Las fosforilaciones son de vital importancia durante la glucólisis , por lo tanto, hacen de las quinasas una parte esencial de la célula debido a su papel en el metabolismo, la señalización celular y muchos otros procesos.
Estructura
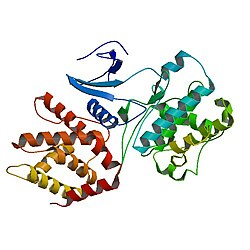
Cdk5 es una serina / treonina quinasa dirigida por prolina, que se identificó por primera vez como un miembro de la familia CDK debido a su estructura similar a CDC2 / CDK1 en humanos, una proteína que juega un papel crucial en la regulación del ciclo celular.
El gen Cdk5 contiene 12 exones en una región que contiene alrededor de 5000 nucleótidos (5kb), como lo determinó Ohshima después de clonar el gen Cdk5 que pertenecía a un ratón.
Cdk5 tiene 292 aminoácidos y presenta estructuras de cadena α y β.
Aunque Cdk5 tiene una estructura similar a otras quinasas dependientes de ciclina, sus activadores son altamente específicos ( CDK5R1 y CDK5R2 ).
Algunas investigaciones han informado que los estados activos de las proteína quinasas difieren estructuralmente entre sí para preservar la geometría de su maquinaria, de modo que la salida catalítica funcione correctamente. La quinasa Cdk5 también tiene un diseño original.
Cdk5 pertenece a las proteína quinasas eucariotas (ePK). Una estructura cristalina del dominio catalítico de la proteína quinasa dependiente de AMPc mostró que contiene 2 lóbulos; por un lado, tiene el lóbulo pequeño, un N-terminal dispuesto como una estructura de hoja β antiparalela, además, contiene motivos de nucleótidos como una forma de orientar el nucleótido para la fosfo-transferencia. Por otro lado, el lóbulo grande, C-terminal, de forma helicoidal, que ayuda a identificar el sustrato e incluye residuos cruciales para la fosfo-transferencia.
Papel fisiológico
Dolor
Recientemente, Cdk5 ha surgido como una quinasa esencial en las vías sensoriales. Informes recientes de Pareek et al. sugieren su necesidad en la señalización del dolor. De hecho, la CDK5 es necesaria para el correcto desarrollo del cerebro y, para ser activada, debe asociarse con CDK5R1 o CDK5R2 . A diferencia de otras quinasas dependientes de ciclina, CDK5 tampoco requiere fosforilación en el bucle T, por lo tanto, la unión con el activador es suficiente para activar la quinasa.
Neuronas
Cdk5 es abundante y se expresa principalmente en neuronas donde fosforila polímeros proteicos de alto peso molecular llamados neurofilamentos, y proteína tau asociada a microtúbulos, que abundan en el SNC (Sistema Nervioso Central). La enzima participa en muchos aspectos del desarrollo y las funciones neuronales.
El papel principal de Cdk5 cuando se trata de neuronas es asegurar una migración neuronal adecuada. Las neuronas enviarán tanto dendritas como axones para formar conexiones con otras neuronas con el fin de transmitir información y Cdk5 regula este proceso. Para funcionar, Cdk5 necesita ser activado por p35 (estos 3 aminoácidos, Asp-259, Asn-266 y Ser-270, están involucrados en la formación de enlaces de hidrógeno con Cdk5) o p39 (la isoforma de p35), que son dos de sus subunidades reguladoras específicas de neuronas. Esto significa que el nivel de expresión de p35 y p39 va a estar relacionado con la actividad de la enzima: si hay una alta actividad de Cdk5 durante el desarrollo cerebral, habrá una alta expresión de sus activadores. De hecho, cuando se realizaron estudios en ratones sin p35 y p39, los resultados fueron los mismos que los observados en ratones sin Cdk5: hubo claras alteraciones de las estructuras laminares en la corteza cerebral, el bulbo olfatorio, el hipocampo. y el cerebelo. El correcto desarrollo y funcionalidad de estas áreas depende totalmente de Cdk5, que se basa en la correcta expresión de p35 y p39. Además, Cdk5 colabora con la señalización de Reelin para asegurar la migración neuronal adecuada en el cerebro en desarrollo.
Cdk5 no solo está implicado en la migración neuronal, la enzima también ayudará a controlar la extensión de neuritas, la formación de sinapsis y la transmisión sináptica. También vale la pena señalar que Cdk5 también regula el proceso de apoptosis, lo cual es necesario para asegurar que las conexiones neuronales que se forman sean las correctas. Además, debido a que Cdk5 también interviene en la regulación de la plasticidad sináptica, está implicado en los procesos de aprendizaje y formación de la memoria, así como en la creación de adicción a las drogas.
Además de eso, Cdk5 modula la dinámica del citoesqueleto de actina fosporilando Pak1 y filamin 1, y regula los microtúbulos fosforilando también tau, MAP1B, doblecortina, Nudel y CRMP, que son proteínas asociadas a los microtúbulos. Una expresión inadecuada de Cdk5 generará defectos en estos sustratos que pueden conducir a múltiples enfermedades. Por ejemplo, un defecto en la filamina 1 en humanos provoca heterotopía periventricular; y un defecto en Lis1 y doblecortinas causarán lisencefalia tipo 1. De hecho, cuatro miembros de una familia musulmana israelí consanguínea que padecía lisencefalia-7 con hipoplasia cerebelosa, tenían una mutación en el sitio de empalme en el gen Cdk5.
Abuso de drogas
Se ha demostrado que Cdk5 está directamente relacionado con el uso indebido de drogas. Sabemos que los fármacos actúan en el sistema de recompensa, alcanzando su acción perturbando las vías de transducción de señales intracelulares. Cdk5 está involucrado en esas neuroseñales. La adicción a las drogas es una clara consecuencia de una experiencia neuronal dependiente y de una plasticidad conductual . Cuando el consumo de drogas se convierte en un hábito repetitivo, modifica varios componentes de la señalización de la dopamina, cambios en la expresión génica y cambios en los circuitos neuronales de las neuronas dopaminoceptivas.
Tomando el ejemplo de la cocaína, sus efectos son causados por CREB (cAMP Response Element Binding), que conduce a un estallido transitorio en la expresión génica temprana inmediata en el cuerpo estriado, y también por ΔFosB (que se acumula y persiste en las neuronas estriatales cuando el el consumo de la droga es regular). Muchos estudios han revelado que la sobreexpresión de ΔFosB debido al abuso de drogas, es la causa de una regulación al alza de Cdk5 (porque es un flujo descendente de ΔFosB en el cuerpo estriado, incluido el núcleo accumbens).
Veamos ahora el papel de Cdk5 en todo esto. Se ha descubierto que con la exposición a drogas como la cocaína y con la presencia excesiva de ΔFosB, aumenta la cantidad de Cdk5. Esto se debe a esos 2 factores que regulan positivamente la p35 que activa la producción de la proteína Cdk5.
También se ha demostrado que esta enzima tiene un lugar importante en la regulación de la neurotransmisión de dopamina. De hecho, Cdk5 es capaz de modificar el sistema de dopamina fosforilando DARPP-32. Sabemos que el núcleo accumbens está relacionado con las adicciones a las drogas. Como consecuencia del aumento de la cantidad de Cdk5, también hay un aumento en el número de ramificaciones y espinas dendríticas, tanto las neuronas espinosas medianas del núcleo accumbens como las neuronas piramidales de la corteza prefrontal medial . De ahí su relación con el abuso de drogas y más concretamente con el sistema de recompensas, que se desencadena por el consumo de drogas.
Analizando más a fondo la relación entre la proporción de Cdk5 y los efectos del fármaco, se ha demostrado que existen diferencias significativas en función de la dosis y la frecuencia de consumo del fármaco. Por ejemplo, si la frecuencia de la dosis de cocaína está realmente esparcida en el tiempo o concentrada en un único y largo período de tiempo, los efectos de la cocaína estarán presentes aunque la producción de Cdk5 en el núcleo accumbens, en el área tegmental ventral y prefrontal la corteza no aumentará. Sin embargo, cuando se trata de dosis frecuentes significativamente cercanas en el tiempo, los efectos de la cocaína no se muestran a pesar de la proporción mejorada de Cdk5. Esas diferencias se pueden explicar con el hecho de que Cdk5 es un estado de transición a la sobreexposición a drogas como la cocaína.
Toda esta información debería centrarse ahora en encontrar un uso terapéutico para Cdk5, que puede reducir la sensación de recompensa cuando usamos drogas con regularidad. En primer lugar, se ha demostrado que el antagonista de Cdk5, después de mucho tiempo de uso, actúa como inhibidor del crecimiento de dendritas espinosas en las neuronas del núcleo accumbens. De esta forma, podríamos tratar las adicciones. En segundo lugar, podría usarse como una forma de diagnosticar el abuso de drogas, si decidimos monitorear la cantidad de Cdk5 en el paciente. Esto es posible porque Cdk5 solo se produce como recompensa por consumir drogas, pero no como mediador o recompensa natural.
Páncreas
Aunque el papel principal de Cdk5 está relacionado con la migración neuronal, su impacto en el cuerpo humano no se limita al sistema nervioso. De hecho, Cdk5 juega un papel importante en el control de la secreción de insulina en el páncreas.
En realidad, esta enzima se ha encontrado en las células β pancreáticas y se ha demostrado que reduce la exocitosis de insulina mediante la fosforilación de L-VDCC ( canal de Ca 2+ dependiente de voltaje de tipo L ).
Sistema inmune
Durante la activación de las células T , Cdk5 fosforila la coronina 1a, una proteína que contribuye al proceso de fagocitosis y regula la polarización de la actina . Por lo tanto, esta quinasa promueve la supervivencia y la motilidad de las células T.
Cdk5 también participa en la producción de interleucina 2 (IL-2), una citoquina involucrada en la señalización celular , por las células T. Para ello, interrumpe la represión de la transcripción de la interleucina 2 por la histona desacetilasa 1 (HDAC1) a través de la fosforilación de la proteína mSin3a. Esto reduce la capacidad del complejo HDAC1 / mSin3a para unirse al promotor de IL-2, lo que conduce a una mayor producción de interleucina 2.
Regulación de la exocitosis
La exocitosis de vesículas sinápticas también está regulada por CdK5, con la fosforilación de la proteína munc-18-a, indispensable para la secreción, ya que tiene una gran afinidad con un derivado del receptor SNAP (proteína SNARE). Esta fosforilación se demostró con la simulación de secreción de células neuroendocrinas, ya que aumentó la actividad de Cdk5. Cuando se eliminó Cdk5, la secreción de norepinefrina disminuyó.
Memoria
Gracias a un experimento con ratones, se demostró una relación entre la memoria y Cdk5. Por un lado, los ratones no mostraron miedo integrado por una actividad previa cuando se inactivó Cdk5. Por otro lado, cuando se incrementó la actividad enzimática en el hipocampo -donde se almacenan los recuerdos- reapareció el miedo.
Remodelación del citoesqueleto de actina en el cerebro.
Durante la embriogénesis , Cdk5 es esencial para el desarrollo del cerebro, ya que es crucial para la regulación del citoesqueleto, que a su vez es importante para la remodelación del cerebro. Varios procesos neuronales: la señalización del dolor, la drogadicción, los cambios de comportamiento, la formación de recuerdos y el aprendizaje, relacionados con el desarrollo del cerebro, se derivan de modificaciones rápidas en el citoesqueleto. Una remodelación negativa del citoesqueleto neuronal se asociará con una pérdida de sinapsis y neurodegeneración en enfermedades cerebrales, donde la actividad de Cdk5 está desregulada. Por tanto, la mayor parte de los sustratos de Cdk5 están relacionados con el esqueleto de actina; tanto las fisiológicas como las patológicas. Algunos de ellos han sido identificados en las últimas décadas: ephexin1, p27, Mst3, CaMKv, kalirin-7, RasGRF2, Pak1, WAVE1, neurabin-1, TrkB, 5-HT6R, talin, drebrin, sinapsina I, sinapsina III, CRMP1 , GKAP, SPAR, PSD-95 y LRRK2.
Regulación del reloj circadiano
El reloj circadiano de los mamíferos está controlado por Cdk5 con la fosforilación de PER2. En el laboratorio, Cdk5 se bloqueó en el SCN (núcleos supraquiasmáticos, un oscilador maestro del sistema circadiano), por lo que se redujo el período de funcionamiento libre en ratones. Durante el período diurno, el PER2 (en el residuo de serina 394) fue fosforilado por el Cdk5, por lo que el Criptocromo 1 (CRY1) pudo interactuar fácilmente con él y el complejo PER2-CRY1 entró en el núcleo. El ciclo y el período circadianos moleculares se establecen correctamente gracias a la función del Cdk5 como conductor nuclear de estas proteínas.
Regulador de la apoptosis celular y la supervivencia celular.
Además de todos los roles mencionados anteriormente, el Cdk5 está involucrado en numerosas funciones celulares como la supervivencia de la movilidad celular, la apoptosis y la regulación de genes.
La membrana plasmática, el citosol y la región perinuclear son los lugares donde se encuentran los activadores de Cdk5 / p35. Sin embargo, Cdk5 también puede ser activada por ciclina I , este regulador provoca un aumento en la expresión de proteínas de la familia BCl-2, las cuales están asociadas con funciones antiapoptóticas.
Papel en la enfermedad
La explicación química de una amplia variedad de trastornos neurológicos conduce al Cdk5; la fosforilación anormal de tau es una acción patológica realizada por esta quinasa y los ovillos neurofibrilares son las consecuencias.
Enfermedades neurodegenerativas
Cdk5 juega un papel esencial en el sistema nervioso central. Durante el proceso de embriogénesis, esta quinasa es necesaria para el desarrollo del cerebro; y en cerebros adultos, Cdk5 es necesaria para muchos procesos neuronales; por ejemplo, el aprendizaje y la formación de recuerdos. Sin embargo, si se desregula la actividad de Cdk5, puede conducir a enfermedades neurológicas realmente graves, como el Alzheimer, el Parkinson, la esclerosis múltiple y la enfermedad de Huntington.
- La enfermedad de Alzheimer (EA) es responsable del 50-70% de todos los casos de demencia. Se han realizado algunos estudios que han demostrado que un exceso en la actividad de Cdk5, una proteína quinasa dirigida por prolina, conduce a la hiperfosforilación de tau , un proceso que se observa en muchos pacientes con EA. Los activadores de Cdk5, p35 y p39 (ambos son proteínas miristoiladas que están ancladas a las membranas celulares), pueden ser escindidas por la calpaína activada por calcio en p25 y p29. Esto resultará en una migración de las proteínas de la membrana celular a las regiones tanto nuclear como perinuclear, y en una desregulación de la actividad de Cdk5. p25 y p29 tienen vidas medias que son de 5 a 10 veces más largas que las que tienen p35 y p39. Esto es increíblemente problemático debido al hecho de que puede conducir a la acumulación de activadores de Cdk5 y un exceso de actividad de Cdk5, que luego causa la hiperfosforilación de tau. Además de eso, un aumento en los niveles de Aβ también puede conducir a la hiperfosforilación de tau al estimular la producción de p25. Por lo tanto, Cdk5 podría ser un objetivo farmacológico potencial para tratar pacientes con EA porque su inhibición podría reducir la hiperfosforilación de tau y, en consecuencia, reducir la formación de NFT (ovillos neurofibrilares) y ralentizar el proceso de neurodegeneración.
- La enfermedad de Huntington (EH) es otra enfermedad neurodegenerativa que de alguna manera está relacionada con la actividad de Cdk5. La proteína 1 relacionada con la dinamina ( Drp1 ) es un elemento esencial en la fisión mitocondrial. Cdk5 puede alterar la distribución subcelular de Drp1 y su actividad. De hecho, se ha observado que la inhibición de la quinasa demasiado activa permite que Drp1 funcione correctamente en la fragmentación mitocondrial para evitar la neurotoxicidad en el cerebro. Además de eso, Cdk5 puede influir en la alteración de la morfología mitocondrial o su potencial transmembrana, lo que puede conducir a la muerte celular y la neurodegeneración. Esto significa que Cdk5 es una posible diana terapéutica para tratar la disfunción mitocondrial que conduce al desarrollo de la EH.
- Enfermedad de Parkinson (EP): se considera que Cdk5 está estrechamente involucrado en la enfermedad de Parkinson. Esta enfermedad neurodegenerativa es causada por la pérdida progresiva de células nerviosas en la parte del cerebro llamada sustancia negra , entre otras. Cdk5 es capaz de formar un complejo con p25 (péptido de escisión de p35): Cdk5 / p25. P25 conducirá a la hiperactividad de Cdk5. El resultado de la formación de este complejo es la apoptosis de las células nerviosas y la neuroinflamación. Este descubrimiento podría usarse para tratar la enfermedad de Parkinson. Para inhibir el complejo Cdk5 / p25, podríamos utilizar un antagonista de Cdk5: CIP. Los resultados de este tratamiento han sido sorprendentemente positivos. De hecho, podemos notar no solo que los síntomas de Parkinson se calmaron, sino también que el CIP resultó proteger la pérdida de neuronas dopaminérgicas en la sustancia negra.
- Esclerosis múltiple (EM): es una de las enfermedades en las que un fallo de remielinización puede provocar un daño axonal duradero y una pérdida de función irreversible. La quinasa 5 dependiente de ciclina está involucrada en el proceso, ya que regula el oligodendrocito (desarrollo y mielinización de OL9 en el SNC). Los inhibidores de Cdk5 impiden la remielinización e interrumpen la actividad de las células neurales. La baja expresión de MBP y proteína proteolípida y la disminución del número de axones mielinizados indican la falta de reparación de la mielina.
Cáncer
Cdk5 está involucrado en cánceres invasivos, aparentemente al reducir la actividad de la proteína reguladora de actina caldesmon .
Aunque Cdk5 no está mutado en tejidos cancerosos, su actividad y expresión están desreguladas. La quinasa fosforila los supresores de tumores y los factores de transcripción , que participan en la progresión del ciclo celular. Cdk5 participa en la proliferación, migración, angiogénesis de tumores y también en la resistencia a la quimioterapia y en la inmunidad antitumoral. También participa en las vías de señalización que conducen a la metástasis y regula el citoesqueleto y las adherencias focales .
| Posibles mecanismos de angiogénesis mediados por Cdk5 | |
|---|---|
| Cdk5 promueve la expresión del factor de crecimiento endotelial vascular (VEGF), una proteína que regula la vasculogénesis y la angiogénesis, según un estudio sobre adenomas hipofisarios. VEGF estimula la división y migración de células endoteliales, así como la permeabilidad vascular. | |
| Cdk5 promueve la angiogénesis al remodelar el citoesqueleto de actina a través de Rac1, una GTPasa de señalización. También puede regular la formación de lamelipodios, que son protuberancias de membrana involucradas en la migración celular. | |
| La fosforilación de Cdk5 y la activación de presenilina estimula la NICD (dominio intracelular de Notch). Como consecuencia, se activa la señalización dependiente de Notch, una vía clave que promueve la angiogénesis. |
Un posible tratamiento contra el cáncer podría consistir en apuntar a Cdk5 y evitar su unión a sus activadores y sustratos.
En estudios recientes, sobre la radioterapia en pacientes con cáncer de pulmón de células grandes, se ha encontrado que el agotamiento de CDK5 disminuye el desarrollo del cáncer de pulmón y la resistencia a la radiación in vitro e in vivo. Se demostró que una disminución de Cdk5 redujo la expresión de TAZ, un componente de la vía del hipotálamo . Como resultado, esta pérdida mitiga la activación de la señal del hipotálamo. En consecuencia, Cdk5 puede tratarse como un objetivo para combatir el cáncer de pulmón.
Historia
CDK5 se denominó originalmente NCLK (quinasa de tipo CDC2 neuronal) debido a su motivo de fosforilación similar. La CDK5 en combinación con un activador también se denominó proteína quinasa Tau II. Además, se ha informado que Cdk5 está involucrado en la activación de las células T y juega un papel importante en el desarrollo de trastornos autoinmunes, como la esclerosis múltiple .
Mapa de ruta interactivo
Haga clic en genes, proteínas y metabolitos a continuación para enlazar con los artículos respectivos.
Interacciones
Se ha demostrado que la quinasa 5 dependiente de ciclina interactúa con diferentes moléculas y sustratos:
- Interactúa con LMTK2 , NDEL1 , CDK5R1 , nestina y PAK1 .
- El gen CABLES1 codifica una proteína de unión a quinasa dependiente de ciclina, cuyo nombre completo es Cdk5 y sustrato 1 de la enzima Abl . Esta proteína de unión une Cdk5 y c-Abl , una tirosina quinasa. El c-Abl activo fosforila CDK5 en tirosina 15, un proceso mejorado por la proteína CABLES1. Como resultado, aumenta la actividad de Cdk5 / p35 en las neuronas en desarrollo. CABLES1 y la fosforilación mencionada pueden jugar un papel importante en la regulación del crecimiento de axones .
- El gen llamado CABLES2 codifica otra proteína de unión, Cdk5 y el sustrato 2 de la enzima Abl . Aunque se desconoce su función, puede estar involucrado en la transición del ciclo celular G1-S , una etapa entre el crecimiento celular y la replicación del ADN.
- Además, Cdk5 fosforila la tirosina quinasa asociada a apoptosis (AATK). Esta proteína probablemente induce la detención del crecimiento y la apoptosis de las células precursoras mieloides , y también activa CdkR1.
- La enzima glutatión S-transferasa P , codificada por el gen GSTP1, provoca una regulación negativa o reducción de la actividad de Cdk5. Esto se logra mediante la translocación p25 / p35 para prevenir la neurodegeneración .
- Cdk5 se une a la proteína histona desacetilasa 1 (HDAC1). Cuando Cdk5 / p25 desregula HDAC1, aparece una actividad anormal del ciclo celular y se rompe el ADN de doble hebra, lo que provoca neurotoxicidad .
- La distribución citoplásmica de Cdk5 está determinada por los activadores p35 y p39. Ambos activadores tienen motivos de localización, que conducen a la presencia de Cdk5 en la membrana plasmática y en la región perinuclear . La miristoilación de p35 y p39 permite que Cdk5 se asocie con membranas.
- Cdk5 también interactúa con la endonucleasa APEX1 . La quinasa fosforila Thr-233, provocando una acumulación de daño en el ADN y, finalmente, la muerte neuronal.
- Cdk5 fosforila y regula la proteína supresora de tumores p53 . En las células apoptóticas PC12 existe un aumento simultáneo de los niveles de Cdk5 y p53, por lo que se cree que el mecanismo por el cual Cdk5 induce la apoptosis podría estar causado por la fosforilación y activación de p53.
- Una vez que la Cdk5 es fosforilada por una proteína llamada receptor A4 de EPH , fosforila los factores de intercambio de nucleótidos de guanina (NGEF) que regulan la morfogénesis de la columna dendrítica y la RhoA .
- Cdk5 también fosforila la quinasa de adhesión focal (FAK). Esto puede estimular la translocación nuclear, que juega un papel importante en la migración neuronal, regulando una estructura de microtúbulos asociada al centrosoma .
- El receptor 6 de 5-hidroxitriptamina (HTR6), que se cree que controla la transmisión neuronal colinérgica en el cerebro, gestiona la migración de neuronas piramidales durante la corticogénesis . Para ello, HTR6 regula la actividad de Cdk5.
- Cdk5 también interactúa con CTNNB1 y CTNND2 .
Referencias
Otras lecturas
- Morishima-Kawashima M, Hasegawa M, Takio K, Suzuki M, Yoshida H, Watanabe A, Titani K, Ihara Y (1995). "Hiperfosforilación de tau en PHF". Neurobiología del envejecimiento . 16 (3): 365–71, discusión 371–80. doi : 10.1016 / 0197-4580 (95) 00027-C . PMID 7566346 . S2CID 22471158 .
- Peruzzi F, Gordon J, Darbinian N, Amini S (diciembre de 2002). "Desregulación inducida por Tat de la diferenciación neuronal y la supervivencia por la vía del factor de crecimiento nervioso". Revista de Neurovirología . 8 Suppl 2 (2): 91–6. doi : 10.1080 / 13550280290167885 . PMID 12491158 .
enlaces externos
- Dependiente de ciclina + quinasa + 5 en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .
- Ubicación del gen humano CDK5 en UCSC Genome Browser .
- Detalles del gen humano CDK5 en UCSC Genome Browser .