Xilosa isomerasa - Xylose isomerase
| xilosa isomerasa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Tetrámero de D-xilosa isomerasa de Streptomyces rubiginosus PDB 2glk . Un monómero está coloreado por una estructura secundaria para resaltar la arquitectura de barril TIM.
| |||||||||
| Identificadores | |||||||||
| CE no. | 5.3.1.5 | ||||||||
| No CAS. | 9023-82-9 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| FÁCIL | NiceZyme vista | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | camino metabólico | ||||||||
| PRIAM | perfil | ||||||||
| Estructuras PDB | RCSB PDB PDBe PDBsum | ||||||||
| Ontología de genes | AmiGO / QuickGO | ||||||||
| |||||||||
En enzimología , una xilosa isomerasa ( EC 5.3.1.5 ) es una enzima que cataliza la interconversión de D-xilosa y D-xilulosa . Esta enzima pertenece a la familia de las isomerasas , específicamente aquellas oxidorreductasas intramoleculares que interconvierten aldosas y cetosis . La isomerasa se ha observado ahora en casi un centenar de especies de bacterias. Las xilosa -isomerasas también se denominan comúnmente fructosa-isomerasas debido a su capacidad para interconvertir glucosa y fructosa. El nombre sistemático de esta clase de enzimas es D-xilosa aldosa-cetosa-isomerasa. Otros nombres de uso común incluyen D-xilosa isomerasa, D-xilosa cetoisomerasa y D-xilosa cetilisomerasa.
Historia
La actividad de la D-xilosa isomerasa fue observada por primera vez por Mitsuhashi y Lampen en 1953 en la bacteria Lactobacillus pentosus . La producción artificial a través de E. coli transformada también ha tenido éxito. En 1957, Kooi y Marshall observaron la actividad de la D-xilosa isomerasa en la conversión de D-glucosa en D-fructosa. Ahora se sabe que las isomerasas tienen una amplia especificidad de sustrato. La mayoría de las pentosas y algunas hexosas son todos sustratos de la D-xilosa isomerasa. Algunos ejemplos incluyen: D-ribosa, L-arabinosa, L-ramnosa y D-alosa.
La conversión de glucosa en fructosa por la xilosa isomerasa se patentó por primera vez en la década de 1960, sin embargo, el proceso no era viable industrialmente ya que las enzimas estaban suspendidas en solución y el reciclaje de la enzima era problemático. Takanashi desarrolló por primera vez en Japón una xilosa isomerasa inmóvil fijada sobre una superficie sólida. Estos desarrollos fueron esenciales para el desarrollo de los procesos de fermentación industrial utilizados en la fabricación de jarabe de maíz con alto contenido de fructosa .
La estructura terciaria se determinó para varias xilosa isomerasas de microbios a partir de mediados de la década de 1980 ( Streptomyces olivochromogenes en 1988, Streptomyces violaceoniger en 1988, Streptomyces rubiginosus en 1984, Arthrobacter B3728 en 1986, Actinoplanes missouriensis en 1992 y Clostridium thermosulfurogenes en 1990).
Función
Este participa enzimáticas en las pentosas y las interconversiones de glucuronato y fructosa y manosa metabolismo. Los azúcares más biodisponibles según la Sociedad Internacional de Azúcares Raros son: glucosa, galactosa, manosa, fructosa, xilosa, ribosa y L-arabinosa. Veinte hexosas y nueve pentosas, incluida la xilulosa, se consideraron "azúcares raros". Por lo tanto, se usa D-xilosa isomerasa para producir estos azúcares raros que tienen aplicaciones muy importantes en biología a pesar de su baja abundancia.
Caracterización
Xilosa isomerasa que se puede aislar del vino de arroz rojo chino, que contiene la bacteria Lactobacillus xylosus . Esta bacteria se clasificó erróneamente como L. plantarum , que normalmente crece en el azúcar L-arabinosa , y rara vez crece en D-xilosa. Se reconoció que L. xylosus se distingue por su capacidad para crecer en D-xilosa. La xilosa isomerasa en L. xylosus tiene un peso molecular de aproximadamente 183000 Daltons. Su pH de crecimiento óptimo es de aproximadamente 7,5 para L. lactis , sin embargo, cepas como la enzima xilosa de L.brevis prefieren un ambiente más alcalino. La cepa de L. lactis es estable en el rango de pH de 6,5 a 11,0, y la enzima L. brevis , que es menos tolerante a los cambios de pH, muestra actividad en el rango de pH de 5,7 a 7,0. Kei Y. y Noritaka T. también realizaron pruebas térmicas y se descubrió que la xilosa isomerasa era térmicamente estable a unos 60 grados Celsius.
Sitio y mecanismo activos
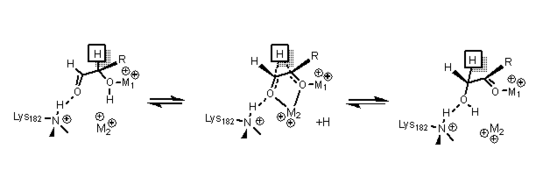
La xilosa isomerasa tiene una estructura que se basa en ocho barriles alfa / beta que crean un sitio activo que contiene dos iones de magnesio divalentes. Las enzimas xilosa isomerasa exhiben un pliegue de cilindro TIM con el sitio activo en el centro del cilindro y una estructura cuaternaria tetramérica . Las estructuras PDB están disponibles en los enlaces del cuadro de información de la derecha. La proteína es un tetrámero donde los barriles emparejados son casi coaxiales, que forman dos cavidades en las que los metales divalentes están unidos a una de las dos cavidades. Los metales tienen una geometría octaédrica. El sitio de metal 1 se une al sustrato firmemente, mientras que el sitio de metal dos se une al sustrato de manera suelta. Ambos comparten un residuo ácido, ácido glutámico 216 de la enzima que une los dos cationes. Dos aminoácidos básicos rodean a los ligandos cargados negativamente para neutralizarlos. La segunda cavidad se enfrenta a la cavidad metálica y ambas cavidades comparten la misma ruta de acceso. La segunda cavidad es de naturaleza hidrófoba y tiene un importante residuo de histidina que es activado por un residuo de aspartato que está unido por enlaces de hidrógeno . Este residuo de histidina es importante en la isomerización de glucosa.
En la isomerización de glucosa, la histidina 53 se usa para catalizar la transferencia de protones de O1 a O5; el diagrama del mecanismo de apertura del anillo se muestra a continuación. El primer metal, mencionado anteriormente, se coordina con O3 y O4, y se utiliza para acoplar el sustrato.
En la isomerización de la xilosa, los datos de los cristales han demostrado que el azúcar xilosa se une a la enzima en una conformación de cadena abierta . El metal 1 se une a O2 y O4, y una vez unido, el metal 2 se une a O1 y O2 en el estado de transición, y estas interacciones junto con un residuo de lisina ayudan a catalizar el cambio de hidruro necesario para la isomerización. El estado de transición consiste en un ion carbonio de alta energía que se estabiliza a través de todas las interacciones del metal con el sustrato de azúcar.
Aplicación en la industria
La aplicación más utilizada de esta enzima es la conversión de glucosa en fructosa para producir jarabe de maíz con alto contenido de fructosa (JMAF). Hay tres pasos generales para producir JMAF a partir de almidón:
- degradación enzimática del almidón usando α- amilasa . También conocido como licuado.
- degradación adicional usando glucoamilasa y una enzima desramificante.
- Producción de fructosa a través de xilosa isomerasa
El proceso se lleva a cabo en biorreactores a 60–65 ° C. Las enzimas se inactivan a altas temperaturas como esta, y un foco de investigación ha sido diseñar versiones más termoestables de xilosa isomerasa y las otras enzimas en el proceso. Las enzimas generalmente se inmovilizan para aumentar el rendimiento; mejores formas de hacer esto ha sido otro foco de investigación.
La xilosa isomerasa es una de las enzimas que utilizan las bacterias en la naturaleza para utilizar la celulosa como alimento y otro foco de investigación industrial y académica, ha estado desarrollando versiones de xilosa isomerasa que podrían ser útiles en la producción de biocombustible .
Como un suplemento dietético
Los productos que contienen xilosa-isomerasa se venden como suplementos dietéticos de venta libre para combatir la malabsorción de fructosa , principalmente en Europa y bajo marcas comerciales que incluyen Fructaid , Fructease y Fructosin . Aparte de las preocupaciones generales sobre la eficacia de las enzimas de venta libre, actualmente hay muy poca investigación disponible sobre la xilosa-isomerasa como suplemento dietético, y el único estudio científico indica un efecto positivo sobre las náuseas y el dolor abdominal relacionados con la malabsorción, pero ninguno sobre la hinchazón. .
Referencias
Otras lecturas
- Hochster RM, Watson RW (1954). "Isomerización enzimática de D-xilosa a D-xilulosa". Arco. Biochem. Biophys . 48 (1): 120–9. doi : 10.1016 / 0003-9861 (54) 90313-6 . PMID 13125579 .
- Slein MW (1955). "Xilosa isomerasa de Pasteurella pestis, cepa A-1122". Mermelada. Chem. Soc . 77 (6): 1663–1667. doi : 10.1021 / ja01611a074 .
- Yamanaka K (1968). "Purificación, cristalización y propiedades de la D-xilosa isomerasa de Lactobacillus brevis". Biochim. Biophys. Acta . 151 (3): 670–80. doi : 10.1016 / 0005-2744 (68) 90015-6 . PMID 5646045 .