Síndrome de Hunter - Hunter syndrome
| Síndrome de Hunter | |
|---|---|
 | |
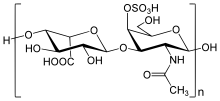
| Estructura del heparán sulfato , uno de los GAG que se acumula en los tejidos de las personas con síndrome de Hunter | |
| Especialidad |
Endocrinología |
| Síntomas | Anomalías esqueléticas, pérdida de audición, degeneración de la retina, hígado y bazo agrandados |
| Complicaciones | Enfermedad de las vías respiratorias superiores; insuficiencia cardiovascular |
| Causas | Deficiencia de la enzima iduronato-2-sulfatasa |
| Diagnóstico diferencial | Mucopolisacaridosis tipo I ; otras mucopolisacaridosis |
| Pronóstico | En casos graves, la muerte suele ocurrir a los 15 años. En casos atenuados, los pacientes pueden sobrevivir hasta los 50 años. |
| Frecuencia | 1 de cada 100.000 a 150.000 nacimientos de varones |
El síndrome de Hunter , o mucopolisacaridosis tipo II ( MPS II ), es un trastorno genético poco común en el que grandes moléculas de azúcar llamadas glicosaminoglicanos (o GAG o mucopolisacáridos) se acumulan en los tejidos corporales. Es una forma de enfermedad por almacenamiento lisosómico . El síndrome de Hunter es causado por una deficiencia de la enzima lisosomal iduronato-2-sulfatasa (I2S). La falta de esta enzima hace que el sulfato de heparán y el sulfato de dermatán se acumulen en todos los tejidos corporales. El síndrome de Hunter es el único síndrome de MPS que exhibe herencia recesiva ligada al cromosoma X.
Los síntomas del síndrome de Hunter son comparables a los de MPS I . Provoca anomalías en muchos órganos, incluidos el esqueleto, el corazón y el sistema respiratorio. En casos graves, esto conduce a la muerte durante la adolescencia. A diferencia de MPS I, el enturbiamiento de la córnea no está asociado con esta enfermedad.
Signos y síntomas
El síndrome de Hunter puede presentarse con una amplia variedad de fenotipos . Tradicionalmente se ha clasificado como "leve" o "grave" según la presencia de síntomas del sistema nervioso central , pero esto es una simplificación excesiva. Los pacientes con formas "atenuadas" o "leves" de la enfermedad aún pueden sufrir problemas de salud importantes. Para los pacientes gravemente afectados, el curso clínico es relativamente predecible; los pacientes normalmente morirán a una edad temprana. Para aquellos con formas más leves de la enfermedad, existe una variedad más amplia de resultados. Muchos viven hasta los 20 y 30 años, pero algunos pueden tener una esperanza de vida casi normal. Las anomalías cardíacas y respiratorias son la causa habitual de muerte de los pacientes con formas más leves de la enfermedad.
Los síntomas del síndrome de Hunter (MPS II) generalmente no son evidentes al nacer. A menudo, los primeros síntomas pueden incluir hernias abdominales , infecciones de oído , secreción nasal y resfriados . A medida que la acumulación de GAG continúa en todas las células del cuerpo, los signos de MPS II se vuelven más visibles. El aspecto físico de muchos niños con el síndrome incluye una tosquedad distintiva en sus rasgos faciales, incluida una frente prominente , una nariz con un puente aplanado y una lengua agrandada . También pueden tener una cabeza grande , así como un abdomen agrandado. Para los casos graves de MPS II, a menudo se hace un diagnóstico entre las edades de 18 y 36 meses. En los casos más leves, los pacientes se presentan de manera similar a los niños con síndrome de Hurler-Scheie y, por lo general, el diagnóstico se realiza entre las edades de 4 y 8 años.
El almacenamiento continuo de GAG conduce a anomalías en múltiples sistemas de órganos. Después de los 18 meses, los niños con MPS II grave pueden sufrir un deterioro del desarrollo y una pérdida progresiva de habilidades. El engrosamiento de las válvulas cardíacas y las paredes del corazón puede provocar una disminución progresiva de la función cardíaca. Las paredes de las vías respiratorias también pueden engrosarse, lo que lleva a una enfermedad obstructiva de las vías respiratorias . A medida que el hígado y el bazo crecen con el tiempo, el abdomen puede dilatarse , lo que hace que las hernias sean más notorias. Todas las articulaciones principales pueden verse afectadas por MPS II, lo que provoca rigidez articular y movimiento limitado. La participación progresiva de las articulaciones de los dedos y el pulgar da como resultado una disminución de la capacidad para levantar objetos pequeños. Los efectos en otras articulaciones, como las caderas y las rodillas, pueden hacer que caminar normalmente sea cada vez más difícil. Si se desarrolla el síndrome del túnel carpiano , puede producirse una disminución adicional de la función de la mano. Los huesos mismos pueden verse afectados, lo que resulta en baja estatura. Además, se pueden encontrar lesiones cutáneas de guijarros de color marfil en la parte superior de los brazos, las piernas y la parte superior de la espalda de algunas personas que la padecen. Estas lesiones cutáneas se consideran patognómicas de la enfermedad. Por último, el almacenamiento de GAG en el cerebro puede provocar un retraso en el desarrollo con la consiguiente discapacidad intelectual y pérdida progresiva de la función.
La edad de inicio de los síntomas y la presencia o ausencia de alteraciones del comportamiento son factores predictivos de la gravedad final de la enfermedad en pacientes muy jóvenes. Los trastornos del comportamiento a menudo pueden imitar combinaciones de síntomas del trastorno por déficit de atención con hiperactividad , autismo , trastorno obsesivo compulsivo y / o trastorno del procesamiento sensorial , aunque la existencia y el nivel de los síntomas difieren en cada niño afectado. A menudo también incluyen la falta de una sensación apropiada de peligro y agresión. Los síntomas conductuales de MPS II generalmente preceden a la neurodegeneración y, a menudo, aumentan en gravedad hasta que las discapacidades mentales se vuelven más pronunciadas. En el momento de la muerte, la mayoría de los niños con MPS II grave tienen discapacidades mentales graves y dependen por completo de sus cuidadores.
Genética
Dado que el síndrome de Hunter es un trastorno recesivo ligado al cromosoma X, afecta preferentemente a pacientes masculinos. El gen IDS se encuentra en el cromosoma X. El gen IDS codifica una enzima llamada iduronato-2-sulfatasa (I2S). La falta de esta enzima conduce a una acumulación de GAG, que causa los síntomas de MPS II. Las mujeres generalmente tienen dos cromosomas X, mientras que los hombres generalmente tienen un cromosoma X que heredan de su madre y un cromosoma Y que heredan de su padre.
Si una mujer hereda una copia del alelo mutante de MPS II, generalmente tendrá una copia normal del gen IDS que puede compensar el alelo mutante. Esto se conoce como portador genético . Sin embargo, un hombre que hereda un cromosoma X defectuoso generalmente no tiene otro cromosoma X para compensar el gen mutante. Por lo tanto, una mujer necesitaría heredar dos genes mutantes para desarrollar MPS II, mientras que un paciente masculino solo necesita heredar un gen mutante. Una mujer portadora puede verse afectada debido a la inactivación de X , que es un proceso aleatorio.
Fisiopatología
El cuerpo humano depende de una amplia gama de reacciones bioquímicas para respaldar funciones críticas. Una de estas funciones es la descomposición de grandes biomoléculas . El fracaso de este proceso es el problema subyacente en el síndrome de Hunter y los trastornos de almacenamiento relacionados.
La bioquímica del síndrome de Hunter está relacionada con un problema en una parte del tejido conectivo conocida como matriz extracelular , que está formada por una variedad de azúcares y proteínas . Ayuda a formar el marco arquitectónico del cuerpo. La matriz rodea las células del cuerpo en una red organizada y funciona como el pegamento que mantiene unidas las células del cuerpo. Una de las partes de la matriz extracelular es una molécula llamada proteoglicano . Como muchos componentes del cuerpo, los proteoglicanos deben descomponerse y reemplazarse. Cuando el cuerpo descompone los proteoglicanos, uno de los productos resultantes son los mucopolisacáridos (GAG).
En MPS II, el problema se refiere a la descomposición de dos GAG: dermatán sulfato y heparán sulfato . El primer paso en la descomposición del dermatán sulfato y el heparán sulfato requiere la enzima lisosomal iduronato-2-sulfatasa, o I2S. En las personas con MPS II, esta enzima está parcial o completamente inactiva. Como resultado, los GAG se acumulan en las células de todo el cuerpo, particularmente en los tejidos que contienen grandes cantidades de dermatán sulfato y heparán sulfato. La tasa de acumulación de GAG no es la misma para todas las personas con MPS II, lo que resulta en un amplio espectro de problemas médicos.
Diagnóstico
La primera prueba de detección de laboratorio para un trastorno de MPS es una prueba de orina para detectar GAG. Los valores anormales indican que es probable que se produzca un trastorno de MPS. En ocasiones, la prueba de orina puede ser normal incluso si el niño realmente tiene un trastorno de MPS. Un diagnóstico definitivo de MPS II se realiza midiendo la actividad de I2S en suero , glóbulos blancos o fibroblastos de una biopsia de piel . En algunas personas con MPS II, el análisis del gen I2S puede determinar la gravedad clínica.
El diagnóstico prenatal está disponible de forma rutinaria midiendo la actividad enzimática de I2S en el líquido amniótico o en el tejido de las vellosidades coriónicas . Si se sabe que una mutación específica es hereditaria, se pueden realizar pruebas genéticas moleculares prenatales. La secuenciación del ADN puede revelar si alguien es portador de la enfermedad.
Tratamiento
Debido a la amplia variedad de fenotipos, el tratamiento de este trastorno se determina específicamente para cada paciente. Hasta hace poco, no se disponía de una terapia eficaz para MPS II, por lo que se utilizaron cuidados paliativos . Sin embargo, los avances recientes han dado lugar a medicamentos que pueden mejorar la supervivencia y el bienestar de las personas con MPS II.
Terapia de reemplazo de enzimas
La idursulfasa , una forma purificada de la enzima lisosomal faltante, se sometió a un ensayo clínico en 2006 y posteriormente fue aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos como tratamiento de reemplazo enzimático para MPS II. La idursulfasa beta, otro tratamiento de reemplazo enzimático, fue aprobado en Corea por el Ministerio de Seguridad de Alimentos y Medicamentos .
Se ha demostrado que los avances recientes en la terapia de reemplazo enzimático (ERT) con idursulfasa mejoran muchos signos y síntomas de MPS II, especialmente si se inicia temprano en la enfermedad. Después de la administración, se puede transportar a las células para descomponer los GAG, pero como el medicamento no puede atravesar la barrera hematoencefálica , no se espera que conduzca a una mejora cognitiva en pacientes con síntomas graves del sistema nervioso central. Incluso con ERT, es necesario el tratamiento de varios problemas de órganos por parte de una amplia variedad de especialistas médicos.
Trasplante de médula ósea y de células madre
El trasplante de médula ósea y el trasplante de células madre hematopoyéticas (TCMH) se han utilizado como tratamientos en algunos estudios. Si bien el trasplante ha proporcionado beneficios para muchos sistemas de órganos, no se ha demostrado que mejore los síntomas neurológicos de la enfermedad. Aunque el TCMH se ha mostrado prometedor en el tratamiento de otros trastornos de MPS, sus resultados hasta ahora no han sido satisfactorios en el tratamiento de MPS II. Se ha demostrado que la ERT conduce a mejores resultados en pacientes con MPS II.
Terapia de edición genética
En febrero de 2019, los científicos médicos que trabajan con Sangamo Therapeutics , con sede en Richmond , California, anunciaron la primera terapia de edición de genes humanos "en el cuerpo" para alterar permanentemente el ADN , en un paciente con MPS II. Los ensayos clínicos de Sangamo que involucran la edición de genes usando nucleasa de dedos de zinc están en curso a partir de febrero de 2019.
Pronóstico
La aparición más temprana de los síntomas está relacionada con un peor pronóstico. En el caso de los niños que presentan síntomas entre las edades de 2 y 4 años, la muerte suele ocurrir entre los 15 y los 20 años. La causa de la muerte suele deberse a complicaciones neurológicas, enfermedad obstructiva de las vías respiratorias e insuficiencia cardíaca. Si los pacientes tienen una afectación neurológica mínima, pueden sobrevivir hasta los 50 años o más.
Epidemiología
Se estima que 2000 personas padecen MPS II en todo el mundo, 500 de las cuales viven en los Estados Unidos.
Un estudio en el Reino Unido indicó una incidencia entre los hombres de alrededor de uno de cada 130.000 varones nacidos vivos.
Historia
El síndrome lleva el nombre del médico Charles A. Hunter (1873-1955), quien lo describió por primera vez en 1917.
Investigar
A partir de 2010, un ensayo clínico de fase I / II evaluó inyecciones intratecales de una dosis más concentrada de idursulfasa que la formulación intravenosa utilizada en las infusiones de terapia de reemplazo enzimático, con la esperanza de prevenir el deterioro cognitivo asociado con la forma grave de la afección. Los resultados se informaron en octubre de 2013. En 2014 se inició un ensayo clínico de fase II / III.
En 2017, un paciente de 44 años con MPS II fue tratado con terapia génica en un intento de prevenir un daño mayor por la enfermedad. Este es el primer caso de terapia génica que se utiliza in vivo en humanos. El estudio se amplió a seis pacientes en 2018.
Sociedad
El 24 de julio de 2004, Andrew Wragg, de 38 años, de Worthing , West Sussex , Inglaterra , asfixió a su hijo de 10 años, Jacob, con una almohada, debido a las discapacidades del niño relacionadas con MPS II. Un especialista en seguridad militar , Wragg también afirmó que estaba bajo estrés después de regresar de la guerra en Irak . Negó haber asesinado a Jacob, pero se declaró culpable de homicidio involuntario debido a su capacidad disminuida. La jueza Anne Rafferty, calificó el caso de "excepcional", le dio a Wragg una sentencia de prisión de dos años por homicidio involuntario y luego suspendió su sentencia por dos años. Rafferty dijo que "no se ganaría nada" enviando a Wragg a prisión por el crimen.
Ver también
- Síndrome de Hurler ( MPS I )
- Síndrome de Sanfilippo (MPS III)
- Síndrome de Morquio (MPS IV)
- Pruebas prenatales
- Asesoramiento genetico
Referencias
enlaces externos
-
 Medios relacionados con el síndrome de Hunter en Wikimedia Commons
Medios relacionados con el síndrome de Hunter en Wikimedia Commons - Entrada de GeneReview / NIH / UW sobre mucopolisacaridosis tipo II
| Clasificación | |
|---|---|
| Recursos externos |