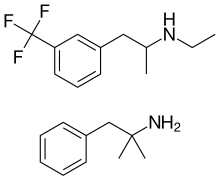
Fenfluramina / fentermina - Fenfluramine/phentermine
 | |
 | |
| Combinación de | |
|---|---|
| Fenfluramina | Serotoninérgico |
| Fentermina | Adrenérgico , dopaminérgico , serotoninérgico |
| Datos clinicos | |
| Vías de administración |
Oral |
| Código ATC | |
| Estatus legal | |
| Estatus legal | |
| Identificadores | |
| Número CAS | |
| (verificar) | |
La combinación de medicamentos fenfluramina / fentermina , generalmente llamada fen-fen , era un tratamiento contra la obesidad que utilizaba dos anoréxicos . La fenfluramina fue comercializada por American Home Products (más tarde conocida como Wyeth ) como Pondimin , pero se demostró que causa hipertensión pulmonar potencialmente fatal y problemas en las válvulas cardíacas , lo que eventualmente llevó a su retiro y daños legales por más de $ 13 mil millones. No se ha demostrado que la fentermina tenga efectos nocivos.
La fenfluramina actúa como un agente liberador de serotonina , la fentermina principalmente como un agente liberador de noradrenalina . La fentermina también induce la liberación de serotonina y dopamina, aunque en un grado mucho menor de lo que induce la liberación de noradrenalina.
Historia
La fenfluramina como fármaco único se introdujo por primera vez en la década de 1970, pero no fue popular porque solo redujo el peso temporalmente. Un estudio de 1984 encontró una pérdida de peso de 7,5 kg en promedio en 24 semanas, en comparación con 4,4 kg con placebo. Se vendió modestamente hasta la década de 1990, cuando se combinó con fentermina y se comercializó mucho. Un fármaco similar, el aminorex , había causado un daño pulmonar severo y "proporcionó motivos para preocuparse de que fármacos similares ... pudieran aumentar el riesgo de una enfermedad pulmonar rara pero a menudo mortal, la hipertensión pulmonar". En 1994, el funcionario de Wyeth Fred Wilson expresó su preocupación por el etiquetado de fenfluramina que contenía solo cuatro casos de hipertensión pulmonar cuando se habían observado un total de 41, pero no se tomó ninguna medida hasta 1996. En 1995, Wyeth introdujo la dexfenfluramina (el isómero dextro , comercializado como Redux ), que esperaba causaría menos efectos adversos. Sin embargo, el oficial médico de la Administración de Alimentos y Medicamentos (FDA), Leo Lutwak , insistió en una advertencia de recuadro negro sobre los riesgos de hipertensión pulmonar. Después de que Lutwak se negó a aprobar el medicamento, la administración de la FDA hizo que James Milton Bilstad, evaluador senior de medicamentos de la FDA, lo firmara y lo aprobara sin una advertencia de recuadro negro para su comercialización en 1996. Los reguladores europeos requerían una advertencia importante sobre los riesgos de hipertensión pulmonar.
En 1996, una mujer de 30 años desarrolló problemas cardíacos después de un mes de usar fenfluramina / fentermina; cuando murió en febrero de 1997, el Boston Herald le dedicó un artículo de primera plana. Más tarde ese mismo año, en agosto de 1997, un artículo en el New England Journal of Medicine (NEJM) de la Clínica Mayo discutió los hallazgos clínicos en 24 personas que habían tomado fen-phen. Los autores señalaron que sus hallazgos sugerían una posible correlación entre la disfunción de la válvula mitral y el uso de estos agentes anoréxicos. La FDA alertó a los médicos de que había recibido nueve informes adicionales del mismo tipo y solicitó a todos los profesionales de la salud que informaran sobre tales casos al programa MedWatch de la agencia oa sus respectivos fabricantes farmacéuticos. Posteriormente, la FDA recibió más de cien informes adicionales de enfermedad cardíaca valvular en personas que tomaban fen-phen, fenfluramine solo o dexfenfluramine solo. La FDA solicitó a los fabricantes de fenfluramina y dexfenfluramina enfatizar el riesgo potencial para el corazón en el etiquetado de los medicamentos y en los prospectos. En 1997, la FDA continuaba recibiendo informes de valvulopatías cardíacas en personas que habían tomado estos medicamentos. Esta enfermedad generalmente involucra las válvulas aórtica y mitral.
Después de informes de valvulopatía e hipertensión pulmonar, principalmente en mujeres que habían estado en tratamiento con fen-phen o (dex) fenfluramine, la FDA solicitó su retiro del mercado en septiembre de 1997.
La acción se basó en los hallazgos de los médicos que habían evaluado a las personas que tomaban estos dos medicamentos con ecocardiogramas , un procedimiento que puede evaluar el funcionamiento de las válvulas cardíacas. Los hallazgos indicaron que aproximadamente el 30 por ciento de las personas que habían tomado la combinación hasta 24 meses tenían ecocardiogramas anormales, aunque no presentaban síntomas. Este porcentaje de resultados anormales de las pruebas fue mucho más alto de lo que cabría esperar de una muestra de población de tamaño comparativo que no había estado expuesta ni a la fenfluramina ni a la dexfenfluramina. Los estudios de seguimiento mostraron que para las personas que tomaron la combinación durante 3 meses o menos, la tasa de complicaciones de las válvulas cardíacas fue inferior al 3%.
Secuelas
Tras la divulgación de la información sobre los riesgos cardíacos de fen-phen, la Asociación de Abogados Litigantes de América formó un gran grupo de abogados litigantes para reclamar daños y perjuicios a American Home Products, el distribuidor de fenfluramina y dexfenfluramina.
Fen-phen ya no está ampliamente disponible. En abril de 2005, la revista American Lawyer publicó un artículo de portada sobre la ola de litigios fen-phen, informando que más de 50.000 demandas por responsabilidad del producto habían sido presentadas por presuntas víctimas de fen-phen. Las estimaciones de la responsabilidad total ascendieron a 14.000 millones de dólares. En febrero de 2005, Wyeth todavía estaba en negociaciones con las partes lesionadas, ofreciendo acuerdos de $ 5,000 a $ 200,000 a algunos de los que habían demandado, y afirmando que podrían ofrecer más a los que resultaron más gravemente heridos. El abogado de un demandante afirmó que "los pagos [iban a] no ser lo suficientemente grandes para cubrir los gastos médicos". Miles de heridos rechazaron estas ofertas. En ese momento, Wyeth anunció que había reservado 21.100 millones de dólares (EE.UU.) para cubrir el costo de las demandas.
Posibles usos
Obesidad
En 1984, investigadores del Centro Médico de la Universidad de Rochester informaron que habían realizado un ensayo clínico controlado, doble ciego, comparando fentermina sola, fenfluramina sola, una combinación de fentermina y fenfluramina, y placebo, para la pérdida de peso en humanos. La pérdida de peso en los que recibieron la combinación fen-phen fue significativamente mayor (8,4 ± 1,1 kg) que en los que recibieron placebo (4,4 ± 0,9 kg) y equivalente a la de los que recibieron fenfluramina (7,5 ± 1,2 kg) o fentermina sola (10,0 ± 0,9 kg). 1,2 kg). Esto equivale a una pérdida de peso adicional de 4 ± 2 kg en el transcurso de 24 semanas. Los efectos adversos fueron menos frecuentes con el régimen de combinación que con los otros tratamientos activos (no placebo). Los autores sintieron que la combinación de fenfluramina y fentermina capitalizó sus diferencias farmacodinámicas , lo que resultó en una pérdida de peso equivalente, menos efectos adversos y un mejor control del apetito.
Adiccion
El término fen-phen fue acuñado en 1994 cuando Pietr Hitzig y Richard B. Rothman informaron que esta combinación podría presuntamente remitir el deseo de consumir alcohol y cocaína. Los autores sugirieron que otros agonistas o precursores combinados de dopamina y serotonina podrían compartir este potencial terapéutico. Experimentos posteriores en ratas apoyaron estos informes preliminares. En 2006 se confirmó que la combinación de fentermina y el precursor de la serotonina 5-hidroxitriptófano (5-HTP), en lugar de fenfluramina, redujo significativamente las convulsiones por abstinencia de alcohol en ratas.
Se diseñaron protocolos de doble ciego intramuros de los Institutos Nacionales de Salud (NIH) para demostrar la eficacia del fen-fen en la adicción al alcohol y la cocaína, pero nunca se llevaron a cabo.
Efectos adversos
Los hallazgos sobre fen-phen, específicamente fenfluramina, que causa valvulopatía cardíaca e hipertensión pulmonar, provocaron un renovado interés en los efectos deletéreos de la serotonina sistémica. Ya se sabía desde hace décadas que dos de los principales efectos secundarios del síndrome carcinoide , en el que se produce un exceso de serotonina de forma endógena, son las valvulopatías y la hipertensión pulmonar. Varios centros pudieron observar una relación con una activación excesiva del subtipo de receptor de serotonina 5-HT 2B .
Referencias
enlaces externos
- Frontline :Prescripciones peligrosas - Entrevista con Leo Lutwak, en la que analiza los efectos secundarios de la fenfluramina (Pondimin), su sucesora dexfenfluramina (Redux) y la combinación fen-phen.
- Información sobre fen-phen de la FDA de EE. UU.
- Tellier P (noviembre de 2001). "Fenfluraminas, hipertensión pulmonar primaria idiopática y trastornos de la válvula cardíaca: hechos y artefactos". Annales de Médecine Interne . 152 (7): 429–36. PMID 11965083 .
