Ditiotreitol - Dithiothreitol
|
|

|
|
| Nombres | |
|---|---|
|
Nombre IUPAC preferido
(2 S , 3 S ) -1,4-Bis (sulfanil) butano-2,3-diol |
|
| Otros nombres
(2 S , 3 S ) -1,4-Dimercaptobutano-2,3-diol
D - treo -1,4-Dimercaptobutano-2,3-diol D - treo -1,4-Dimercapto-2,3-butanodiol 1 , 4-Ditio- D -treitol Reactivo de Cleland Reductacryl |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| DrugBank | |
| Tarjeta de información ECHA |
100.020.427 |
|
PubChem CID
|
|
| UNII | |
|
Tablero CompTox ( EPA )
|
|
|
|
|
|
| Propiedades | |
| C 4 H 10 O 2 S 2 | |
| Masa molar | 154,253 g / mol |
| Apariencia | Blanco sólido |
| Punto de fusion | 42 a 43 ° C (108 a 109 ° F; 315 a 316 K) |
| Punto de ebullición | 125 a 130 ° C (257 a 266 ° F; 398 a 403 K) a 2 mmHg |
| Soluble | |
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencias de Infobox | |
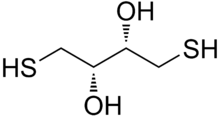
Ditiotreitol ( DTT ) es el nombre común de un reactivo redox de molécula pequeña también conocido como reactivo de Cleland . La fórmula de DTT es C 4 H 10 O 2 S 2 y la estructura química de uno de sus enantiómeros en su forma reducida se muestra a la derecha; su forma oxidada es un anillo de 6 miembros unido por enlaces disulfuro (que se muestra a continuación). El reactivo se usa comúnmente en su forma racémica, ya que ambos enantiómeros son reactivos. Su nombre deriva del azúcar de cuatro carbonos , threose . El DTT tiene un compuesto epimérico ("hermano"), ditioeritritol (DTE).
Agente reductor
DTT es un agente reductor ; una vez oxidado, forma un anillo estable de seis miembros con un enlace disulfuro interno . Tiene un potencial redox de −0,33 V a pH 7. La reducción de un enlace disulfuro típico se produce mediante dos reacciones secuenciales de intercambio tiol-disulfuro y se ilustra a continuación. La reducción generalmente no se detiene en las especies de disulfuro mixto porque el segundo tiol de DTT tiene una alta propensión a cerrar el anillo, formando DTT oxidado y dejando un enlace disulfuro reducido . El poder reductor de la TDT se limita a valores de pH por encima de 7, ya que sólo la carga negativa tiolato forma -S - es reactivo (el protonado tiol forma -SH no lo es); el pKa de los grupos tiol es 9.2 y 10.1.

Aplicaciones
El DTT se utiliza como agente reductor o "desprotector" del ADN tiolado. Los átomos de azufre terminales del ADN tiolado tienen tendencia a formar dímeros en solución, especialmente en presencia de oxígeno. La dimerización reduce en gran medida la eficacia de las reacciones de acoplamiento posteriores, como la inmovilización de ADN sobre oro en biosensores. Normalmente, el DTT se mezcla con una solución de ADN y se deja reaccionar, y luego se elimina por filtración (para el catalizador sólido) o por cromatografía (para la forma líquida). El procedimiento de eliminación de TDT a menudo se denomina "desalación". Generalmente, el DTT se usa como agente protector que previene la oxidación de los grupos tiol .
El DTT se usa con frecuencia para reducir los enlaces disulfuro de proteínas y, más generalmente, para evitar que se formen enlaces disulfuro intramoleculares e intermoleculares entre residuos de cisteína de proteínas. Sin embargo, incluso el DTT no puede reducir los enlaces disulfuro enterrados (inaccesibles al disolvente), por lo que la reducción de los enlaces disulfuro a veces se lleva a cabo en condiciones de desnaturalización (p. Ej., A altas temperaturas o en presencia de un desnaturalizante fuerte como el cloruro de guanidinio 6 M , 8). Urea M o dodecilsulfato de sodio al 1% ). El DTT se usa a menudo junto con el dodecilsulfato de sodio en SDS-PAGE para desnaturalizar aún más las proteínas al reducir sus enlaces disulfuro para permitir una mejor separación de las proteínas durante la electroforesis . Debido a la capacidad de reducir los enlaces disulfuro, el DTT se puede utilizar para desnaturalizar el CD38 en los glóbulos rojos. El DTT también desnaturalizará los antígenos de los sistemas de grupos sanguíneos Kell, Lutheran, Dombrock, Cromer, Cartwright, LW y Knops. Por el contrario, la exposición al disolvente de diferentes enlaces disulfuro puede evaluarse por su tasa de reducción en presencia de DTT.
El DTT también se puede utilizar como agente oxidante . Su principal ventaja es que efectivamente no se pueblan especies de disulfuro mixto, a diferencia de otros agentes como el glutatión . En casos muy raros, se puede formar un aducto de DTT , es decir, los dos átomos de azufre de DTT pueden formar enlaces disulfuro con diferentes átomos de azufre; en tales casos, DTT no puede ciclar ya que no tiene tales tioles libres restantes.
Propiedades
El DTT es inestable en condiciones atmosféricas ambientales ya que se oxida con oxígeno; El DTT debe almacenarse y manipularse bajo gases inertes para evitar la oxidación. La vida útil del ditiotreitol se puede extender con refrigeración a 2–8 ° C. La oxidación presenta complicaciones adicionales ya que el DTT oxidado exhibe un fuerte pico de absorbancia a 280 nm. Dado que los tioles son menos nucleófilos que sus bases conjugadas, los tiolatos , el DTT se convierte en un nucleófilo menos potente a medida que desciende el pH. (2 S ) -2-Amino-1,4-dimercaptobutano (ditiobutilamina o DTBA) es un nuevo agente reductor de ditiol que supera de alguna manera esta limitación de DTT. La tris (2-carboxietil) fosfina ( TCEP ) es un agente reductor alternativo que es más estable y eficaz a pH bajo, pero es voluminoso y reduce las cistinas en las proteínas plegadas solo lentamente.
La vida media del DTT es de 40 horas a pH 6,5 y 1,4 horas a pH 8,5 y 20 ° C; su vida media disminuye aún más a medida que aumenta la temperatura. La presencia de EDTA (ácido etilendiaminotetraacético) para quelar los iones metálicos divalentes (Fe 2+ , Cu 2+ y otros) aumenta considerablemente la vida media del DTT en solución.
Referencias
enlaces externos
-
 Medios relacionados con el ditiotreitol en Wikimedia Commons
Medios relacionados con el ditiotreitol en Wikimedia Commons
