Cromatografía - Chromatography
| Parte de una serie sobre |
| Mecánica de Medios Continuos |
|---|
| Parte de una serie sobre |
| Química |
|---|

|
En análisis químico , la cromatografía es una técnica de laboratorio para la separación de una mezcla. La mezcla se disuelve en un fluido (gas o disolvente) denominado fase móvil, que la transporta a través de un sistema (una columna, un tubo capilar, una placa o una lámina) sobre el que se fija un material denominado fase estacionaria . Los diferentes componentes de la mezcla tienen diferentes afinidades por la fase estacionaria. Las diferentes moléculas permanecen más o menos en la fase estacionaria, dependiendo de sus interacciones con sus sitios de superficie. Por lo tanto, viajan a diferentes velocidades aparentes en el fluido móvil, lo que hace que se separen. La separación se basa en la división diferencial entre las fases móvil y estacionaria. Las diferencias sutiles en el coeficiente de partición de un compuesto dan como resultado una retención diferencial en la fase estacionaria y, por lo tanto, afectan la separación.
La cromatografía puede ser preparativa o analítica. El propósito de la cromatografía preparativa es separar los componentes de una mezcla para su uso posterior y, por tanto, es una forma de purificación . La cromatografía analítica se realiza normalmente con cantidades más pequeñas de material y sirve para establecer la presencia o medir las proporciones relativas de analitos en una mezcla. Los dos no son mutuamente excluyentes.
Etimología y pronunciación
Chromatography, pronunciada / ˌ k r oʊ m ə t ɒ ɡ r ə f i / , se deriva de griego χρῶμα croma , que significa " de color ", y γράφειν graphein , que significa "escribir". La combinación de estos dos términos se heredó directamente de la invención de la técnica que se utilizó por primera vez para separar los pigmentos.
Historia
La cromatografía fue ideada por primera vez en Rusia por el científico italiano Mikhail Tsvet en 1900. Desarrolló la técnica, acuñó la cromatografía, en la primera década del siglo XX, principalmente para la separación de pigmentos vegetales como clorofila , carotenos y xantofilas. . Dado que estos componentes se separan en bandas de diferentes colores (verde, naranja y amarillo, respectivamente), inspiraron directamente el nombre de la técnica. Los nuevos tipos de cromatografía desarrollados durante las décadas de 1930 y 1940 hicieron que la técnica fuera útil para muchos procesos de separación .
La técnica de la cromatografía se desarrolló sustancialmente como resultado del trabajo de Archer John Porter Martin y Richard Laurence Millington Synge durante las décadas de 1940 y 1950, por lo que ganaron el Premio Nobel de Química de 1952 . Establecieron los principios y técnicas básicas de la cromatografía de partición, y su trabajo alentó el rápido desarrollo de varios métodos cromatográficos: cromatografía en papel , cromatografía de gases y lo que se conocería como cromatografía líquida de alta resolución . Desde entonces, la tecnología ha avanzado rápidamente. Los investigadores encontraron que los principios fundamentales de la cromatografía de Tsvet podrían aplicarse de muchas formas diferentes, dando como resultado las diferentes variedades de cromatografía que se describen a continuación. Los avances están mejorando continuamente el rendimiento técnico de la cromatografía, lo que permite la separación de moléculas cada vez más similares.
Términos de cromatografía
- Analito : la sustancia que se va a separar durante la cromatografía. También es normalmente lo que se necesita de la mezcla.
- Cromatografía analítica : el uso de cromatografía para determinar la existencia y posiblemente también la concentración de analitos en una muestra .
- Fase ligada: una fase estacionaria que está unida covalentemente a las partículas de soporte o a la pared interior de la tubería de la columna.
-
Cromatograma : la salida visual del cromatógrafo. En el caso de una separación óptima, diferentes picos o patrones en el cromatograma corresponden a diferentes componentes de la mezcla separada.

 En el eje x se representa el tiempo de retención y en el eje y se representa una señal (por ejemplo, obtenida mediante un espectrofotómetro , espectrómetro de masas o una variedad de otros detectores) correspondiente a la respuesta creada por los analitos que salen del sistema. En el caso de un sistema óptimo, la señal es proporcional a la concentración del analito específico separado.
En el eje x se representa el tiempo de retención y en el eje y se representa una señal (por ejemplo, obtenida mediante un espectrofotómetro , espectrómetro de masas o una variedad de otros detectores) correspondiente a la respuesta creada por los analitos que salen del sistema. En el caso de un sistema óptimo, la señal es proporcional a la concentración del analito específico separado. - Cromatógrafo o aerógrafo : instrumento que permite una separación sofisticada, por ejemplo, cromatografía de gases o cromatográfica líquida.
- Cromatografía : método físico de separación que distribuye los componentes para separarlos entre dos fases, una estacionaria (fase estacionaria) y la otra (la fase móvil) que se mueve en una dirección definida.
- Eluyente (a veces deletreado eluyente ): el disolvente o la mezcla de disolventes que se utiliza en la cromatografía de elución y es sinónimo de fase móvil .
- Eluido : la mezcla de soluto (ver Eluite) y solvente (ver Eluyente) que sale de la columna.
- Efluente : la corriente que sale de una columna cromatográfica. En la práctica, se usa como sinónimo de eluato , pero el término se refiere más precisamente a la corriente independientemente de la separación que tenga lugar.
- Eluite : un término más preciso para soluto o analito . Es un componente de la muestra que sale de la columna cromatográfica.
- Serie eluotrópica : una lista de disolventes clasificados según su poder de elución.
- Fase inmovilizada : una fase estacionaria que está inmovilizada en las partículas de soporte o en la pared interna de la tubería de la columna.
- fase móvil - la fase que se mueve en una dirección definida. Puede ser un líquido (LC y electrocromatografía capilar (CEC)), un gas (GC) o un fluido supercrítico (cromatografía de fluido supercrítico, SFC). La fase móvil consiste en la muestra que se separa / analiza y el solvente que mueve la muestra a través de la columna. En el caso de HPLC, la fase móvil consiste en uno o más solventes no polares como hexano en fase normal o un solvente polar como metanol en cromatografía de fase inversa y la muestra que se separa. La fase móvil se mueve a través de la columna de cromatografía (la fase estacionaria) donde la muestra interactúa con la fase estacionaria y se separa.
- Cromatografía preparativa : el uso de cromatografía para purificar cantidades suficientes de una sustancia para su uso posterior, en lugar de análisis.
- Tiempo de retención : el tiempo característico que tarda un analito en particular en pasar a través del sistema (desde la entrada de la columna al detector) en condiciones establecidas. Ver también: índice de retención de Kovats
- Muestra : la materia analizada en cromatografía. Puede consistir en un solo componente o puede ser una mezcla de componentes. Cuando la muestra se trata en el curso de un análisis, la fase o las fases que contienen los analitos de interés se denominan muestra, mientras que todo lo que no interesa separado de la muestra antes o en el curso del análisis se denomina como desperdicio.
- Soluto : los componentes de la muestra en la cromatografía de partición.
- Disolvente : cualquier sustancia capaz de solubilizar otra sustancia, y especialmente la fase móvil líquida en cromatografía líquida.
- Fase estacionaria : sustancia fijada en el lugar para el procedimiento de cromatografía. Los ejemplos incluyen la capa de sílice en cromatografía de capa fina
- Detector : el instrumento utilizado para la detección cualitativa y cuantitativa de analitos después de la separación.
La cromatografía se basa en el concepto de coeficiente de partición. Cualquier soluto se divide entre dos disolventes inmiscibles. Cuando inmovilizamos un solvente (por adsorción en una matriz de soporte sólido) y otro móvil resulta en las aplicaciones más comunes de la cromatografía. Si el soporte de la matriz, o fase estacionaria, es polar (por ejemplo, papel, sílice, etc.) es cromatografía de fase directa, y si es no polar (C-18) es fase inversa.
Técnicas por forma de lecho cromatográfico
Cromatografía de columna
La cromatografía en columna es una técnica de separación en la que el lecho estacionario está dentro de un tubo. Las partículas de la fase estacionaria sólida o el soporte recubierto con una fase estacionaria líquida pueden llenar todo el volumen interior del tubo (columna empaquetada) o concentrarse sobre o a lo largo de la pared interior del tubo dejando un camino abierto e irrestricto para la fase móvil en la parte media del tubo (columna tubular abierta). Las diferencias en las velocidades de movimiento a través del medio se calculan para diferentes tiempos de retención de la muestra. En 1978, W. Clark Still introdujo una versión modificada de la cromatografía en columna llamada cromatografía en columna ultrarrápida (flash). La técnica es muy similar a la cromatografía en columna tradicional, excepto que el disolvente pasa a través de la columna aplicando presión positiva. Esto permitió que la mayoría de las separaciones se realizaran en menos de 20 minutos, con separaciones mejoradas en comparación con el método anterior. Los sistemas de cromatografía ultrarrápida modernos se venden como cartuchos de plástico preenvasados y el disolvente se bombea a través del cartucho. Los sistemas también pueden estar vinculados con detectores y recolectores de fracciones que proporcionan automatización. La introducción de bombas de gradiente resultó en separaciones más rápidas y menos uso de solventes.
En la adsorción en lecho expandido , se usa un lecho fluidizado, en lugar de una fase sólida hecha por un lecho empacado. Esto permite la omisión de los pasos de limpieza iniciales, como la centrifugación y la filtración, para caldos de cultivo o pastas de células rotas.
La cromatografía de fosfocelulosa utiliza la afinidad de unión de muchas proteínas de unión al ADN por la fosfocelulosa. Cuanto más fuerte es la interacción de una proteína con el ADN, mayor es la concentración de sal necesaria para eluir esa proteína.
Cromatografía plana
La cromatografía plana es una técnica de separación en la que la fase estacionaria está presente como o en un plano. El plano puede ser un papel, que sirva como tal o impregnado por una sustancia como lecho estacionario ( cromatografía en papel ) o una capa de partículas sólidas esparcidas sobre un soporte como una placa de vidrio ( cromatografía en capa fina ). Los diferentes compuestos en la mezcla de muestra viajan diferentes distancias según la fuerza con la que interactúan con la fase estacionaria en comparación con la fase móvil. El factor de retención específico (R f ) de cada sustancia química se puede utilizar para ayudar en la identificación de una sustancia desconocida.
Cromatografía en papel
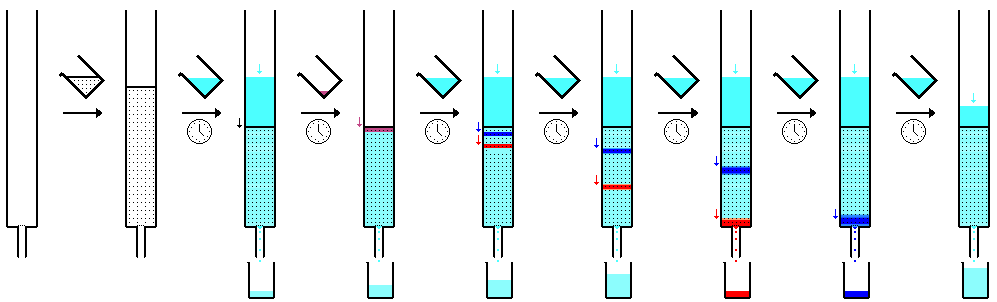
La cromatografía en papel es una técnica que consiste en colocar un pequeño punto o línea de solución de muestra en una tira de papel cromatográfico . El papel se coloca en un recipiente con una capa poco profunda de disolvente y se sella. A medida que el solvente sube a través del papel, se encuentra con la mezcla de muestra, que comienza a viajar por el papel con el solvente. Este papel está hecho de celulosa , una sustancia polar , y los compuestos dentro de la mezcla viajan más lejos si son menos polares. Las sustancias más polares se unen con el papel de celulosa más rápidamente y, por lo tanto, no viajan tan lejos.
Cromatografía de capa fina (TLC)
La cromatografía de capa fina (TLC) es una técnica de laboratorio ampliamente empleada para separar diferentes productos bioquímicos sobre la base de sus atracciones relativas a las fases estacionaria y móvil. Es similar a la cromatografía en papel . Sin embargo, en lugar de utilizar una fase estacionaria de papel, se trata de una fase estacionaria de una capa delgada de adsorbente como gel de sílice , alúmina o celulosa sobre un sustrato plano e inerte . TLC es muy versátil; Se pueden separar varias muestras simultáneamente en la misma capa, lo que la hace muy útil para aplicaciones de detección, como pruebas de niveles de fármacos y pureza del agua. La posibilidad de contaminación cruzada es baja ya que cada separación se realiza en una nueva capa. En comparación con el papel, tiene la ventaja de realizar tiradas más rápidas, mejores separaciones, mejor análisis cuantitativo y la posibilidad de elegir entre diferentes adsorbentes. Para una resolución aún mejor y una separación más rápida que utiliza menos disolvente, se puede utilizar TLC de alto rendimiento . Un uso popular más antiguo había sido para diferenciar cromosomas observando la distancia en gel (la separación de era un paso separado).
Cromatografía de desplazamiento
El principio básico de la cromatografía de desplazamiento es: una molécula con una alta afinidad por la matriz cromatográfica (el desplazador) compite eficazmente por los sitios de unión y, por tanto, desplaza todas las moléculas con menor afinidad. Existen claras diferencias entre la cromatografía de desplazamiento y de elución. En el modo de elución, las sustancias normalmente emergen de una columna en picos gaussianos estrechos. Se desea una amplia separación de picos, preferiblemente hasta la línea base, para una purificación máxima. La velocidad a la que cualquier componente de una mezcla desciende por la columna en el modo de elución depende de muchos factores. Pero para que dos sustancias viajen a diferentes velocidades y, por lo tanto, se resuelvan, debe haber diferencias sustanciales en alguna interacción entre las biomoléculas y la matriz cromatográfica. Los parámetros operativos se ajustan para maximizar el efecto de esta diferencia. En muchos casos, la separación de la línea base de los picos se puede lograr solo con elución en gradiente y cargas de columna bajas. Por tanto, dos inconvenientes de la cromatografía en modo de elución, especialmente a escala preparativa, son la complejidad operativa, debido al bombeo de disolvente en gradiente, y el bajo rendimiento, debido a las bajas cargas de la columna. La cromatografía de desplazamiento tiene ventajas sobre la cromatografía de elución en que los componentes se resuelven en zonas consecutivas de sustancias puras en lugar de "picos". Debido a que el proceso aprovecha la no linealidad de las isotermas, se puede separar una alimentación de columna más grande en una columna determinada con los componentes purificados recuperados en concentraciones significativamente más altas.
Técnicas por estado físico de fase móvil
Cromatografía de gases
La cromatografía de gases (GC), también conocida a veces como cromatografía de gas-líquido (GLC), es una técnica de separación en la que la fase móvil es un gas. La separación por cromatografía de gases siempre se lleva a cabo en una columna, que normalmente está "empaquetada" o "capilar". Las columnas empaquetadas son los caballos de trabajo rutinarios de la cromatografía de gases, son más baratas y fáciles de usar y, a menudo, brindan un rendimiento adecuado. Las columnas capilares generalmente brindan una resolución muy superior y, aunque son más caras, se están utilizando ampliamente, especialmente para mezclas complejas. Además, las columnas capilares se pueden dividir en tres clases: columnas tubulares abiertas de capa porosa (PLOT), tubulares abiertas revestidas de pared (WCOT) y tubulares abiertas revestidas de soporte (SCOT). Las columnas PLOT son únicas en el sentido de que la fase estacionaria se adsorbe a las paredes de la columna, mientras que las columnas WCOT tienen una fase estacionaria que está unida químicamente a las paredes. Las columnas SCOT son, en cierto modo, la combinación de los dos tipos mencionados de manera que tienen partículas de soporte adheridas a las paredes de la columna, pero esas partículas tienen una fase líquida unida químicamente a ellas. Ambos tipos de columna están hechos de materiales no adsorbentes y químicamente inertes. El acero inoxidable y el vidrio son los materiales habituales para las columnas empaquetadas y el cuarzo o sílice fundida para las columnas capilares.
La cromatografía de gases se basa en un equilibrio de partición del analito entre una fase estacionaria líquida sólida o viscosa (a menudo un material a base de silicona líquida) y un gas móvil (con mayor frecuencia helio). La fase estacionaria se adhiere al interior de un tubo de vidrio o de sílice fundida (una columna capilar) de diámetro pequeño (comúnmente 0,53 - 0,18 mm de diámetro interior) o una matriz sólida dentro de un tubo de metal más grande (una columna empaquetada). Es muy utilizado en química analítica ; aunque las altas temperaturas utilizadas en GC lo hacen inadecuado para biopolímeros o proteínas de alto peso molecular (el calor los desnaturaliza), que se encuentran con frecuencia en bioquímica , es muy adecuado para su uso en los campos petroquímico , monitoreo y remediación ambiental y química industrial . También se utiliza ampliamente en la investigación química.
Cromatografía líquida
La cromatografía líquida (LC) es una técnica de separación en la que la fase móvil es un líquido. Se puede realizar tanto en columna como en plano. La cromatografía líquida actual, que generalmente utiliza partículas de relleno muy pequeñas y una presión relativamente alta, se denomina cromatografía líquida de alta resolución (HPLC).
En HPLC, la muestra es forzada por un líquido a alta presión (la fase móvil) a través de una columna que está empaquetada con una fase estacionaria compuesta por partículas de forma irregular o esférica, una capa monolítica porosa o una membrana porosa. La HPLC se ha dividido históricamente en dos subclases diferentes según la polaridad de las fases móvil y estacionaria. Los métodos en los que la fase estacionaria es más polar que la fase móvil (p. Ej., Tolueno como fase móvil, sílice como fase estacionaria) se denominan cromatografía líquida en fase normal (NPLC) y lo contrario (p. Ej., Mezcla de agua y metanol como fase móvil). fase y C18 ( octadecilsililo ) como fase estacionaria) se denomina cromatografía líquida de fase inversa (RPLC).
Las técnicas específicas bajo este amplio título se enumeran a continuación.
Cromatografía de afinidad
La cromatografía de afinidad se basa en la interacción selectiva no covalente entre un analito y moléculas específicas. Es muy específico, pero no muy robusto. Se utiliza a menudo en bioquímica en la purificación de proteínas unidas a etiquetas. Estas proteínas de fusión están marcadas con compuestos como etiquetas His , biotina o antígenos , que se unen específicamente a la fase estacionaria. Después de la purificación, estas etiquetas generalmente se eliminan y se obtiene la proteína pura.
La cromatografía de afinidad a menudo utiliza la afinidad de una biomolécula por un metal (Zn, Cu, Fe, etc.). Las columnas a menudo se preparan manualmente. Las columnas de afinidad tradicionales se utilizan como paso preparativo para eliminar biomoléculas no deseadas.
Sin embargo, existen técnicas de cromatografía líquida que utilizan propiedades de cromatografía de afinidad. La cromatografía de afinidad por metales inmovilizados (IMAC) es útil para separar las moléculas antes mencionadas basándose en la afinidad relativa por el metal. A menudo, estas columnas se pueden cargar con diferentes metales para crear una columna con una afinidad específica.
Cromatografía de fluidos supercríticos
La cromatografía de fluidos supercríticos es una técnica de separación en la que la fase móvil es un fluido por encima y relativamente cerca de su temperatura y presión críticas.
Técnicas por mecanismo de separación
Cromatografía de intercambio de iones
La cromatografía de intercambio iónico (generalmente denominada cromatografía iónica) utiliza un mecanismo de intercambio iónico para separar los analitos en función de sus respectivas cargas. Suele realizarse en columnas, pero también puede resultar útil en modo plano. La cromatografía de intercambio iónico utiliza una fase estacionaria cargada para separar los compuestos cargados, incluidos aniones , cationes , aminoácidos , péptidos y proteínas . En los métodos convencionales, la fase estacionaria es una resina de intercambio iónico que lleva grupos funcionales cargados que interactúan con grupos cargados opuestamente del compuesto a retener. Hay dos tipos de cromatografía de intercambio iónico: intercambio catiónico e intercambio aniónico. En la cromatografía de intercambio catiónico la fase estacionaria tiene carga negativa y el ion intercambiable es un catión, mientras que en la cromatografía de intercambio aniónico la fase estacionaria tiene carga positiva y el ion intercambiable es un anión. La cromatografía de intercambio iónico se usa comúnmente para purificar proteínas usando FPLC .
Cromatografía de exclusión por tamaño
La cromatografía de exclusión por tamaño (SEC) también se conoce como cromatografía de permeación en gel (GPC) o cromatografía de filtración en gel y separa las moléculas según su tamaño (o más exactamente según su diámetro hidrodinámico o volumen hidrodinámico). Las moléculas más pequeñas pueden ingresar a los poros del medio y, por lo tanto, las moléculas quedan atrapadas y eliminadas del flujo de la fase móvil. El tiempo medio de residencia en los poros depende del tamaño efectivo de las moléculas de analito. Sin embargo, se excluyen las moléculas que son más grandes que el tamaño medio de los poros del relleno y, por tanto, no sufren esencialmente retención; estas especies son las primeras en ser eluidas. Por lo general, es una técnica de cromatografía de baja resolución y, por lo tanto, a menudo se reserva para el paso final de "pulido" de una purificación. También es útil para determinar la estructura terciaria y la estructura cuaternaria de proteínas purificadas, especialmente porque se puede llevar a cabo en condiciones de solución nativa.
Separación cromatográfica de adsorción en lecho expandido
Una columna de adsorción cromatográfica de lecho expandido (EBA) para un proceso de separación bioquímica comprende un distribuidor de líquido de compensación de presión que tiene una función de autolimpieza debajo de una placa de tamiz de bloqueo poroso en la parte inferior del lecho expandido, un conjunto de boquilla de la parte superior que tiene una función de limpieza por retrolavado en la parte superior del lecho expandido, una mejor distribución del licor de la materia prima añadida al lecho expandido asegura que el fluido que pasa a través de la capa del lecho expandido muestre un estado de flujo de pistón. La capa de lecho expandido muestra un estado de flujo de pistón. La columna de separación cromatográfica de lecho expandido tiene la ventaja de incrementar la eficiencia de separación del lecho expandido.
La cromatografía de adsorción en lecho expandido (EBA) es una técnica conveniente y eficaz para la captura de proteínas directamente de una muestra cruda no clarificada. En la cromatografía EBA, el lecho sedimentado se expande primero mediante un flujo ascendente de tampón de equilibrio. El alimento crudo, una mezcla de proteínas solubles, contaminantes, células y restos celulares, se pasa luego hacia arriba a través del lecho expandido. Las proteínas objetivo se capturan en el adsorbente, mientras que las partículas y los contaminantes pasan. Un cambio en el tampón de elución mientras se mantiene el flujo ascendente da como resultado la desorción de la proteína objetivo en el modo de lecho expandido. Alternativamente, si se invierte el flujo, las partículas adsorbidas se asentarán rápidamente y las proteínas pueden ser desorbidas por un tampón de elución. El modo utilizado para la elución (lecho expandido frente a lecho sedimentado) depende de las características de la alimentación. Después de la elución, el adsorbente se limpia con una solución de limpieza en el lugar (CIP) predefinida, con limpieza seguida de regeneración de la columna (para uso posterior) o almacenamiento.
Tecnicas especiales
Cromatografía de fase inversa
La cromatografía de fase inversa (RPC) es cualquier procedimiento de cromatografía líquida en el que la fase móvil es significativamente más polar que la fase estacionaria. Se llama así porque en la cromatografía líquida de fase normal, la fase móvil es significativamente menos polar que la fase estacionaria. Las moléculas hidrófobas en la fase móvil tienden a adsorberse en la fase estacionaria relativamente hidrófoba. Las moléculas hidrófilas en la fase móvil tenderán a eluir primero. Las columnas de separación comprenden típicamente una cadena de carbono C8 o C18 unida a un sustrato de partículas de sílice.
Cromatografía de interacción hidrofóbica
La cromatografía de interacción hidrofóbica (HIC) es una técnica analítica y de purificación que separa analitos, como las proteínas, basándose en interacciones hidrofóbicas entre ese analito y la matriz cromatográfica. Puede proporcionar un enfoque ortogonal no desnaturalizante para la separación de fases reversa, preservando las estructuras nativas y la actividad potencialmente proteica. En la cromatografía de interacción hidrófoba, el material de la matriz está ligeramente sustituido con grupos hidrófobos. Estos grupos pueden variar entre grupos metilo, etilo, propilo, butilo, octilo o fenilo. A altas concentraciones de sal, las cadenas laterales no polares de la superficie de las proteínas "interactúan" con los grupos hidrófobos; es decir, ambos tipos de grupos quedan excluidos por el disolvente polar (los efectos hidrófobos aumentan con el aumento de la fuerza iónica). Por lo tanto, la muestra se aplica a la columna en un tampón que es altamente polar, lo que impulsa una asociación de parches hidrófobos en el analito con la fase estacionaria. El eluyente es típicamente un tampón acuoso con concentraciones de sal decrecientes, concentraciones crecientes de detergente (que altera las interacciones hidrófobas) o cambios en el pH. Es de importancia crítica el tipo de sal utilizada, con más sales kosmotrópicas como las definidas por la serie Hofmeister que proporcionan la mayor estructura de agua alrededor de la molécula y la presión hidrófoba resultante. El sulfato de amonio se usa con frecuencia para este propósito. La adición de disolventes orgánicos u otros constituyentes menos polares puede ayudar a mejorar la resolución.
En general, la cromatografía de interacción hidrofóbica (HIC) es ventajosa si la muestra es sensible al cambio de pH o a los disolventes agresivos que se utilizan normalmente en otros tipos de cromatografía, pero no a altas concentraciones de sal. Comúnmente, es la cantidad de sal en el tampón la que varía. En 2012, Müller y Franzreb describieron los efectos de la temperatura en el HIC utilizando albúmina de suero bovino (BSA) con cuatro tipos diferentes de resina hidrófoba. El estudio alteró la temperatura para afectar la afinidad de unión de BSA a la matriz. Se concluyó que la temperatura cíclica de 50 a 10 grados no sería adecuada para lavar eficazmente todo el BSA de la matriz, pero podría ser muy eficaz si la columna solo se usara unas pocas veces. El uso de la temperatura para efectuar cambios permite a los laboratorios reducir los costos de compra de sal y ahorrar dinero.
Si desea evitar altas concentraciones de sal junto con fluctuaciones de temperatura, puede usar un más hidrófobo para competir con su muestra para eluirla. [fuente] Este método de HIC denominado independiente de la sal mostró un aislamiento directo de la inmunoglobulina humana G (IgG) del suero con un rendimiento satisfactorio y utilizó Beta-ciclodextrina como competidor para desplazar la IgG de la matriz. Esto abre en gran medida la posibilidad de utilizar HIC con muestras que son sensibles a la sal, ya que sabemos que las altas concentraciones de sal precipitan las proteínas.
Cromatografía hidrodinámica
La cromatografía hidrodinámica (HDC) se deriva del fenómeno observado de que las gotas grandes se mueven más rápido que las pequeñas. En una columna, esto sucede porque se evita que el centro de masa de las gotas más grandes esté tan cerca de los lados de la columna como las gotas más pequeñas debido a su mayor tamaño total. Las gotas más grandes eluirán primero desde el centro de la columna, mientras que las gotas más pequeñas se adherirán a los lados de la columna y eluirán al final. Esta forma de cromatografía es útil para separar analitos por masa molar , tamaño, forma y estructura cuando se usa junto con detectores de dispersión de luz , viscosímetros y refractómetros . Los dos tipos principales de HDC son tubo abierto y columna empaquetada . El tubo abierto ofrece tiempos de separación rápidos para partículas pequeñas, mientras que el HDC de columna empaquetada puede aumentar la resolución y es más adecuado para partículas con una masa molecular promedio mayor que los daltons . La HDC se diferencia de otros tipos de cromatografía porque la separación solo tiene lugar en el volumen intersticial, que es el volumen que rodea y entre las partículas de una columna empaquetada.
La HDC comparte el mismo orden de elución que la cromatografía de exclusión por tamaño (SEC), pero los dos procesos aún varían de muchas maneras. En un estudio que compara los dos tipos de separación, Isenberg, Brewer, Côté y Striegel utilizan ambos métodos para la caracterización de polisacáridos y concluyen que el HDC junto con la dispersión de luz multiangular (MALS) logra una distribución de masa molar más precisa en comparación con MALS fuera de línea que SEC en mucho menos tiempo. Esto se debe en gran parte a que la SEC es una técnica más destructiva debido a que los poros de la columna degradan el analito durante la separación, lo que tiende a afectar la distribución de masa. Sin embargo, la principal desventaja de HDC es la baja resolución de los picos de analitos, lo que hace que SEC sea una opción más viable cuando se usa con productos químicos que no son fácilmente degradables y donde la elución rápida no es importante.
HDC juega un papel especialmente importante en el campo de la microfluídica . El primer aparato exitoso para el sistema HDC-on-a-chip fue propuesto por Chmela, et al. en 2002. Su diseño fue capaz de lograr separaciones utilizando un canal de 80 mm de largo en una escala de tiempo de 3 minutos para partículas con diámetros que van de 26 a 110 nm, pero los autores expresaron la necesidad de mejorar los parámetros de retención y dispersión . En una publicación de 2010 de Jellema, Markesteijn, Westerweel y Verpoorte, la implementación de HDC con un flujo bidireccional recirculante resultó en una separación basada en el tamaño de alta resolución con solo un canal de 3 mm de largo. Tener un canal tan corto y una resolución tan alta se consideró especialmente impresionante teniendo en cuenta que en estudios anteriores se utilizaron canales de 80 mm de longitud. Para una aplicación biológica, en 2007, Huh, et al. propuso un dispositivo de clasificación de microfluidos basado en HDC y gravedad, que fue útil para evitar que partículas potencialmente peligrosas con un diámetro mayor a 6 micrones ingresen al torrente sanguíneo al inyectar agentes de contraste en ultrasonidos . Este estudio también logró avances para la sostenibilidad ambiental en microfluidos debido a la falta de componentes electrónicos externos que impulsen el flujo, lo que resultó ser una ventaja de usar un dispositivo basado en la gravedad.
Cromatografía bidimensional
En algunos casos, la selectividad proporcionada por el uso de una columna puede ser insuficiente para proporcionar resolución de analitos en muestras complejas. La cromatografía bidimensional tiene como objetivo aumentar la resolución de estos picos mediante el uso de una segunda columna con diferentes propiedades físico-químicas ( clasificación química ). Dado que el mecanismo de retención sobre este nuevo soporte sólido es diferente al de la primera separación dimensional, puede ser posible separar compuestos mediante cromatografía bidimensional que son indistinguibles mediante cromatografía unidimensional. Además, la separación en la segunda dimensión ocurre más rápidamente que en la primera dimensión. Un ejemplo de una separación por TLC bidimensional es cuando la muestra se coloca en una esquina de una placa cuadrada, se revela, se seca al aire, luego se gira 90 ° y generalmente se vuelve a revelar en un segundo sistema de solvente. La cromatografía bidimensional se puede aplicar a separaciones por GC o LC. Este método de separación también se puede utilizar en un enfoque desgarrador, donde las regiones específicas de interés en la primera dimensión se seleccionan para la separación por la segunda dimensión, o en un enfoque integral, donde todos los analitos de la primera dimensión se someten a la segunda dimensión. separación.
Cromatografía de lecho móvil simulado
La técnica de lecho móvil simulado (SMB) es una variante de la cromatografía líquida de alta resolución; se utiliza para separar partículas y / o compuestos químicos que serían difíciles o imposibles de resolver de otro modo. Esta mayor separación se produce mediante una disposición de válvula y columna que se utiliza para alargar la fase estacionaria indefinidamente. En la técnica de lecho móvil de la cromatografía preparativa, la entrada de alimentación y la recuperación del analito son simultáneas y continuas, pero debido a dificultades prácticas con un lecho en movimiento continuo, se propuso la técnica de lecho móvil simulado. En la técnica de lecho móvil simulado, en lugar de mover el lecho, las posiciones de entrada de la muestra y salida del analito se mueven continuamente, dando la impresión de un lecho en movimiento. La verdadera cromatografía de lecho móvil (TMBC) es solo un concepto teórico. Su simulación, SMBC se logra mediante el uso de una multiplicidad de columnas en serie y una compleja disposición de válvulas, que proporciona alimentación de muestra y solvente, y también toma de analitos y desechos en ubicaciones apropiadas de cualquier columna, por lo que permite cambiar a intervalos regulares. la entrada de la muestra en una dirección, la entrada del disolvente en la dirección opuesta, mientras que también se cambian las posiciones de toma de analitos y desechos de manera apropiada.
Cromatografía de gases de pirólisis
La pirólisis-cromatografía de gases-espectrometría de masas es un método de análisis químico en el que la muestra se calienta hasta su descomposición para producir moléculas más pequeñas que se separan mediante cromatografía de gases y se detectan mediante espectrometría de masas.
La pirólisis es la descomposición térmica de materiales en una atmósfera inerte o al vacío. La muestra se pone en contacto directo con un alambre de platino o se coloca en un tubo de muestra de cuarzo y se calienta rápidamente a 600–1000 ° C. Dependiendo de la aplicación, se utilizan temperaturas incluso más altas. En los pirolizadores reales se utilizan tres técnicas de calentamiento diferentes: horno isotérmico, calentamiento inductivo (filamento Curie Point) y calentamiento resistivo con filamentos de platino. Las moléculas grandes se escinden en sus puntos más débiles y producen fragmentos más pequeños y volátiles. Estos fragmentos pueden separarse mediante cromatografía de gases. Los cromatogramas GC de pirólisis son típicamente complejos porque se forma una amplia gama de diferentes productos de descomposición. Los datos se pueden utilizar como huellas dactilares para probar la identidad del material o los datos de GC / MS se utilizan para identificar fragmentos individuales para obtener información estructural. Para aumentar la volatilidad de los fragmentos polares, se pueden agregar varios reactivos de metilación a una muestra antes de la pirólisis.
Además del uso de pirolizadores dedicados, la pirólisis GC de muestras sólidas y líquidas se puede realizar directamente dentro de los inyectores de vaporizador de temperatura programable (PTV) que proporcionan un calentamiento rápido (hasta 30 ° C / s) y altas temperaturas máximas de 600–650 ° C. Esto es suficiente para algunas aplicaciones de pirólisis. La principal ventaja es que no es necesario adquirir ningún instrumento específico y la pirólisis se puede realizar como parte del análisis de GC de rutina. En este caso, se deben utilizar revestimientos de inyectores GC de cuarzo. Se pueden adquirir datos cuantitativos y también se publican buenos resultados de derivatización dentro del inyector PTV.
Cromatografía líquida de proteínas rápida
La cromatografía líquida de proteínas rápida (FPLC) es una forma de cromatografía líquida que se utiliza a menudo para analizar o purificar mezclas de proteínas. Como en otras formas de cromatografía, la separación es posible porque los diferentes componentes de una mezcla tienen diferentes afinidades por dos materiales, un fluido en movimiento (la "fase móvil") y un sólido poroso (la fase estacionaria). En FPLC, la fase móvil es una solución acuosa o "tampón". El caudal del búfer se controla mediante una bomba de desplazamiento positivo y normalmente se mantiene constante, mientras que la composición del búfer se puede variar extrayendo fluidos en diferentes proporciones de dos o más depósitos externos. La fase estacionaria es una resina compuesta de perlas, generalmente de agarosa reticulada, empaquetadas en una columna cilíndrica de vidrio o plástico. Las resinas FPLC están disponibles en una amplia gama de tamaños de perlas y ligandos de superficie, según la aplicación.
Cromatografía en contracorriente
La cromatografía en contracorriente (CCC) es un tipo de cromatografía líquido-líquido, donde tanto la fase estacionaria como la móvil son líquidas y la fase estacionaria líquida se mantiene estancada por una fuerte fuerza centrífuga.
Cromatografía hidrodinámica en contracorriente (CCC)
El principio de funcionamiento del instrumento CCC requiere una columna que consta de un tubo abierto enrollado alrededor de una bobina. La bobina gira en un movimiento giratorio de doble eje (cardioide), lo que hace que un campo de gravedad variable (G) actúe sobre la columna durante cada rotación. Este movimiento hace que la columna vea un paso de reparto por revolución y los componentes de la muestra se separen en la columna debido a su coeficiente de reparto entre las dos fases líquidas inmiscibles utilizadas. Hay muchos tipos de CCC disponibles en la actualidad. Estos incluyen HSCCC (CCC de alta velocidad) y HPCCC (CCC de alto rendimiento). HPCCC es la versión más reciente y de mejor rendimiento de la instrumentación disponible actualmente.
Cromatografía hidrostática en contracorriente o cromatografía de partición centrífuga (CPC)
En el instrumento CPC, la columna consta de una serie de celdas interconectadas por conductos unidos a un rotor. Este rotor gira sobre su eje central creando el campo centrífugo necesario para mantener la fase estacionaria en su lugar. El proceso de separación en CPC se rige únicamente por la partición de solutos entre las fases estacionaria y móvil, cuyo mecanismo se puede describir fácilmente utilizando los coeficientes de partición ( K D ) de los solutos. Los instrumentos CPC están disponibles comercialmente para separaciones a escala industrial, piloto y de laboratorio con diferentes tamaños de columnas que van desde unos 10 mililitros hasta 10 litros de volumen.
Cromatografía periódica a contracorriente
A diferencia de la cromatografía en contracorriente (ver más arriba), la cromatografía en contracorriente periódica (PCC) utiliza una fase estacionaria sólida y solo una fase móvil líquida. Por tanto, es mucho más similar a la cromatografía de afinidad convencional que a la cromatografía contracorriente. PCC utiliza múltiples columnas, que durante la fase de carga se conectan en línea. Este modo permite sobrecargar la primera columna de esta serie sin perder producto, que ya atraviesa la columna antes de que la resina esté completamente saturada. El producto innovador se captura en las columnas siguientes. En un paso siguiente, las columnas se desconectan entre sí. La primera columna se lava y se eluye, mientras que la (s) otra (s) columna (s) todavía se están cargando. Una vez que se reequilibra la primera columna (inicialmente), se vuelve a introducir en el flujo de carga, pero como última columna. A continuación, el proceso continúa de forma cíclica.
Cromatografía quiral
La cromatografía quiral implica la separación de estereoisómeros. En el caso de los enantiómeros, estos no tienen diferencias químicas o físicas aparte de ser imágenes especulares tridimensionales. La cromatografía convencional u otros procesos de separación son incapaces de separarlos. Para permitir que tengan lugar las separaciones quirales, la fase móvil o la fase estacionaria deben hacerse quirales, dando diferentes afinidades entre los analitos. Las columnas de HPLC de cromatografía quiral (con una fase estacionaria quiral) tanto en fase normal como en fase inversa están disponibles comercialmente.
Cromatografía acuosa en fase normal
La cromatografía de fase normal acuosa (ANP) se caracteriza por el comportamiento de elución del modo de fase normal clásico (es decir, donde la fase móvil es significativamente menos polar que la fase estacionaria) en la que el agua es uno de los componentes del sistema disolvente de la fase móvil. Se distingue de la cromatografía líquida de interacción hidrófila (HILIC) en que el mecanismo de retención se debe a la adsorción más que a la partición.
Aplicaciones
La cromatografía se utiliza en muchos campos, incluida la industria farmacéutica , la industria de alimentos y bebidas , la industria química , la ciencia forense , el análisis ambiental y los hospitales .
Ver también
- Cromatografía de afinidad
- Cromatografía acuosa en fase normal
- Selectividad vinculante
- Análisis quiral
- Cromatoenfoque
- Cromatografía en el procesamiento de sangre
- Software de cromatografía
- Glowmatografía
- Purificación de gradiente de disolvente en contracorriente multicolumna (MCSGP)
- Ecuación de Purnell
- Ecuación de Van Deemter
- Cromatografía de afinidad débil