Reticulación de ADN - Crosslinking of DNA
En genética , el entrecruzamiento del ADN ocurre cuando varios agentes exógenos o endógenos reaccionan con dos nucleótidos del ADN , formando un enlace covalente entre ellos. Esta reticulación puede ocurrir dentro de la misma hebra (intracadena) o entre hebras opuestas de ADN bicatenario (entre hebras). Estos aductos interfieren con el metabolismo celular, como la replicación y transcripción del ADN , provocando la muerte celular . Sin embargo, estos enlaces cruzados pueden repararse mediante rutas de escisión o recombinación.
El entrecruzamiento del ADN también tiene un mérito útil en la quimioterapia y en las células cancerosas dirigidas a la apoptosis , así como en la comprensión de cómo las proteínas interactúan con el ADN.
Agentes reticulantes
Muchos agentes de reticulación caracterizados tienen dos grupos reactivos independientes dentro de la misma molécula, cada uno de los cuales es capaz de unirse con un residuo nucleotídico de ADN. Estos agentes se separan según su fuente de origen y se etiquetan como exógenos o endógenos. Los agentes reticulantes exógenos son productos químicos y compuestos, tanto naturales como sintéticos, que se derivan de exposiciones ambientales, como productos farmacéuticos y humo de cigarrillos o gases de escape de automóviles. Los agentes de reticulación endógenos son compuestos y metabolitos que se introducen a partir de rutas celulares o bioquímicas dentro de una célula u organismo.
Agentes exógenos
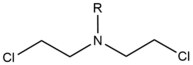
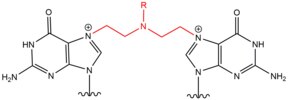
- Las mostazas nitrogenadas son agentes alquilantes exógenos que reaccionan con la posición N 7 de la guanina. Estos compuestos tienen una estructura de núcleo de bis- (2-etilcloro) amina, con un grupo R variable , con los dos grupos funcionales reactivos que sirven para alquilar nucleobases y formar una lesión de reticulación. Estos agentes forman más preferentemente una reticulación entre cadenas 1,3 5'-d (GNC). La introducción de este agente dobla ligeramente el dúplex de ADN para adaptarse a la presencia del agente dentro de la hélice. Estos agentes a menudo se introducen como productos farmacéuticos y se utilizan en quimioterapia citotóxica .
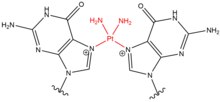
- El cisplatino (cis-diaminodicloroplatino (II)) y sus derivados actúan principalmente sobre las guaninas adyacentes en sus posiciones N 7 . El compuesto plano se une a las nucleobases mediante el desplazamiento de agua de uno o ambos de sus grupos cloruro, lo que permite que el cisplatino forme monoaductos a ADN o ARN, entrecruzamientos de ADN intracatenarios, entrecruzamientos de ADN entre cadenas y entrecruzamientos de ADN-proteína. Cuando el cisplatino genera enlaces cruzados de ADN, con mayor frecuencia forma enlaces cruzados 1,2-intracadena (5'-GG), pero también forma enlaces cruzados 1,3-intracadena (5-GNG) en porcentajes más bajos. Cuando el cisplatino forma enlaces cruzados entre cadenas (5'-GC), hay una distorsión severa en la hélice del ADN debido a una distancia acortada entre las guaninas en las hebras opuestas y una citosina que sale de la hélice como consecuencia de la interacción GG. Al igual que las mostazas de nitrógeno, el cisplatino se usa con frecuencia en el tratamiento de quimioterapia, especialmente para los cánceres de testículo y ovario.
- La cloro etil nitroso urea (CENU), específicamente la carmustina (BCNU), son agentes reticulantes que se usan ampliamente en quimioterapia, particularmente para tumores cerebrales. Estos agentes se diferencian de otros reticulantes en que alquilan el O 6 de la guanina para formar una O 6 -etanoguanina. Este compuesto intermedio conduce luego a una reticulación entre cadenas entre un par de bases GC. Estos agentes de reticulación solo dan como resultado pequeñas distorsiones en la hélice de ADN debido al tamaño más pequeño de las moléculas.
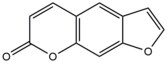
- Los psoralenos son compuestos naturales (furocumarinas) presentes en las plantas. Estos compuestos se intercalan en el ADN en los sitios de secuencia 5'-AT y forman aductos de timidina cuando se activan en presencia de rayos ultravioleta-A (UV-A) . Estos aductos covalentes se forman uniendo el borde 3, 4 ( pirona ) o 4 ', 5' ( furano ) del psoraleno al doble enlace 5, 6 de la timina . Los psoralenos pueden formar dos tipos de monoaductos y un diaducto (un entrecruzamiento entre cadenas) con timina . Estos aductos dan como resultado distorsiones locales del ADN en el sitio de intercalación. Los psoralenos se utilizan en el tratamiento médico de enfermedades de la piel, como la psoriasis y el vitiligo .
- La mitomicina C (MMC) pertenece a una clase de antibióticos que se utilizan ampliamente en la quimioterapia, a menudo con cánceres relacionados con el aparato digestivo. La mitomicina C solo puede actuar como reticulante cuando un nucleótido de ADN ha tenido una reducción en su anillo de quinona . Cuando dos dG se han reordenado y metilado de esta manera, se puede formar una reticulación entre cadenas 5'-GC con las exo aminas de cada nucleobase. La mitomicina también tiene la capacidad de formar monoaductos y enlaces cruzados intracadenas con el ADN. Los enlaces cruzados entre cadenas de mitomicina C se forman en el surco menor del ADN, lo que induce un ensanchamiento o estiramiento moderado de la hélice del ADN para adaptarse a la presencia de la molécula dentro de las dos cadenas.
Agentes endógenos
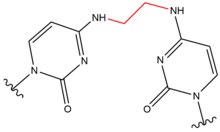
- El ácido nitroso se forma como un subproducto en el estómago a partir de fuentes dietéticas de nitritos y puede provocar lesiones entrecruzadas en el ADN a través de la conversión de grupos amino en el ADN en carbonilos. Este tipo de lesión ocurre con mayor frecuencia entre dos guanosinas, con 1 de 4 guanosinas desaminadas dando como resultado un entrecruzamiento entre cadenas. Induce la formación de enlaces cruzados de ADN entre cadenas en el aminogrupo de N 2 exocíclico de guanina en las secuencias 5'-CG. Esta lesión distorsiona levemente la doble hélice.
- Los aldehídos bifuncionales son sustancias químicas reactivas que se forman de forma endógena a través de la peroxidación de lípidos y la biosíntesis de prostoglandinas . Crean aductos de eteno formados por aldehído que experimentan reordenamientos para formar enlaces cruzados en hebras opuestas de ADN. El malondialdehído es un ejemplo prototípico que puede reticular el ADN a través de dos grupos amino de guanina exocíclicos. Otros aldehídos, como el formaldehído y el acetilaldehído , pueden introducir enlaces cruzados entre cadenas y, a menudo, actuar como agentes exógenos como se encuentran en muchos alimentos procesados. Los aldehídos α, β insaturados, como la acroleína y el crotonaldehído, que se encuentran a menudo en pesticidas, humo de tabaco y gases de escape de automóviles, son agentes exógenos adicionales que pueden inducir enlaces cruzados de ADN. A diferencia de otros agentes de reticulación, la reticulación inducida por aldehídos es un proceso intrínsecamente reversible. La estructura de RMN de estos tipos de agentes como enlaces cruzados entre cadenas muestra que un aducto 5'-GC da como resultado una distorsión menor del ADN, sin embargo, un aducto 5'-CG desestabiliza la hélice e induce una curvatura y torsión en el ADN.
- Las lesiones de entrecruzamiento del ADN también se pueden formar en condiciones de estrés oxidativo, en las que los radicales libres de oxígeno generan intermediarios reactivos en el ADN, y estas lesiones se han relacionado con el envejecimiento y el cáncer. Las lesiones de ADN en tándem se forman con una frecuencia sustancial por radiación ionizante y reacciones de H 2 O 2 catalizadas por metales . En condiciones anóxicas, la lesión de doble base predominante es una especie en la que el C8 de la guanina se une al grupo 5-metilo de una 3'-timina adyacente (G [8,5-Me] T), formando lesiones intracadenas.
Tabla resumen de agentes reticulantes
| Agente de reticulación | Agente alquilante | Estructura de reticulación | Secuencia de destino preferencial |
| Mostaza nitrogenada | Intrastrand; 5'-GC | ||
| Cisplatino | Intrastrand; 5'-GC
Interstrand; 5'-GNG |
||
| Carmustina (BNCU) | Interstand; Par de bases GC | ||
| Mitomicina C | Interstrand; 5'-GC | ||
| Psoralen | Interstand; 5'-TA | ||
| Malondialdehído | Interstrand; 5'-GC, 5'-CG | ||
| Estrés oxidativo (y radiación) | Intrastrand; d (GpT) | ||
| Ácido nitroso | Interstrand; 5'-CG |
Reparación de enlaces cruzados de ADN
El ADN reticulado se repara en las células mediante una combinación de enzimas y otros factores de la vía de reparación por escisión de nucleótidos (NER), la recombinación homóloga y la vía de reparación por escisión de bases (BER). Para reparar los enlaces cruzados entre cadenas en eucariotas, se recluta una endonucleasa de aleta 3 'del NER, XPF-ERCC1 , en el ADN entrecruzado, donde ayuda a "desenganchar" el ADN escindiendo la cadena 3' en el sitio de entrecruzamiento. Luego, la hebra 5 'se escinde, ya sea por XPF-ERCC1 u otra endonucleasa , formando una ruptura de doble hebra (DSB), que luego puede repararse mediante la ruta de recombinación homóloga .
Los enlaces cruzados de ADN generalmente provocan la pérdida de información de secuencia superpuesta de las dos cadenas de ADN. Por lo tanto, la reparación precisa del daño depende de recuperar la información perdida de un cromosoma homólogo no dañado en la misma célula. La recuperación puede ocurrir al emparejarse con una cromátida hermana producida durante una ronda anterior de replicación. En una célula diploide, la recuperación también puede ocurrir al emparejarse con un cromosoma homólogo no hermano , como ocurre especialmente durante la meiosis . Una vez que se ha producido el emparejamiento, se puede eliminar el entrecruzamiento e introducir la información correcta en el cromosoma dañado mediante recombinación homóloga.
La escisión del enlace entre un azúcar desoxirribosa en la columna vertebral de azúcar-fosfato del ADN y su nucleobase asociada deja un sitio básico en el ADN bicatenario. Estos sitios abásicos a menudo se generan como intermedios y luego se restauran en la reparación por escisión de la base. Sin embargo, si se permite que estos sitios persistan, pueden inhibir la replicación y transcripción del ADN. Los sitios abásicos pueden reaccionar con grupos amina en proteínas para formar enlaces cruzados de ADN-proteína o con aminas exocíclicas de otras nucleobases para formar enlaces cruzados entre cadenas. Para evitar entrecruzamientos entre cadenas o entre ADN y proteína, las enzimas de la vía BER se unen estrechamente al sitio abásico y lo secuestran de los grupos reactivos cercanos, como se demuestra en la alquiladenina ADN glicosilasa (AAG) humana y la 3-metiladenina ADN glicosilasa II (AlkA) de E. coli . La evidencia in vitro demostró que el Interstand Cross-Links inducido por un sitio abásico (DOB-ICL) es una lesión que bloquea la replicación y tiene una alta codificación errónea. En comparación con varios otros TLS pols examinados, es probable que pol η contribuya a la reparación mediada por TLS de la DOB-ICL in vivo . Mediante el uso de lesiones de ADN de O 6 -2'-desoxiguanosina-butileno-O 6 -2'-desoxiguanosina (O6-dG-C4-O6-dG), que es una estructura químicamente estable, se investigó la actividad de derivación de varias ADN polimerasas y los resultados demostraron que pol η exhibió la mayor actividad de derivación; sin embargo, el 70% de los productos de derivación eran mutagénicos y contenían sustituciones o deleciones. El aumento en el tamaño de los intermedios de reparación desenganchados eleva la frecuencia de mutación por deleción.
El tratamiento de E. coli con psoraleno más luz ultravioleta ( PUVA ) produce enlaces cruzados entre cadenas en el ADN de las células. Cole y col. y Sinden y Cole presentaron evidencia de que un proceso de reparación recombinacional homólogo que requiere los productos de los genes uvrA , uvrB y recA puede eliminar estos enlaces cruzados en E. coli . Este proceso parece bastante eficaz. Aunque una o dos reticulaciones no reparadas son suficientes para inactivar una célula, una célula bacteriana de tipo salvaje puede reparar y, por tanto, recuperar de 53 a 71 reticulaciones de psoraleno. Las células de levadura eucariotas también son inactivadas por una reticulación restante, pero las células de levadura de tipo salvaje pueden recuperarse de 120 a 200 reticulaciones.
Aplicaciones
Reticulación de ADN y proteínas
Métodos de interacción bioquímica
La reticulación de ADN-proteína puede ser causada por una variedad de agentes químicos y físicos, incluidos metales de transición, radiación ionizante y aldehídos endógenos, además de agentes quimioterapéuticos . De manera similar a la reticulación del ADN, las reticulaciones de ADN-proteína son lesiones en las células que con frecuencia resultan dañadas por la radiación ultravioleta. El efecto de los rayos UV puede provocar interacciones reactivas y hacer que el ADN y las proteínas que están en contacto con él se reticulen. Estos enlaces cruzados son lesiones muy voluminosas y complejas. Ocurren principalmente en áreas de los cromosomas que están experimentando la replicación del ADN e interfieren con los procesos celulares.
El avance en los métodos de identificación de estructuras ha progresado, y la adición de la capacidad de medir las interacciones entre el ADN y las proteínas es un requisito para comprender completamente los procesos bioquímicos. La estructura de los complejos de ADN-proteína puede mapearse mediante fotorreticulación , que es la formación fotoinducida de un enlace covalente entre dos macromoléculas o entre dos partes diferentes de una macromolécula. La metodología implica unir covalentemente un motivo de unión a ADN de la proteína de unión a ADN específica de la secuencia diana con un agente de reticulación fotoactivable capaz de reaccionar con nucleótidos de ADN cuando se expone a UV. Este método proporciona información sobre la interacción entre el ADN y la proteína en la reticulación.
Tratamientos clinicos
Las vías de reparación del ADN pueden resultar en la formación de células tumorales . Los tratamientos contra el cáncer se han diseñado utilizando agentes de entrecruzamiento del ADN para interactuar con las bases nitrogenadas del ADN para bloquear la replicación del ADN. Estos agentes de entrecruzamiento tienen la capacidad de actuar como terapias de agente único dirigiéndose y destruyendo nucleótidos específicos en células cancerosas. Este resultado detiene el ciclo y el crecimiento de las células cancerosas; debido a que inhibe vías específicas de reparación del ADN, este enfoque tiene la ventaja potencial de tener menos efectos secundarios.
En los seres humanos, la principal causa de muerte por cáncer en todo el mundo es el cáncer de pulmón, incluido el carcinoma de pulmón de células no pequeñas (CPCNP), que representa el 85% de todos los casos de cáncer de pulmón en los Estados Unidos. Los individuos con NSCLC a menudo se tratan con compuestos terapéuticos de platino (por ejemplo, cisplatino, carboplatino u oxaliplatino) (consulte Quimioterapia contra el cáncer de pulmón ) que causan entrecruzamiento del ADN entre cadenas. Entre las personas con NSLC, la baja expresión del gen del cáncer de mama 1 ( BRCA1 ) en el tumor primario se ha correlacionado con una mejor supervivencia después de la quimioterapia que contiene platino. Esta correlación implica que un bajo BRCA1 en el cáncer, y el consiguiente bajo nivel de reparación del ADN, provoca la vulnerabilidad del cáncer al tratamiento por los agentes de entrecruzamiento del ADN. El BRCA1 alto puede proteger a las células cancerosas al actuar en la vía de reparación recombinacional homóloga que elimina los daños en el ADN introducidos por los medicamentos de platino. El nivel de expresión de BRCA1 es potencialmente una herramienta importante para adaptar la quimioterapia en el tratamiento del cáncer de pulmón.
La quimioterapia clínica puede inducir enlaces cruzados de ADN-proteína enzimáticos y no enzimáticos. Un ejemplo de esta inducción es con derivados del platino, como cisplatino y oxaliplatino. Crean enlaces cruzados de ADN-proteína no enzimáticos a través del entrecruzamiento no específico de proteínas que interactúan con la cromatina con el ADN. La reticulación también es posible en otros agentes terapéuticos al estabilizar los intermediarios de la reacción covalente ADN-proteína o al crear un pseudosustrato, que atrapa la enzima en el ADN. Los derivados de la camptotecina, como el irinotecán y el topotecán, se dirigen y atrapan la topoisomerasa 1 de ADN específica (TOP1) intercalando dentro de la interfaz enzima-ADN. Debido a que la toxicidad de estos fármacos depende del atrapamiento de TOP1, la sensibilidad celular a estos compuestos depende directamente de los niveles de expresión de TOP1. Como resultado, la función de estos medicamentos es servir como venenos enzimáticos en lugar de inhibidores. Esto se puede aplicar para tratar células tumorales mediante el uso de venenos enzimáticos TOP 2.
Referencias
enlaces externos
- PDB : 1AIO - Estructura interactiva para la formación de aductos de cisplatino y ADN
- PDB : 204D - Estructura interactiva para psoraleno y ADN reticulado
- Psoralen Ultraviolet A Light Treatment