Factor de transcripción AP-1 - AP-1 transcription factor
| Proteínas AP-1 (Fos, ATF, JDP) | |
|---|---|
| Identificadores | |
| Símbolo | AP-1 |
| InterPro | IPR000837 |
| Factor de transcripción Jun | |
|---|---|
| Identificadores | |
| Símbolo | Leuzip_Jun |
| InterPro | IPR002112 |
La proteína activadora 1 (AP-1) es un factor de transcripción que regula la expresión génica en respuesta a una variedad de estímulos, que incluyen citocinas , factores de crecimiento , estrés e infecciones bacterianas y virales. AP-1 controla varios procesos celulares que incluyen diferenciación , proliferación y apoptosis . La estructura de AP-1 es un heterodímero compuesto por proteínas pertenecientes a las familias c-Fos , c-Jun , ATF y JDP .
Historia
AP-1 se descubrió por primera vez como un factor de transcripción activado por TPA que se unía a un elemento regulador en cis del promotor de la metalotioneína IIa humana ( hMTIIa ) y SV40 . El sitio de unión de AP-1 se identificó como el elemento de respuesta (TRE) de 12-O-tetradecanoilforbol-13-acetato ( TPA ) con la secuencia consenso 5'-TGA G / C TCA-3 '. La subunidad Jun de AP-1 se identificó como una nueva oncoproteína del virus del sarcoma aviar , y la proteína p39 asociada a Fos se identificó como la transcripción del gen Jun celular. Fos se aisló por primera vez como el homólogo celular de dos oncogenes v-fos virales, los cuales inducen osteosarcoma en ratones y ratas. Desde su descubrimiento, se ha descubierto que AP-1 está asociado con numerosos procesos reguladores y fisiológicos, y aún se investigan nuevas relaciones.
Estructura
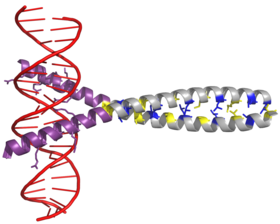
El factor de transcripción AP-1 se ensambla mediante la dimerización de un dominio bZIP característico ( cremallera de leucina de la región básica ) en las subunidades Fos y Jun . Un dominio bZIP típico consiste en una región de " cremallera de leucina " y una "región básica". La cremallera de leucina es responsable de la dimerización de las subunidades proteicas Jun y Fos . Este motivo estructural retuerce dos dominios de proteínas alfa helicoidales en una " espiral enrollada " , caracterizada por una periodicidad de 3,5 residuos por vuelta y leucinas repetitivas que aparecen en cada séptima posición de la cadena polipeptídica . Debido a la secuencia de aminoácidos y la periodicidad de las hélices, las cadenas laterales de leucina están dispuestas a lo largo de una cara de la hélice α y forman una superficie hidrófoba que modula la dimerización. Los residuos hidrófobos adicionales a la leucina también forman la repetición característica 3-4 de las hélices α involucradas en las interacciones "en espiral", y ayudan a contribuir al empaquetamiento hidrófobo que impulsa la dimerización. Juntos, esta superficie hidrófoba mantiene unidas las dos subunidades.
La región básica del dominio bZIP está justo corriente arriba de la cremallera de leucina y contiene residuos cargados positivamente. Esta región interactúa con los sitios de destino del ADN . Aparte de la "cremallera de leucina" y la "región básica" que son importantes para la dimerización y la unión al ADN, la proteína c-jun contiene tres regiones cortas, que consisten en grupos de aminoácidos cargados negativamente en su mitad N-terminal que son importante para la activación transcripcional in vivo.
La dimerización ocurre entre los productos de los protooncogenes c-jun y c-fos , y es necesaria para la unión al ADN. Las proteínas Jun pueden formar tanto homo como heterodímeros y, por lo tanto, son capaces de unirse al ADN por sí mismas. Sin embargo, las proteínas Fos no se dimerizan entre sí y, por lo tanto, solo pueden unirse al ADN cuando se unen con Jun. El heterodímero Jun-Fos es más estable y tiene una mayor actividad de unión al ADN que los homodímeros de Jun.
Función
Se ha demostrado que el factor de transcripción AP-1 interviene en una amplia gama de procesos celulares, incluido el crecimiento celular , la diferenciación y la apoptosis . La actividad de AP-1 a menudo se regula mediante modificaciones postraduccionales , composición de dímeros de unión al ADN e interacción con varios socios de unión. Los factores de transcripción AP-1 también están asociados con numerosas funciones fisiológicas, especialmente en la determinación de la vida útil de los organismos y la regeneración de tejidos . A continuación se muestran algunas de las otras funciones importantes y roles biológicos en los que se ha demostrado que los factores de transcripción AP-1 están involucrados.
Crecimiento, proliferación y senescencia celular
Se ha demostrado que el factor de transcripción AP-1 desempeña numerosas funciones en el crecimiento y la proliferación celular. En particular, c-Fos y c-Jun parecen ser actores importantes en estos procesos. Se ha demostrado que C-jun es esencial para la proliferación de fibroblastos , y se ha demostrado que los niveles de ambas subunidades AP-1 se expresan por encima de los niveles basales durante la división celular . También se ha demostrado que C-fos aumenta la expresión en respuesta a la introducción de factores de crecimiento en la célula, lo que respalda aún más su implicación sugerida en el ciclo celular. Se ha demostrado que los factores de crecimiento TGF alfa , TGF beta e IL2 estimulan el c-Fos y, por lo tanto, estimulan la proliferación celular mediante la activación de AP-1.
La senescencia celular se ha identificado como "un proceso dinámico y reversible regulado por la (in) activación de un paisaje potenciador predeterminado controlado por el factor de transcripción pionero AP-1", que "define los principios organizativos de la red de factores de transcripción que impulsa el programa transcripcional de células senescentes ".
Diferenciación celular
La transcripción de AP-1 está profundamente involucrada en la modulación de la expresión génica . Los cambios en la expresión génica celular en el inicio de la síntesis de ADN y la formación de derivados diferenciados pueden conducir a la diferenciación celular . Se ha demostrado que AP-1 participa en la diferenciación celular en varios sistemas. Por ejemplo, al formar heterodímeros estables con c-Jun, la región bZIP de c-Fos aumenta la unión de c-Jun a genes diana cuya activación está implicada en la diferenciación de fibroblastos de embriones de pollo (CEF).
Apoptosis
El factor de transcripción AP-1 está asociado con una amplia gama de interacciones relacionadas con la apoptosis . La actividad de AP-1 es inducida por numerosos agentes genotóxicos y de matriz extracelular , lo que sugiere una participación en la muerte celular programada . Muchos de estos estímulos activan las quinasas N-terminales de c-Jun (JNK) que conducen a la fosforilación de las proteínas Jun y a una mayor actividad transcripcional de los genes dependientes de AP-1. Se han informado aumentos en los niveles de las proteínas Jun y Fos y la actividad de JNK en escenarios en los que las células experimentan apoptosis. Por ejemplo, las células c-Jun-ER inactivadas muestran una morfología normal, mientras que se ha demostrado que las células activadas con c-Jun-ER son apoptóticas.
Regulación de AP-1
El aumento de los niveles de AP-1 conduce a una mayor transactivación de la expresión del gen diana. Por lo tanto, la regulación de la actividad de AP-1 es fundamental para la función celular y se produce a través de interacciones específicas controladas por la composición de dímeros, eventos transcripcionales y postraduccionales e interacción con proteínas accesorias.
Las funciones de AP-1 dependen en gran medida de las subunidades específicas de Fos y Jun que contribuyen a los dímeros AP-1. El resultado de la activación de AP-1 depende de los patrones combinatorios complejos de los dímeros del componente AP-1. El complejo AP-1 se une a un motivo de ADN palindrómico (5'-TGA G / C TCA-3 ') para regular la expresión génica, pero la especificidad depende de la composición dímera de la subunidad bZIP.
Relevancia fisiológica
Se ha demostrado que el factor de transcripción AP-1 está involucrado en la fisiología de la piel, específicamente en la regeneración de tejidos . El proceso del metabolismo de la piel se inicia mediante señales que provocan que las células proliferativas indiferenciadas se sometan a diferenciación celular. Por lo tanto, la actividad de las subunidades AP-1 en respuesta a señales extracelulares puede modificarse en condiciones en las que el equilibrio de la proliferación y diferenciación de queratinocitos debe modificarse rápida y temporalmente. También se ha demostrado que el factor de transcripción AP-1 está involucrado en el crecimiento de las células del cáncer de mama a través de múltiples mecanismos, incluida la regulación de la ciclina D1 , los factores E2F y sus genes diana. c-Jun, que es una de las subunidades AP-1, regula el crecimiento de las células del cáncer de mama. El c-Jun activado se expresa predominantemente en el frente invasivo en el cáncer de mama y está asociado con la proliferación de células de mama. Debido a las funciones reguladoras de AP-1 en las células cancerosas, la modulación de AP-1 se estudia como una estrategia potencial para la prevención y la terapia del cáncer.