Cultivo celular 3D - 3D cell culture
Un cultivo celular en 3D es un entorno creado artificialmente en el que se permite que las células biológicas crezcan o interactúen con su entorno en las tres dimensiones. A diferencia de los entornos 2D (por ejemplo, una placa de Petri ), un cultivo celular en 3D permite que las células in vitro crezcan en todas las direcciones, de forma similar a como lo harían in vivo . Estos cultivos tridimensionales generalmente se cultivan en biorreactores, pequeñas cápsulas en las que las células pueden convertirse en esferoides o colonias de células en 3D. Por lo general, se cultivan aproximadamente 300 esferoides por biorreactor.
Fondo
Los cultivos de células 3D se han utilizado en la investigación durante varias décadas. Uno de los primeros enfoques registrados para su desarrollo fue a principios del siglo XX, con los esfuerzos de Alexis Carrel para desarrollar métodos para cultivos prolongados de tejidos in vitro. Los primeros estudios en los años 80, dirigidos por Mina Bissell del Laboratorio Nacional Lawrence Berkeley , destacaron la importancia de las técnicas 3D para crear modelos de cultivo in vitro precisos. Este trabajo se centró en la importancia de la matriz extracelular y la capacidad de los cultivos en matrices 3D artificiales para producir estructuras multicelulares fisiológicamente relevantes, como estructuras acinares en modelos de tejido mamario sanos y cancerosos. Estas técnicas se han aplicado a modelos de enfermedades in vitro utilizados para evaluar respuestas celulares a compuestos farmacéuticos.
Eric Simon, en un informe de subvención del NIH SBIR de 1988, mostró que el electrohilado podría usarse para producir esteras fibrosas de poliestireno y policarbonato a escala nano y submicrónica (ahora conocidas como andamios) específicamente diseñadas para su uso como sustratos de células in vitro. Este uso temprano de celosías fibrosas electrohiladas para cultivo celular e ingeniería de tejidos mostró que varios tipos de células, incluidos los fibroblastos del prepucio humano (HFF), el carcinoma humano transformado (HEp-2) y el epitelio pulmonar de visón (MLE) se adherirían y proliferarían sobre las fibras. . Se observó que, a diferencia de la morfología aplanada que se ve típicamente en el cultivo 2D, las células cultivadas en las fibras electrohiladas exhibieron una morfología tridimensional redondeada más histotípica que generalmente se observa in vivo.
Propiedades
En los tejidos vivos, las células existen en microambientes 3D con intrincadas interacciones célula-célula y célula-matriz y una compleja dinámica de transporte de nutrientes y células. Los cultivos celulares estándar 2D, o monocapa, son representaciones inadecuadas de este entorno, lo que a menudo los convierte en predictores poco fiables de la eficacia y toxicidad de los fármacos in vivo . Los esferoides 3D se parecen más al tejido in vivo en términos de comunicación celular y desarrollo de matrices extracelulares . Estas matrices ayudan a las células a moverse dentro de su esferoide de manera similar a como se mueven las células en el tejido vivo. Por tanto, los esferoides son modelos mejorados para la migración , diferenciación , supervivencia y crecimiento celular . Además, los cultivos de células en 3D proporcionan una descripción más precisa de la polarización celular, ya que en 2D, las células solo se pueden polarizar parcialmente. Además, las células cultivadas en 3D exhiben una expresión génica diferente a las que se cultivan en 2D.
La tercera dimensión del crecimiento celular proporciona más espacio de contacto para las entradas mecánicas y para la adhesión celular , que es necesaria para la ligadura de integrinas , la contracción celular e incluso la señalización intracelular. La difusión normal de solutos y la unión a proteínas efectoras (como factores de crecimiento y enzimas ) también dependen de la matriz celular 3D, por lo que es fundamental para el establecimiento de gradientes de concentración de solutos a escala tisular.
A los efectos del cribado de toxicología de fármacos , es mucho más útil probar la expresión génica de células in vitro cultivadas en 3D que en 2D, ya que la expresión génica de los esferoides 3D se asemejará más a la expresión génica in vivo. Por último, los cultivos celulares en 3D tienen una mayor estabilidad y una vida útil más prolongada que los cultivos celulares en 2D. Esto significa que son más adecuados para estudios a largo plazo y para demostrar los efectos a largo plazo del fármaco. Los entornos 3D también permiten que las células crezcan sin ser molestadas. En 2D, las células deben someterse a tripsinización regular para proporcionarles suficientes nutrientes para el crecimiento celular normal. Los esferoides 3D se han cultivado en un laboratorio durante hasta 302 días sin dejar de mantener un crecimiento saludable y no canceroso.
Clasificación de métodos de cultivo 3D
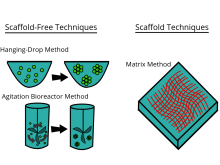
Existe una gran cantidad de herramientas de cultivo disponibles comercialmente que afirman proporcionar las ventajas del cultivo celular en 3D. En general, las plataformas se pueden clasificar en dos tipos de métodos de cultivo 3D: técnicas de andamio y técnicas sin andamio .
Técnicas de andamios
Las técnicas de andamios incluyen el uso de andamios sólidos, hidrogeles y otros materiales. En un estudio reciente, se exploró la potencialidad de las células madre CD34 + humanas mediante la generación de un modelo 3D de gel de agarosa in vitro para comprender el proceso de osificación ósea.
Hidrogeles
Como la matriz extracelular natural (MEC) es importante en la supervivencia, proliferación, diferenciación y migración de las células, las diferentes matrices de hidrogel que imitan la estructura natural de la MEC se consideran enfoques potenciales para el cultivo celular in vivo. Los hidrogeles están compuestos por poros interconectados con alta retención de agua, lo que permite un transporte eficiente de, por ejemplo, nutrientes y gases. Se encuentran disponibles varios tipos diferentes de hidrogeles de materiales naturales y sintéticos para el cultivo de células 3D, incluidos, por ejemplo, hidrogeles de extracto de ECM animal, hidrogeles de proteína, hidrogeles de péptidos, hidrogeles de polímero e hidrogel de nanocelulosa a base de madera .
Técnicas sin andamios
Las técnicas sin andamios emplean otro enfoque independiente del uso de andamios. Los métodos sin andamios incluyen, por ejemplo, el uso de placas de baja adhesión, placas colgantes, superficies con micropatrones y biorreactores giratorios , levitación magnética y bioimpresión magnética en 3D .
Esferoides
Los esferoides son un tipo de modelado celular tridimensional que simula mejor las condiciones ambientales de una célula viva en comparación con un modelo celular bidimensional, específicamente con las reacciones entre las células y las reacciones entre las células y la matriz. Los esferoides son útiles en el estudio de las características fisiológicas cambiantes de las células, la diferencia en la estructura de las células sanas y las células tumorales, y los cambios que experimentan las células cuando forman un tumor. Se utilizaron esferoides cocultivados con células tumorales y sanas para simular cómo las células cancerosas interactúan con las células normales. Los esferoides se pueden cultivar con algunos métodos diferentes. Un método común es usar placas de baja adhesión celular, típicamente una placa de 96 pocillos, para producir cultivos de esferoides en masa, donde los agregados se forman en el fondo redondeado de las placas de células. Los esferoides también se pueden cultivar utilizando el método de gota colgante que implica formar agregados celulares en gotas que cuelgan de la superficie de una placa celular. Otros métodos en investigación incluyen el uso de biorreactores de vasos de pared giratoria, que hacen girar y cultivan las células cuando están constantemente en caída libre y forman agregados en capas. Recientemente, se han estandarizado algunos protocolos para producir esferoides uniformes y confiables. Los investigadores también habían explorado métodos estandarizados, económicos y reproducibles para el cultivo celular en 3D.
Biorreactores
Los biorreactores utilizados para cultivos de células en 3D son pequeñas cámaras cilíndricas de plástico que están diseñadas específicamente con el propósito de hacer crecer células en tres dimensiones. El biorreactor utiliza materiales sintéticos bioactivos como membranas de tereftalato de polietileno para rodear las células esferoides en un entorno que mantiene altos niveles de nutrientes. Son fáciles de abrir y cerrar, por lo que los esferoides celulares se pueden extraer para realizar pruebas, pero la cámara puede mantener el 100% de humedad en todo momento. Esta humedad es importante para lograr el máximo crecimiento y función celular. La cámara del biorreactor es parte de un dispositivo más grande que gira para asegurar un crecimiento celular igual en cada dirección en tres dimensiones.
MC2 Biotek ha desarrollado un biorreactor para incubar proto-tejido que utiliza el intercambio de gases para mantener altos niveles de oxígeno dentro de la cámara celular. Esta es una mejora con respecto a los biorreactores anteriores porque los niveles más altos de oxígeno ayudan a que la célula crezca y experimente una respiración celular normal.
Microfluidos
Las diversas estructuras celulares del cuerpo humano deben estar vascularizadas para recibir los nutrientes y la ayuda de intercambio de gases que necesitan para sobrevivir. De manera similar, los cultivos de células 3D in vitro requieren ciertos niveles de circulación de fluidos, lo que puede ser problemático para cultivos densos en 3D donde es posible que no todas las células tengan una exposición adecuada a los nutrientes. Esto es particularmente importante en los cultivos de hepatocitos porque el hígado es un órgano muy vascularizado. Un estudio cultivó hepatocitos y células vasculares en un andamio de gel de colágeno entre canales de microfluidos , comparó el crecimiento de células en entornos estáticos y fluidos, y mostró la necesidad de modelos con tejidos y una red microvascular.
Proyección de alto impacto
El desarrollo avanzado de modelos 3D para el cribado de alto rendimiento en formatos de alta densidad se ha logrado recientemente debido a los logros tecnológicos relacionados con el aumento de la densidad de microplacas . Estos se pueden encontrar en formatos de 384 y 1536 pocillos que son repelentes de células, rentables y aptos para plataformas de detección totalmente automatizadas. Dos opciones que permiten formatos de 1536 pozos están disponibles en Greiner Bio-One usando la bioimpresión 3D magnética m3D y Corning Life Sciences que incorpora un recubrimiento de superficie de fijación ultrabaja, junto con una geometría de microcavidad y gravedad para crear modelos 3D. Debido a los métodos y tecnologías rápidos y asequibles que se han desarrollado para el cribado en 3D, se han habilitado enfoques de cribado paralelos de alto rendimiento para probar pares isogénicos de mutantes relacionados con oncogén frente al tipo salvaje.
Farmacología y toxicología
Un propósito principal del cultivo de células en andamios 3D y como esferoides de células 3D in vitro es probar los efectos farmacocinéticos y farmacodinámicos de fármacos y nanomateriales en ensayos preclínicos. Los estudios de toxicología han demostrado que los cultivos celulares en 3D están casi a la par con los estudios in vivo con el fin de probar la toxicidad de los compuestos farmacológicos. Al comparar los valores de LD50 para 6 fármacos comunes: acetaminofén , amiodarona , diclofenaco , metformina , fenformina y ácido valproico , los valores de esferoide 3D se correlacionaron directamente con los de estudios in vivo. Aunque los cultivos de células 2D se han utilizado anteriormente para probar la toxicidad junto con los estudios in vivo, los esferoides 3D son mejores para probar la toxicidad por exposición crónica debido a su vida útil más prolongada. La matriz en los esferoides 3D hace que las células mantengan filamentos de actina y es más relevante fisiológicamente en la organización citoesquelética y la polaridad celular y la forma de las células humanas. La disposición tridimensional permite que los cultivos proporcionen un modelo que se asemeja con mayor precisión al tejido humano in vivo sin utilizar sujetos de prueba con animales.
Criticas
Los métodos 3D existentes no están exentos de limitaciones, incluida la escalabilidad, la reproducibilidad, la sensibilidad y la compatibilidad con los instrumentos de detección de alto rendimiento (HTS). El HTS basado en células se basa en la determinación rápida de la respuesta celular a la interacción farmacológica, como la viabilidad celular dependiente de la dosis, la interacción célula-célula / célula-matriz y / o la migración celular, pero los ensayos disponibles no están optimizados para el cultivo de células en 3D. Otro desafío al que se enfrenta el cultivo de células en 3D es la cantidad limitada de datos y publicaciones que abordan los mecanismos y correlaciones de la interacción de fármacos, la diferenciación celular y la señalización celular en estos entornos 3D. Ninguno de los métodos 3D ha reemplazado todavía el cultivo 2D a gran escala, incluso en el proceso de desarrollo de fármacos ; aunque el número de publicaciones sobre cultivos de células en 3D está aumentando rápidamente, la caracterización bioquímica limitada actual del tejido en 3D disminuye la adopción de nuevos métodos.
También existen problemas al usar esferoides como modelo de tejido canceroso. Aunque beneficiosos para el cultivo de tejidos en 3D, los esferoides tumorales han sido criticados por ser desafiantes o imposibles de "manipular gradientes de moléculas solubles en construcciones [esferoides 3D] y caracterizar células en estos gradientes complejos", a diferencia del cultivo de células 3D en papel para bioensayos basados en tejidos explorados por Ratmir et al. Otros desafíos asociados con las técnicas complejas de cultivo celular en 3D incluyen: obtención de imágenes debido a los grandes tamaños de andamios y la incompatibilidad con muchos microscopios de fluorescencia, citometría de flujo porque requiere la disociación de esferoides en una suspensión unicelular y la automatización de la manipulación de líquidos.
Ver también
- Cultivo de células
- Líneas celulares
- Ensayo de cultivo celular
- Hidrogel
- Línea celular Madin-Darby Canine Kidney
- Microfisiometria