Niraparib - Niraparib
 | |
| Datos clinicos | |
|---|---|
| Pronunciación |
/ N ɪ r æ p ə r ɪ b / NIH- RAP -Uh-costilla |
| Nombres comerciales | Zejula |
| Otros nombres | MK-4827 |
| AHFS / Drugs.com | Monografía |
| MedlinePlus | a617007 |
| Datos de licencia | |
Categoría de embarazo |
|
| Vías de administración |
Oral |
| Código ATC | |
| Estatus legal | |
| Estatus legal | |
| Datos farmacocinéticos | |
| Biodisponibilidad | 73% |
| Enlace proteico | 83% |
| Metabolismo | Carboxilesterasas |
| Metabolitos | M1 ( ácido carboxílico ) |
| Vida media de eliminación | 36 horas |
| Excreción | 48% orina, 29% heces |
| Identificadores | |
| |
| Número CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CHEBI | |
| CHEMBL | |
| Tablero CompTox ( EPA ) | |
| Tarjeta de información ECHA |
100.210.548 |
| Datos químicos y físicos | |
| Fórmula | C 19 H 20 N 4 O |
| Masa molar | 320,396 g · mol −1 |
| Modelo 3D ( JSmol ) | |
| solubilidad en agua | 0,7-1,1 |
| |
| |
Niraparib , que se vende bajo la marca Zejula , es un medicamento contra el cáncer que se usa para el tratamiento del cáncer epitelial de ovario, de trompas de Falopio o peritoneal primario. Se toma por vía oral .
Los efectos secundarios más comunes incluyen náuseas (malestar), trombocitopenia (recuentos bajos de plaquetas en sangre), cansancio y debilidad, anemia (recuentos bajos de glóbulos rojos), estreñimiento , vómitos , dolor abdominal (vientre), neutropenia (niveles bajos de neutrófilos, un tipo de glóbulo blanco), insomnio (dificultad para dormir), dolor de cabeza, falta de apetito, diarrea , disnea (dificultad para respirar), hipertensión (presión arterial alta), dolor de espalda, mareos, tos, dolor en las articulaciones, sofocos y disminución de células blancas de la sangre.
El niraparib fue aprobado para uso médico en los Estados Unidos y en la Unión Europea en 2017.
Usos médicos
Niraparib está indicado para el tratamiento de mantenimiento de adultos con cáncer epitelial de ovario , trompas de Falopio o peritoneal primario recurrente que están en respuesta completa o parcial a la quimioterapia a base de platino .
En octubre de 2019, la indicación de niraparib se amplió para incluir a las personas con cáncer avanzado de ovario, trompas de Falopio o peritoneal primario tratadas con tres o más regímenes de quimioterapia previos y cuyo cáncer está asociado con un estado positivo de deficiencia de recombinación homóloga (HRD). La HRD se define por una mutación de BRCA deletérea o presuntamente dañina, o inestabilidad genómica en pacientes con progresión de la enfermedad mayor de seis meses después de la respuesta a la última quimioterapia basada en platino.
En abril de 2020, la indicación de niraparib se amplió para incluir el tratamiento de mantenimiento de adultos con cáncer epitelial avanzado de ovario, trompas de Falopio o peritoneal primario que tienen una respuesta completa o parcial a la quimioterapia de primera línea basada en platino.
En la Unión Europea, niraparib está indicado: como monoterapia para el tratamiento de mantenimiento de adultos con cáncer epitelial avanzado (estadios FIGO III y IV) de ovario, de trompas de Falopio o primario peritoneal de grado alto que responden (completa o parcialmente) después de la finalización del tratamiento. quimioterapia de primera línea a base de platino; y como monoterapia para el tratamiento de mantenimiento de adultos con cáncer de ovario, trompas de Falopio o peritoneal primario, epitelial seroso de alto grado recidivante y sensible al platino que responden (total o parcialmente) a la quimioterapia basada en platino.
Contraindicaciones
No se enumeran contraindicaciones en la información de prescripción.
Efectos secundarios
Los efectos secundarios más comunes en los estudios fueron recuentos bajos de células sanguíneas, a saber, trombocitopenia (en el 61% de los pacientes, grave en el 29%), anemia (en el 50%, grave en el 25%) y neutropenia (en el 30%, grave en el 20%). ). Otros efectos secundarios, en su mayoría de leves a moderados, incluyeron náuseas , fatiga y estreñimiento . En un estudio que duró 250 días ( mediana ), el 15% de los pacientes tuvo que suspender permanentemente niraparib debido a los efectos adversos.
Interacciones
No se han realizado estudios de interacción clínica. El potencial de interacciones con otros fármacos es bajo, ya que niraparib y su principal metabolito M1 no interactúan de forma significativa con ninguna de las importantes enzimas hepáticas del citocromo P450 in vitro . Niraparib, pero no M1, es transportado por la glicoproteína P y BCRP , pero no los inhibe de manera significativa. Ni el niraparib ni el M1 interactúan significativamente con ninguna de las otras proteínas transportadoras importantes.
Farmacología
Mecanismo de acción
Niraparib es un inhibidor de las enzimas PARP1 y PARP2 .
Farmacocinética
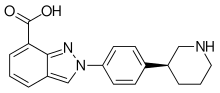
El 73% del niraparib ingerido se absorbe en el intestino y alcanza las concentraciones plasmáticas más altas después de aproximadamente tres horas, independientemente de la ingesta de alimentos. En la circulación, el 83% de la sustancia se une a las proteínas plasmáticas . Es inactivado por carboxilesterasas al metabolito principal M1, el derivado del ácido carboxílico , que posteriormente se glucuronida .
La vida media biológica media es de 36 horas. El 47,5% de la sustancia se encuentra en la orina y el 38,8% en las heces. El niraparib no metabolizado representa el 11% en la orina y el 19% en las heces.
Química
El fármaco se utiliza en forma de sal monohidrato de tosilato de niraparib , que es de color blanco a blanquecino, cristales no higroscópicos .
Estudios
Un estudio de 2012 en una línea celular encontró que los inhibidores de PARP exhiben efectos citotóxicos no basados únicamente en su inhibición enzimática de PARP, sino por su captura de PARP en el ADN dañado, y la fuerza de esta actividad de captura se ordenó niraparib >> olaparib >> veliparib .
Historia
Niraparib recibió la designación de vía rápida por parte de la Administración de Alimentos y Medicamentos de los EE. UU . (FDA), y Tesaro presentó una nueva solicitud de medicamento en 2016. Fue aprobado el 27 de marzo de 2017 en los EE. UU. Y aprobado en la Unión Europea el 16 de noviembre de 2017.
En un estudio con 553 pacientes, la supervivencia libre de progresión (SSP) para los pacientes con una mutación de BRCA perjudicial o presuntamente perjudicial en la línea germinal fue de 21,0 meses con niraparib, en comparación con 5,5 meses con placebo . Los pacientes sin dicha mutación tuvieron una SSP de 9,3 meses con niraparib frente a 3,9 meses con placebo.
La Administración de Drogas y Alimentos de los EE. UU . (FDA) otorgó la solicitud para la vía rápida de niraparib , la revisión de prioridad , la terapia innovadora y las designaciones de medicamentos huérfanos .
Referencias
enlaces externos
- "Niraparib" . Portal de información sobre medicamentos . Biblioteca Nacional de Medicina de EE. UU.
- "Tosilato de niraparib" . Portal de información sobre medicamentos . Biblioteca Nacional de Medicina de EE. UU.
- "Tosilato de niraparib monohidrato" . Diccionario de drogas del NCI . Instituto Nacional del Cáncer.
- "Tosilato de niraparib monohidrato" . Instituto Nacional del Cáncer . 14 de abril de 2017.
