Procolágeno-prolina dioxigenasa - Procollagen-proline dioxygenase
| Procolágeno-prolina dioxigenasa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
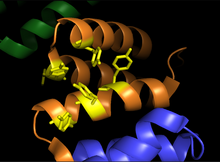
 Subunidades alfa de procolágeno-prolina dioxigenasa. La imagen muestra la región de unión del sustrato (naranja) y el surco de unión de los residuos de tirosina (amarillo)
| |||||||||
| Identificadores | |||||||||
| CE no. | 1.14.11.2 | ||||||||
| No CAS. | 9028-06-2 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| FÁCIL | NiceZyme vista | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | camino metabólico | ||||||||
| PRIAM | perfil | ||||||||
| Estructuras PDB | RCSB PDB PDBe PDBsum | ||||||||
| Ontología de genes | AmiGO / QuickGO | ||||||||
| |||||||||
La procolágeno-prolina dioxigenasa , comúnmente conocida como prolil hidroxilasa , es un miembro de la clase de enzimas conocidas como hidroxilasas dependientes de alfa-cetoglutarato . Estas enzimas catalizan la incorporación de oxígeno en sustratos orgánicos a través de un mecanismo que requiere ácido alfa-cetoglutárico , Fe 2+ y ascorbato . Esta enzima en particular cataliza la formación de (2 S , 4 R ) -4-hidroxiprolina , un compuesto que representa la modificación postraduccional más prevalente en el proteoma humano .
Mecanismo enzimático
La procolágeno-prolina dioxigenasa cataliza la siguiente reacción:
L-prolina + ácido alfa-cetoglutárico + O 2 → (2 S , 4 R ) -4-hidroxiprolina + succinato + CO 2
El mecanismo de reacción es similar al de otras dioxigenasas y se produce en dos etapas distintas: en la primera, se produce una especie Fe (IV) = O altamente reactiva . El oxígeno molecular se une por los extremos en una posición axial, produciendo una unidad de dioxígeno. El ataque nucleofílico sobre C2 genera un intermedio tetraédrico, con pérdida del doble enlace en la unidad de dioxígeno y enlaces al hierro y al carbono alfa del 2-oxoglutarato. La posterior eliminación de CO 2 coincide con la formación de la especie Fe (IV) = O. La segunda etapa implica la abstracción del átomo de hidrógeno pro - R del C-4 del sustrato de prolina seguido de la combinación de radicales , que produce hidroxiprolina.
Como consecuencia del mecanismo de reacción, una molécula de 2-oxoglutarato se descarboxila , formando succinato. Este succinato se hidroliza y se reemplaza por otro 2-oxoglutarato después de cada reacción, y se ha llegado a la conclusión de que, en presencia de 2-oxoglutarato, el Fe 2+ unido a la enzima se convierte rápidamente en Fe 3+ , lo que lleva a la inactivación de la enzima. El ascorbato se utiliza como cofactor para reducir el Fe 3+ de nuevo a Fe 2+ .
Estructura enzimática
La prolil hidroxilasa es un tetrámero con 2 subunidades únicas. La subunidad α es de 59 kDa y es responsable tanto de la unión del péptido como de la actividad catalítica. El dominio de unión del péptido abarca los residuos 140-215 de la subunidad α y consiste en una superficie cóncava revestida con múltiples residuos de tirosina que interactúan favorablemente con el sustrato rico en prolina. El sitio activo consiste en Fe2 + unido a dos residuos de histidina y un residuo de aspartato , una característica compartida por la mayoría de las dioxigenasas dependientes de 2-oxoglutarato. La subunidad β de 55 kDa es responsable de la localización y retención de la enzima en el retículo endoplásmico . Esta subunidad es idéntica a la enzima conocida como proteína disulfuro isomerasa .
Función biológica
La prolil hidroxilasa cataliza la formación de hidroxiprolina. La modificación tiene un impacto significativo en la estabilidad del colágeno , el principal tejido conectivo del cuerpo humano. Específicamente, la hidroxilación aumenta la temperatura de fusión (T m ) de colágeno helicoidal por 16 ° C, en comparación con el colágeno no hidroxilada, una diferencia que permite que la proteína sea estable a temperatura corporal. Debido a la abundancia de colágeno (aproximadamente un tercio de la proteína total) en los seres humanos y la alta incidencia de esta modificación en el colágeno, la hidroxiprolina es cuantitativamente la modificación postraduccional más abundante en los seres humanos.
La enzima actúa específicamente sobre la prolina contenida en el motivo X-Pro-Gly, donde Pro es prolina. Debido a este comportamiento específico del motivo, la enzima también actúa sobre otras proteínas que contienen esta misma secuencia. Dichas proteínas incluyen C1q , elastinas , PrP , Argonaute 2 y conotoxinas , entre otras.
Relevancia de la enfermedad
Como la prolil hidroxilasa requiere ascorbato como cofactor para funcionar, su ausencia compromete la actividad de la enzima. La hidroxilación disminuida resultante conduce a la enfermedad conocida como escorbuto . Dado que la estabilidad del colágeno se ve comprometida en pacientes con escorbuto, los síntomas incluyen debilitamiento de los vasos sanguíneos que causan púrpura , petequias y hemorragia gingival.
El factor inducible por hipoxia (HIF) es un factor de transcripción conservado evolutivamente que permite que la célula responda fisiológicamente a las disminuciones de oxígeno. Se ha identificado una clase de prolil hidroxilasas que actúan específicamente sobre HIF; La hidroxilación de HIF permite que la proteína se dirija a la degradación. La prolilhidroxilasa de HIF ha sido el objetivo de una variedad de inhibidores que tienen como objetivo tratar el accidente cerebrovascular , la enfermedad renal, la isquemia , la anemia y otras enfermedades importantes.
Nombres Alternativos
- Protocolágeno hidroxilasa
- Prolil hidroxilasa
- Prolil 4-hidroxilasa
- Protocolágeno prolil hidroxilasa
Referencias
enlaces externos
- Procolágeno-prolina + dioxigenasa en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .
- Dominio de Fe (2+) 2-oxoglutarato dioxigenasa en PROSITE