Complejo de carga de péptidos - Peptide loading complex
El complejo de carga de péptidos (PLC) es un complejo de proteínas de membrana de múltiples subunidades de vida corta que se encuentra en el retículo endoplásmico (RE). Orquesta la translocación y selección de péptidos mediante moléculas de clase I del complejo principal de histocompatibilidad (MHC-I) . Los complejos péptido-MHC I estables se liberan a la superficie celular para promover la respuesta de las células T contra las células malignas o infectadas. A su vez, las células T reconocen los péptidos activados, que pueden ser inmunogénicos o no inmunogénicos .
Descripción general
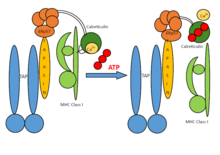
Un conjunto de PLC consta de siete subunidades, incluidos los transportadores asociados con el procesamiento de antígenos (TAP1 y TAP2, denominados conjuntamente TAP), la oxidorreductasa ERp57 , el heterodímero MHC-I y las chaperonas tapasina y calreticulina . TAP transporta productos de degradación proteasomal desde el citosol al lumen del RE, donde se cargan en moléculas MHC-I. Los complejos péptido-MHC-I luego se mueven a través de una vía secretora hacia la superficie celular, presentando su carga antigénica a las células T citotóxicas.
En general, las cadenas pesadas preliminares de MHC-I están acompañadas por el sistema calnexina-calreticulina en el RE. Junto con la β2-microglobulina (β2m), las cadenas pesadas de MHC-I forman conjuntos de heterodímeros que actúan como receptores de péptidos antigénicos. Los heterodímeros vacíos de MHC-I son reclutados por calreticulina y forman PLC macromolecular de corta duración donde la tapasina acompañante proporciona además estabilización en las moléculas de MHC-I. Además, ERp57 y tapasina forman conjugados unidos por enlaces disulfuro , y la tapasina es crucial para mantener la estabilidad estructural del PLC, así como para facilitar la carga óptima de péptidos. Después del control de calidad final, durante el cual los heterodímeros de MHC-I se someten a edición de péptidos, se liberan complejos péptido-MHC-I estables a la superficie celular para el reconocimiento de las células T. El PLC puede servir a una gran variedad de alomorfos del MHC-I , desempeñando así un papel central en la diferenciación y cebado de los linfocitos T, y en el control de las infecciones virales y el desarrollo de tumores.
Estructura
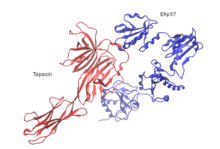
Hasta el momento, solo se ha dilucidado la estructura del PLC humano mediante crio-microscopía electrónica de partícula única (crio-EM). La organización estructural consta de moléculas de tapasina, calreticulina, ERp57 y MHC-I que se centran alrededor de TAP y tienen una orientación pseudo-simétrica. El tamaño del PLC es de 150 Å por 150 Å con una altura total de 240 Å a través de la membrana ER. Dos moléculas de tapasina opuestas dan forma al dominio central en el PLC. En este modelo, el residuo E225 del dominio similar a inmunoglobulina N-terminal de una molécula y R60, que se encuentra en el motivo helicoidal corto del barril β N-terminal de siete hebras de la segunda molécula, en la distancia del puente salino . Estos residuos se conservan entre los vertebrados con mandíbulas, pero faltan en el PLC aviar. Esto es consistente con la existencia de una única copia de tapasina en el PLC aviar y la ausencia de un dominio transmembrana N-terminal (TMD0) en el TAP1 aviar. Los dominios ER-luminal de las moléculas de tapasina opuestas se inclinan 30 ° entre sí, colocando los dos puntos de entrada de la membrana de las hélices transmembrana a 60 Å de distancia. La torsión de dominio resultante excluye la unión de calreticulina o calnexina al glicano del andamio de tapasina dimérica y explica por qué solo tapasina madura puede ensamblarse en el PLC. Otra característica estructural es que ERp57 en su conformación típica en forma de U forma un complejo con tapasina a través de los dominios ay a 'catalíticamente activos. La orientación inesperada de tapasina permite que la extensión C-terminal del dominio a 'del trans ERp57 interaccione con el dominio tipo inmunoglobulina C-terminal de la tapasina cis, lo que potencialmente aumenta la estabilidad del PLC.
Esta estructura crio-EM revela un alto grado de plasticidad del sándwich N-terminal de tres láminas β de tapasina y muestra que la fijación flexible de MHC-I es esencial para que tapasina ejerza su función de corrección de pruebas. La calreticulina es crucial y depende en gran medida del ensamblaje y maduración del MHC-I en el PLC. El dominio de lectina globular de la calreticulina alberga un sitio de unión a glucanos, que detecta restos de monoglucosa de MHC-I glucosilado con núcleo N antes de que se asocie con tapasina. La rama monoglucosilada del glucano del núcleo N que emana del N86 del MHC-I se une a la superficie de unión del glucano de la calreticulina, mientras que es probable que otra rama de manosa se encuentre cerca de los residuos en el borde del sándwich β de lectina. De acuerdo con su actividad de detección de lípidos dependiente del calcio propuesta, la cola ácida C-terminal de la calreticulina apunta hacia la valva de la membrana luminal ER, donde se encuentra cerca del dominio de tapasina similar a la inmunoglobulina C-terminal. En la estructura crio-EM se hace hincapié en el papel central del dominio de tapasina similar a inmunoglobulina C-terminal, que actúa como un núcleo de interacción multivalente esencial para las subunidades restantes de PLC. Una cavidad central que conecta la salida de la vía de translocación de péptidos de TAP con la luz del RE a través de dos ventanas laterales podría servir como una cesta molecular para los péptidos transportados antes de que sean editados por aminopeptidasas residentes en el RE.
GRIFO
TAP es un complejo heterodimérico, que consta de miembros TAP1 (ABCB2) y TAP2 (ABCB3) de la superfamilia de transportadores ABC. La característica común de todos los transportadores ABC es su organización: 1) en dos dominios transmembrana (TMD) y 2) en dos dominios de unión a nucleótidos (NBD). Ambos dominios intramoleculares están acoplados entre sí y cuando la unión de ATP está en curso, los cambios conformacionales en los TMD permiten que los productos de degradación proteasomal se muevan a través de la membrana. TAP reconoce y transporta los péptidos antigénicos producidos en el citosol directamente al ER, mientras que tapasin reconoce el tipo de péptidos que tienen la capacidad de formar complejos estables con MHC-I. Este proceso se conoce como corrección o edición de péptidos. Los péptidos seleccionados mediante corrección de pruebas mejoran la estabilidad del MHC-I; tapasin también contribuye a la edición de epítopos de péptidos inmunogénicos. Sin embargo, solo recientemente se demostró a través de estudios bioquímicos, biofísicos y estructurales que una función clave en la inmunidad adaptativa, el mecanismo catalítico de corrección de péptidos, es realizada por tapasina y TAPBPR (relacionada con la proteína de unión a TAP, un homólogo de tapasina).
Tapasin
Cresswell y sus colaboradores descubrieron por primera vez la tapasina (glicoproteína asociada a TAP) como una proteína de 48 kDa en complejos aislados con anticuerpos TAP1 de lisados de digitonina de células linfoblastoides B humanas. Tapasin une HC / β2m junto con los chaperones ER al transportador de péptidos. Se encuentra en el RE y su función consiste en mantener juntas las moléculas de clase I junto con la chaperona calreticulina y la ERp57 a TAP. Estudios de una línea celular deficiente en tapasina y de ratones portadores de un gen de tapasina alterado, el complejo de corta duración de moléculas de clase I.
Tapasin y TAP son muy importantes para la estabilización de las moléculas de clase I y también para la optimización del péptido presentado a las células T citotóxicas. Se encontró una proteína homóloga de tapasina independiente de PLC llamada TAPBPR que tiene la capacidad de actuar como un segundo corrector o editor de péptidos específicos de MHC-I, pero no posee un dominio transmembrana. Tapasin y TAPBPR comparten interfaces de unión similares en MHC-I, como se muestra con la estructura de rayos X de TAPBPR con MHC-I (cadena pesada y microglobulina β2). El uso de un péptido fotoescindible de alta afinidad permitió a los investigadores formar moléculas MHC-I estables (unidas) y luego formar un complejo TAPBPR y MHC-I estable con escisión por luz UV del péptido fotoinducido.
ERp57
ERp57 es una enzima de la familia de las tiol oxidorreductasa ubicada en el RE. Se une a los sustratos de forma indirecta a través de la asociación con la chaperona molecular calreticulina del complejo de carga de péptidos. En las primeras etapas de generación de moléculas de MHC-I, ERp57 se asocia con cadenas pesadas de MHC-I libres. Como resultado, su función está determinada por la formación de enlaces disulfuro en las cadenas pesadas, por el plegamiento oxidativo de la cadena pesada y, finalmente, por el hecho de que ERp57 está cargando los péptidos en las moléculas de MHC-I.
MHC-I
Las cadenas pesadas preliminares del MHC-I forman acompañantes con la ayuda del complejo calnexina-calreticulina en el ER. Además de esto, la β2-microglobulina (β2m) se une a las cadenas pesadas de los heterodímeros y en su conjunto actúan como receptores de péptidos antigénicos. Cuando las cadenas de MHC-I están vacías, son reclutadas por calreticulina y forman un PLC transitorio.
Tapasin juega regularmente un papel en la estabilización del MHC-I. Solo después de que se hayan desplegado heterodímeros de MHC-I para la corrección o edición de péptidos, se liberan complejos de pMHC-I (péptido-MHC-I) estables a la superficie celular para el reconocimiento y destrucción de células infectadas por virus o neoplásicas malignamente. En general, cada organismo individual posee una colección de seis moléculas MHC-I (tres de cada padre). Así, en emergencias autoinmunes , los donantes compatibles son parientes que poseen una colección similar de moléculas MHC-I, además de las del receptor.
Calreticulina
La calreticulina, especialmente su dominio similar a la lectina, interactúa con MHC-I. El dominio P se enfrenta al sitio de unión del péptido MHC-I hacia ERp57. Esta orientación hace posible que tapasin adhiera y asegure el MHC-I. Esta translocación de TAP facilita su apertura hacia una cavidad luminal ER, bordeada por puntos de entrada de membrana estándar como los de tapasin y MHC-I. Estos dos puntos de entrada facilitan el reclutamiento de MHC-I con una carga óptima de péptidos y la eventual liberación de MHC-I en las superficies de las células T para su reconocimiento.