Ensayo de unión a ligando - Ligand binding assay
Un ensayo de unión de ligando ( LBA ) es un ensayo o un procedimiento analítico que se basa en la unión de moléculas de ligando a receptores , anticuerpos u otras macromoléculas . Se usa un método de detección para determinar la presencia y extensión de los complejos ligando-receptor formados, y esto se determina normalmente electroquímicamente o mediante un método de detección por fluorescencia . Este tipo de prueba analítica se puede usar para probar la presencia de moléculas diana en una muestra que se sabe que se unen al receptor.
Existen numerosos tipos de ensayos de unión de ligandos, tanto radiactivos como no radiactivos. Como tal, los ensayos de unión de ligandos son un superconjunto de ensayos de radiounión , que son el inverso conceptual de los radioinmunoensayos (RIA). Algunos tipos más nuevos se denominan ensayos de "mezcla y medida" porque no requieren la separación del ligando unido del no unido.
Los ensayos de unión de ligandos se utilizan principalmente en farmacología para diversas demandas. Específicamente, a pesar de los receptores , hormonas y otros neurotransmisores endógenos del cuerpo humano , los farmacólogos utilizan ensayos para crear fármacos que sean selectivos, o imiten, los componentes celulares que se encuentran endógenamente. Por otro lado, estas técnicas también están disponibles para crear antagonistas de los receptores con el fin de evitar más cascadas. Estos avances brindan a los investigadores la capacidad no solo de cuantificar hormonas y receptores hormonales, sino también de aportar información farmacológica importante en el desarrollo de fármacos y planes de tratamiento.
Historia
Históricamente, las técnicas de ensayo de unión de ligandos se utilizaron ampliamente para cuantificar las concentraciones de hormonas o receptores de hormonas en plasma o tejido. La metodología del ensayo de unión al ligando cuantificó la concentración de la hormona en el material de prueba comparando los efectos de la muestra de prueba con los resultados de cantidades variables de proteína conocida ( ligando ).
Los cimientos sobre los que se han construido los ensayos de unión de ligandos son el resultado de Karl Landsteiner , en 1945, y su trabajo sobre la inmunización de animales mediante la producción de anticuerpos para ciertas proteínas. El trabajo de Landsteiner demostró que la tecnología de inmunoensayo permitió a los investigadores analizar a nivel molecular. Rosalyn Sussman Yalow y Solomon Berson informaron del primer ensayo de unión de ligando exitoso en 1960 . Investigaron la interacción de unión de la insulina y un anticuerpo específico de la insulina, además de desarrollar el primer radioinmunoensayo (RIA) para la insulina. Estos descubrimientos proporcionaron información valiosa sobre la sensibilidad y la especificidad de las hormonas proteicas que se encuentran en los fluidos sanguíneos. Yalow y Berson recibieron el Premio Nobel de Medicina como resultado de sus avances. A través del desarrollo de la tecnología RIA, los investigadores han podido ir más allá del uso de radiactividad y, en su lugar, utilizar ensayos de inmunorradiométricos, competitivos y de fase líquida y sólida. Como resultado directo de estos hallazgos monumentales, los investigadores han continuado el avance de los ensayos de unión de ligandos en muchas facetas en los campos de la biología, la química y similares.
Aplicaciones
Los ensayos de unión de ligandos proporcionan una medida de las interacciones que ocurren entre dos moléculas, como las uniones a proteínas, así como el grado de afinidad (débil, fuerte o sin conexión) por el cual los reactivos se unen. Los aspectos esenciales de los ensayos de unión incluyen, entre otros, el nivel de concentración de reactivos o productos ( ver sección radioactiva ), mantener el equilibrio constante de los reactivos durante todo el ensayo y la fiabilidad y validez de las reacciones enlazadas. Aunque los ensayos de unión son simples, no brindan información sobre si el compuesto que se está probando afecta o no la función del objetivo.
Ensayos de radioligando
Los radioligandos se utilizan para medir la unión del ligando a los receptores y, idealmente, deberían tener alta afinidad, baja unión no específica, alta actividad específica para detectar bajas densidades de receptor y especificidad de receptor.
Los niveles de radiactividad de un radioligando (por mol) se denominan actividad específica (SA), que se mide en Ci / mmol. La concentración real de un radioligando está determinada por la mezcla de stock específica para la que se originó el radioligando (de los fabricantes). La siguiente ecuación determina la concentración real:
Enlace de saturación
El análisis de saturación se usa en varios tipos de tejidos, como fracciones de plasma parcialmente purificado de homogeneizados de tejido , células transfectadas con receptores clonados y células que están en cultivo o aisladas antes del análisis. El análisis de unión por saturación puede determinar la afinidad y densidad del receptor. Requiere que la concentración elegida se determine empíricamente para un nuevo ligando.
Hay dos estrategias comunes que se adoptan para este tipo de experimento: aumentar la cantidad de radioligando agregado mientras se mantiene tanto la actividad específica constante como la concentración constante de radioligando, o disminuir la actividad específica del radioligando debido a la adición de un ligando no marcado.
Parcela Scatchard
Se puede utilizar un gráfico de Scatchard ( gráfico de Rosenthal) para mostrar la afinidad del radioligando. En este tipo de gráfico, la relación de radioligando unido / libre se representa frente al radioligando unido. La pendiente de la línea es igual al recíproco negativo de la constante de afinidad (K). La intersección de la línea con el eje X es una estimación de Bmax. El gráfico de Scatchard se puede estandarizar con una referencia apropiada para que pueda haber una comparación directa de la densidad de receptores en diferentes estudios y tejidos. Esta gráfica de muestra indica que el radioligando se une con una sola afinidad. Si el ligando se hubiera unido a múltiples sitios que tienen diferentes afinidades de radioligando, entonces el gráfico de Scatchard habría mostrado una línea cóncava en su lugar.
Ajuste de curva no lineal
Los programas de ajuste de curvas no lineales, como Equilibrium Binding Data Analysis (EBDA) y LIGAND, se utilizan para calcular estimaciones de parámetros de enlace a partir de experimentos de saturación y enlace de competición. EBDA realiza el análisis inicial, que convierte la radioactividad medida en concentraciones molares y crea pendientes Hill y transformaciones de Scatchard a partir de los datos. Luego, LIGAND puede utilizar el análisis realizado por EBDA para estimar un modelo específico para la unión.
Enlace de competición
La unión competitiva se usa para determinar la presencia de selectividad para un ligando particular para subtipos de receptores, lo que permite la determinación de la densidad y proporción de cada subtipo en el tejido. Las curvas de competencia se obtienen representando la unión específica, que es el porcentaje de la unión total, frente a la concentración logarítmica del ligando competidor. Una curva de competencia pronunciada suele indicar la unión a una única población de receptores, mientras que una curva poco profunda, o una curva con puntos de inflexión claros, es indicativa de múltiples poblaciones de sitios de unión.
Ensayos de unión no radiactiva
A pesar de las diferentes técnicas utilizadas para los ensayos no radiactivos, requieren que los ligandos exhiban características de unión similares a sus equivalentes radiactivos. Por lo tanto, los resultados de los ensayos radioactivos y no radiactivos seguirán siendo consistentes. Una de las mayores diferencias entre los ensayos de ligandos radiactivos y no radiactivos se refiere a los peligros para la salud humana. Los ensayos radiactivos son dañinos porque producen desechos radiactivos; mientras que los ensayos de ligandos no radiactivos utilizan un método diferente para evitar la producción de desechos tóxicos. Estos métodos incluyen, pero no se limitan a, polarización de fluorescencia (FP), transferencia de energía de resonancia de fluorescencia (FRET) y resonancia de plasmón de superficie (SPR). Para medir el proceso de unión ligando-receptor, la mayoría de los métodos no radiactivos requieren que el etiquetado evite interferir con las interacciones moleculares.
Polarización de fluorescencia
La polarización de fluorescencia (FP) es sinónimo de anisotropía de fluorescencia . Este método mide el cambio en la velocidad de rotación de un ligando marcado con fluorescencia una vez que se une al receptor. Se utiliza luz polarizada para excitar el ligando y se mide la cantidad de luz emitida. La despolarización de la luz emitida depende de la unión del ligando (p. Ej., Al receptor). Si el ligando no está unido, tendrá una gran despolarización (el ligando es libre de girar rápidamente, girando la luz). Si el ligando está unido, el mayor tamaño combinado da como resultado una rotación más lenta y, por lo tanto, una despolarización reducida. Una ventaja de este método es que solo requiere un paso de etiquetado. Sin embargo, este método es menos preciso a concentraciones nanomolares bajas.
Transferencia de energía de resonancia de fluorescencia
La transferencia de energía por resonancia de fluorescencia (FRET) utiliza la energía transferida entre las moléculas donadoras y aceptoras que están muy próximas. FRET usa un ligando marcado con fluorescencia, como con FP. La transferencia de energía dentro de FRET comienza excitando al donante. La interacción dipolo-dipolo entre el donante y la molécula aceptora transfiere la energía del donante a la molécula aceptora. Si el ligando está unido al complejo receptor-anticuerpo, el aceptor emitirá luz. Cuando se usa FRET, es fundamental que haya una distancia menor de 10 nm entre el aceptor y el donante, además de un espectro de absorción superpuesto entre el aceptor y el donante, y que el anticuerpo no interfiera ni bloquee el sitio de unión del ligando.
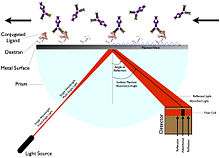
Resonancia de plasmones superficiales
La resonancia de plasma de superficie (SPR) no requiere el etiquetado del ligando. En cambio, funciona midiendo el cambio en el ángulo en el que la luz polarizada se refleja desde una superficie ( índice de refracción ). El ángulo está relacionado con el cambio de masa o capa de espesor, como la inmovilización de un ligando cambiando el ángulo de resonancia, lo que aumenta la luz reflejada. El dispositivo para el que se deriva SPR incluye un chip sensor, una celda de flujo, una fuente de luz, un prisma y un detector de posición de ángulo fijo.
Ensayos de unión en fase líquida
Inmunoprecipitación
El ensayo de unión de ligando en fase líquida de inmunoprecipitación (IP) es un método que se usa para purificar o enriquecer una proteína específica, o un grupo de proteínas, usando un anticuerpo de una mezcla compleja. El extracto de tejido o células rotas se mezcla con un anticuerpo contra el antígeno de interés, que produce el complejo antígeno-anticuerpo. Cuando la concentración de antígeno es baja, la precipitación del complejo antígeno-anticuerpo puede tardar horas o incluso días y resulta difícil aislar la pequeña cantidad de precipitado formado.
El ensayo de inmunoabsorción ligado a enzimas ( ELISA ) o la transferencia Western son dos formas diferentes de obtener y analizar el antígeno purificado (o múltiples antígenos). Este método implica la purificación de un antígeno con la ayuda de un anticuerpo adherido sobre un soporte sólido (con cuentas), como una resina de agarosa. El complejo proteico inmovilizado se puede lograr en un solo paso o sucesivamente.
El IP también se puede utilizar junto con el marcaje de radioisótopos biosintéticos. Usando esta combinación de técnicas, se puede determinar si un antígeno específico es sintetizado por un tejido o por una célula.
Ensayos de unión en fase sólida
Placa multipocillo
Las placas de múltiples pocillos son múltiples placas de Petri incorporadas en un recipiente, con un número de pocillos individuales que varía de 6 a más de 1536. Los ensayos de placas de múltiples pocillos son convenientes para manejar las dosis y réplicas necesarias. Existe una amplia gama de tipos de placas que tienen una huella, equipos de apoyo y sistemas de medición estandarizados. Los electrodos se pueden integrar en la parte inferior de las placas para capturar información como resultado de los ensayos de unión. Los reactivos de unión se inmovilizan en la superficie del electrodo y luego se pueden analizar.
Las placas multipocillo se fabrican para permitir a los investigadores crear y manipular diferentes tipos de ensayos (es decir, bioensayos , inmunoensayos , etc.) dentro de cada placa multipocillo. Debido a la variabilidad en el formato de las placas multipocillo, no es raro que surjan artefactos. Los artefactos se deben a los diferentes entornos que se encuentran dentro de los diferentes pozos de la placa, especialmente cerca de los bordes y el centro de los pozos. Estos efectos se conocen como efectos, efectos de borde y efectos de placa. Por lo tanto, se enfatiza la necesidad de colocar los diseños de ensayo de la manera correcta tanto dentro como entre cada placa.
El uso de placas multipocillo es común cuando se mide la actividad de un ensayo biológico in vitro o se mide la inmunorreactividad mediante inmunoensayos. Los artefactos pueden evitarse manteniendo la uniformidad de la placa aplicando la misma dosis del medio específico en cada pocillo, además de mantener la presión atmosférica y las tasas de temperatura para reducir la humedad.
Encuadernación con cordón
Los ensayos de unión de ligando en perlas son métodos de aislamiento para proteínas básicas, ADN / ARN u otras biomoléculas ubicadas en suspensiones indefinidas y pueden usarse en múltiples aplicaciones biocromatográficas. Los ligandos bioafinados se unen covalentemente a perlas de sílice con grupos silanol cargados negativamente terminales o perlas de poliestireno y se utilizan para el aislamiento y purificación de proteínas básicas o la adsorción de biomoléculas. Después de la unión, la separación se realiza por centrifugación (separación por densidad) o por atracción de campo magnético (solo para partículas magnéticas). Las perlas se pueden lavar para proporcionar pureza a la molécula aislada antes de disolverla mediante métodos de intercambio iónico. Los métodos de análisis directo basados en la detección enzimática / fluorescente (por ejemplo, HRP, colorante fluorescente) se pueden utilizar para la determinación o cuantificación de biomoléculas unidas en perlas.
Encuadernación en columna
Filtrar
Los ensayos de filtro son un ensayo de unión de ligando en fase sólida que utiliza filtros para medir la afinidad entre dos moléculas. En un ensayo de unión de filtros , los filtros se utilizan para atrapar las membranas celulares aspirando el medio a través de ellas. Este método rápido ocurre a una velocidad rápida en la que se puede lograr la filtración y la recuperación de la fracción encontrada. Lavar los filtros con un tampón elimina los ligandos no unidos residuales y cualquier otro ligando presente que sea capaz de eliminarse por lavado de los sitios de unión. Los complejos receptor-ligando presentes mientras se lava el filtro no se disociarán significativamente porque quedarán completamente atrapados por los filtros. Las características del filtro son importantes para cada trabajo que se realiza. Un filtro más grueso es útil para obtener una recuperación más completa de las pequeñas piezas de membrana, pero puede requerir un tiempo de lavado más prolongado. Se recomienda pretratar los filtros para ayudar a atrapar las piezas de membrana cargadas negativamente. Remojar el filtro en una solución que le daría al filtro una carga superficial positiva atraería los fragmentos de membrana cargados negativamente.
Unión celular en tiempo real
En este tipo de ensayo, se sigue la unión de un ligando a las células a lo largo del tiempo. La señal obtenida es proporcional al número de ligandos unidos a una estructura diana, a menudo un receptor, en la superficie celular. La información sobre la interacción ligando-objetivo se obtiene a partir del cambio de señal a lo largo del tiempo y se pueden calcular parámetros cinéticos tales como la constante de velocidad de asociación k a , la constante de velocidad de disociación k d y la afinidad K D. Al medir la interacción directamente en las células, no se necesita aislamiento de la proteína diana, lo que de otra manera puede ser un desafío, especialmente para algunas proteínas de membrana. Para asegurar que se mide la interacción con la estructura objetivo deseada, se recomiendan controles biológicos apropiados, como células que no expresan la estructura objetivo.
Se han utilizado mediciones en tiempo real utilizando enfoques sin etiqueta o basados en etiquetas para analizar interacciones biomoleculares en células fijadas o vivas.
La ventaja de medir las interacciones ligando-receptor en tiempo real es que no es necesario alcanzar el equilibrio de unión para una determinación precisa de la afinidad.
Especificidad de unión
Los efectos de un fármaco son el resultado de su selectividad de unión con las propiedades macromoléculas de un organismo, o la afinidad con la que se unen diferentes ligandos a un sustrato. Más específicamente, la especificidad y selectividad de un ligando a su receptor respectivo brinda a los investigadores la oportunidad de aislar y producir efectos farmacológicos específicos mediante la manipulación de las concentraciones de ligando y las densidades de receptor. Las hormonas y los neurotransmisores son ligandos reguladores endógenos esenciales que afectan a los receptores fisiológicos dentro de un organismo. Los fármacos que actúan sobre estos receptores son increíblemente selectivos para producir las respuestas necesarias de las moléculas de señalización.
La unión específica se refiere a la unión de un ligando a un receptor, y es posible que haya más de un sitio de unión específico para un ligando. La unión no específica se refiere a la unión de un ligando a algo que no sea su receptor designado, como varios otros receptores o diferentes tipos de transportadores en la membrana celular. Por ejemplo, varios antagonistas pueden unirse a múltiples tipos de receptores. En el caso de los antagonistas muscarínicos, también pueden unirse a los receptores de histamina. Estos patrones de unión se consideran técnicamente específicos, ya que el destino del ligando es específico para múltiples receptores. Sin embargo, es posible que los investigadores no se centren en tales comportamientos en comparación con otros factores vinculantes. Sin embargo, el comportamiento de unión inespecífico es una información muy importante que se debe adquirir. Estas estimaciones se miden examinando cómo se une un ligando a un receptor mientras reacciona simultáneamente a un agente sustituto (antagonista) que evitará que se produzca una unión específica.
Tipos de unión específicos para interacciones de ligando y receptor:
| Imita los efectos endógenos | Inhibe los efectos endógenos |
|---|---|
| Agonista | Antagonista |
| Agonista parcial | Antagonistas negativos (ver: agonista inverso ) |
Avances tecnológicos
Las tecnologías para el ensayo de unión de ligandos continúan avanzando en relación con el aumento de la velocidad y el mantenimiento de procedimientos rentables mientras se mantiene y aumenta la precisión y la sensibilidad. Algunos avances tecnológicos incluyen nuevos reactivos de unión como alternativas a los anticuerpos, soluciones de colorantes alternativas y sistemas de microplacas, y el desarrollo de un método para omitir el paso de filtración, que se requiere en muchos procesos de ensayo de unión de ligandos.
Una molécula de señalización prominente en las células es el calcio , (Ca 2+ ), que se puede detectar con un colorante acetoximetilo Fluo-4 . Se une a los iones de Ca 2+ libres, que a su vez aumentan ligeramente la fluorescencia del Fluo-4 AM. El inconveniente de la formulación del tinte Fluo-4 es que se requiere un paso de lavado para eliminar el tinte extracelular, que puede proporcionar señales de fondo no deseadas. Por ejemplo, el lavado ejerce una presión adicional sobre las células, además de consumir tiempo, lo que impide un análisis oportuno. Recientemente, se ha desarrollado una solución de colorante alternativa y un sistema de microplacas llamado FLIPR® (lector de placas de imágenes fluorométricas), que utiliza un reactivo de ensayo de calcio 3 que no requiere un paso de lavado. Como resultado, el cambio en la fluorescencia del tinte se puede ver en tiempo real sin demora utilizando un láser excitador y un dispositivo de carga acoplada .
Muchos ensayos de unión de ligandos requieren un paso de filtración para separar ligandos unidos y no unidos antes de la selección. Recientemente se ha desarrollado un método llamado ensayo de centelleo por proximidad (SPA), que elimina este paso que de otro modo sería crucial. Funciona a través de perlas de celosía cristalina, que están recubiertas con moléculas de acoplamiento de ligandos y llenas de iones de cerio . Estos emiten ráfagas de luz cuando son estimulados por un isótopo, que se puede medir fácilmente. Los ligandos se radiomarcan utilizando 3H o 125I y se liberan en el ensayo. Dado que solo los radioligandos que se unen directamente a las perlas inician una señal, los ligandos libres no interfieren durante el proceso de selección.
Limitaciones
Por naturaleza, los ensayos deben realizarse en un entorno controlado in vitro, por lo que este método no proporciona información sobre la unión del receptor in vivo. Los resultados obtenidos solo pueden verificar que un ligando específico se ajusta a un receptor, pero los ensayos no proporcionan forma de conocer la distribución de los receptores de unión al ligando en un organismo.
La unión del ligando in vivo y la distribución del receptor se pueden estudiar mediante la tomografía por emisión de positrones (PET), que funciona mediante la inducción de un radionúclido en un ligando, que luego se libera en el cuerpo de un organismo estudiado. Los ligandos radiomarcados se localizan espacialmente mediante un escáner PET para revelar áreas en el organismo con altas concentraciones de receptores.