Síntesis de indol de Fukuyama - Fukuyama indole synthesis
La síntesis de indol de Fukuyama es una reacción química versátil mediada por estaño que da como resultado la formación de indoles 2,3-disustituidos . Una práctica reacción en un solo recipiente que puede ser útil para la creación de indoles disustituidos. Más comúnmente, se utiliza hidruro de tributilestaño como agente reductor, con azobisisobutironitrilo (AIBN) como iniciador de radicales. También se puede usar trietilborano como iniciador de radicales. La reacción puede comenzar con un derivado de orto -isocianoestireno o de 2- alqueniltioanilida , ambos formando el indol mediante ciclación de radicales mediante un radical α-estannoimidoilo. El grupo R puede ser una variedad de grupos funcionales sensibles tanto básicos como ácidos, tales como ésteres, éteres de THP y β-lactámicos. Además, la reacción no es estereoespecífica , ya que se pueden usar tanto la isoforma cis como la trans para obtener el producto deseado.
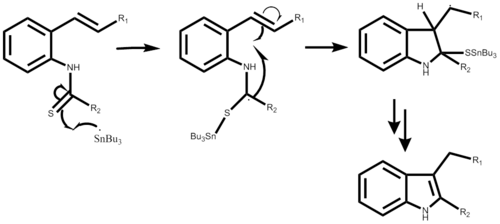
Mecanismo
El mecanismo de reacción comienza con la creación del radical tributil estaño con AIBN o trietilborano, que no se muestran en ninguno de los mecanismos escalonados. Después de que el radical ataca el carbono o-isociano creando el radical alfa-estannoimidoilo. Mediante la ciclación de radicales se forma un anillo de cinco miembros seguido de la propagación de un nuevo radical de estaño. El paso final depende del resultado deseado de la reacción. Esta reacción es una síntesis de un solo recipiente y da como resultado rendimientos que varían de 50% a 98% dependiendo del sustituyente.
El mecanismo que utiliza 2-alqueniltioanilida es muy similar, comenzando también con la formación de un enlace, ahora entre el radical de estaño y el azufre. Seguido de una ciclación radical similar que da como resultado un anillo de cinco miembros, se produce un nuevo radical de estaño y el radical atacante original se va con el sustituyente azufre. Esta parte del mecanismo paso a paso aún no se ha detallado. El rendimiento de la reacción puede oscilar entre el 40% y el 93% dependiendo también del sustituyente deseado.
Derivados
La síntesis de Fukuyama Indole puede generar una variedad de sustituyentes diferentes en la posición 2,3 que antes eran inalcanzables sin un grupo protector en el nitrógeno del anillo. Un ejemplo de ello es el derivado de 2-yodoindol, que luego puede conducir a una variedad de indoles 2,3 sustituidos N-no protegidos. Antes del descubrimiento de este compuesto, no se había desarrollado la química que involucraba a los 2-estanilindoles ya que no había forma de sintetizar prácticamente estos 2,3-estanilindoles N-desprotegidos. Uno se limitó a la producción de 2-estannilindoles N-protegidos mediante metalación mediante un proceso conocido como acoplamiento de Stille . Los 2-estanilindoles N-desprotegidos generados a partir de la Síntesis de Fukuyama se pueden oxidar fácilmente con yodo abriendo un área de la química que permite la síntesis de una variedad de compuestos utilizando los 2-yodoindoles como reactivo de partida. Este derivado sustituido con yodo puede conducir a haluros de arilo, yoduros de vinilo, triflatos de vinilo, bromuros de bencilo.
Además de acetilenos ( acoplamiento de Sonogashira ) y acrilatos ( reacción de Heck ) en la segunda posición.
Aplicaciones
La síntesis es uno de los métodos más simples para crear indoles polisustituidos, este procedimiento se ha utilizado en numerosas síntesis de productos naturales , incluyendo aspidofitina , vinblastina y estricnina.
A continuación se muestra el cuarto paso en la síntesis de (+) - Vinblastina, la aplicación de la síntesis de Fukuyama Indole para crear un indol disustituido.
Además, la reacción de fukuyama juega un papel en la síntesis de indolocarbazoles, biindolilos y la síntesis total de vincadifformina y tabersonina.