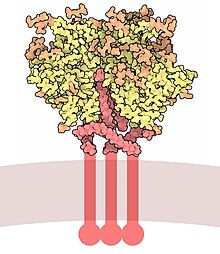
Glicoproteína de envoltura GP120 - Envelope glycoprotein GP120
| Envoltura de glicoproteína gp120 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | GP120 | ||||||||
| Pfam | PF00516 | ||||||||
| InterPro | IPR000777 | ||||||||
| SCOP2 | 1gc1 / SCOPe / SUPFAM | ||||||||
| |||||||||
La glicoproteína de la envoltura GP120 (o gp120 ) es una glicoproteína expuesta en la superficie de la envoltura del VIH . Fue descubierto por los profesores Tun-Hou Lee y Myron "Max" Essex de la Escuela de Salud Pública de Harvard en 1988. El 120 en su nombre proviene de su peso molecular de 120 kDa . Gp120 es esencial para la entrada del virus en las células, ya que juega un papel vital en la unión a receptores específicos de la superficie celular . Estos receptores son DC-SIGN , Heparán Sulfato Proteoglicano y una interacción específica con el receptor CD4 , particularmente en las células T colaboradoras . La unión a CD4 induce el inicio de una cascada de cambios conformacionales en gp120 y gp41 que conducen a la fusión de la membrana viral con la membrana de la célula huésped . La unión a CD4 es principalmente electrostática, aunque existen interacciones de van der Waals y enlaces de hidrógeno .
Gp120 está codificado por el gen env del VIH , que tiene una longitud de alrededor de 2,5 kb y codifica alrededor de 850 aminoácidos. El producto env primario es la proteína gp160, que se escinde en gp120 (~ 480 aminoácidos) y gp41 (~ 345 aminoácidos) en el retículo endoplasmático por la proteasa celular furina . La estructura cristalina del núcleo gp120 muestra una organización con un dominio externo, un dominio interno con respecto a sus terminales y una hoja puente . Gp120 se ancla a la membrana viral , o envoltura, a través de enlaces no covalentes con la glicoproteína transmembrana , gp41 . Tres gp120s y gp41s se combinan en un trímero de heterodímeros para formar el pico de la envoltura, que media la unión y la entrada a la célula huésped.
Variabilidad
Dado que la gp120 juega un papel vital en la capacidad del VIH-1 para ingresar a las células CD4 + , su evolución es de particular interés. Muchos anticuerpos neutralizantes se unen a sitios ubicados en regiones variables de gp120, por lo que las mutaciones en estas regiones se seleccionarán fuertemente. Se ha demostrado que la diversidad de env aumenta en un 1-2% por año en el grupo M del VIH-1 y las unidades variables son notables por los rápidos cambios en la longitud de la secuencia de aminoácidos. Los aumentos en la variabilidad de gp120 dan como resultado niveles significativamente elevados de replicación viral, lo que indica un aumento en la aptitud viral en individuos infectados por diversas variantes del VIH-1. Otros estudios han demostrado que la variabilidad en los sitios potenciales de glicosilación ligados a N (PNGS) también da como resultado un aumento de la aptitud viral. Los PNGS permiten la unión de carbohidratos de cadena larga a las regiones de alta variabilidad de gp120, por lo que los autores plantean la hipótesis de que el número de PNGS en env podría afectar la aptitud del virus al proporcionar más o menos sensibilidad a los anticuerpos neutralizantes. La presencia de grandes cadenas de carbohidratos que se extienden desde gp120 podría ocultar posibles sitios de unión de anticuerpos.
Los límites del potencial para agregar y eliminar PNGS se exploran ingenuamente mediante el crecimiento de las poblaciones virales después de cada nueva infección. Mientras que el huésped transmisor ha desarrollado una respuesta de anticuerpos neutralizantes a gp120, el huésped recién infectado carece de reconocimiento inmunológico del virus. Los datos de la secuencia muestran que las variantes virales iniciales en un huésped sin experiencia inmunológica tienen pocos sitios de glicosilación y bucles variables expuestos más cortos. Esto puede facilitar la capacidad viral para unirse a los receptores de la célula huésped. A medida que el sistema inmunológico del huésped desarrolla anticuerpos contra gp120, las presiones inmunitarias parecen seleccionar un aumento de la glicosilación, particularmente en los bucles variables expuestos de gp120. En consecuencia, las inserciones en env , que confieren más PNGS a gp120, pueden ser más toleradas por el virus, ya que una mayor densidad de glucanos promueve la capacidad viral para evadir anticuerpos y, por lo tanto, promueve una mayor aptitud viral. Al considerar cuánto podría cambiar teóricamente la densidad de PNGS, puede haber un límite superior para el número de PNGS debido a su inhibición del plegamiento de gp120, pero si el número de PNGS disminuye sustancialmente, entonces el virus se detecta con demasiada facilidad mediante anticuerpos neutralizantes. Por lo tanto, es probable que se establezca un equilibrio de selección estabilizador entre densidades de glucanos bajas y altas. Un número más bajo de glucanos voluminosos mejora la eficiencia de la replicación viral y un número más alto en los bucles expuestos ayuda a la evasión inmune del huésped a través del disfraz.
La relación entre gp120 y anticuerpos neutralizantes es un ejemplo de la dinámica evolutiva de la Reina Roja . Se requiere una adaptación evolutiva continua para que la proteína de la envoltura viral mantenga la aptitud en relación con las adaptaciones evolutivas continuas de los anticuerpos neutralizantes inmunes del huésped, y viceversa, formando un sistema coevolutivo.
Objetivo de la vacuna
Dado que la unión al receptor CD4 es el paso más obvio en la infección por VIH, la gp120 fue uno de los primeros objetivos de la investigación de la vacuna contra el VIH . Sin embargo, los esfuerzos para desarrollar vacunas contra el VIH dirigidas a la gp120 se han visto obstaculizados por las propiedades químicas y estructurales de la gp120, que dificultan que los anticuerpos se unan a ella. La gp120 también puede desprenderse fácilmente de la superficie del virus y ser capturada por las células T debido a su unión suelta con la gp41. Se ha identificado una región conservada en la glicoproteína gp120 que está implicada en la unión metaestable de gp120 a CD4 y se ha logrado el direccionamiento de la región invariante con un anticuerpo ampliamente neutralizante, IgG1-b12.
La investigación de los NIH publicada en Science informa el aislamiento de 3 anticuerpos que neutralizan el 90% de las cepas de VIH-1 en la región CD4bs de gp120, lo que potencialmente ofrece una estrategia terapéutica y de vacuna. [1] Sin embargo, la mayoría de los anticuerpos que se unen a la región CDbs de gp120 no neutralizan el VIH, y los raros que lo hacen, como IgG1-b12, tienen propiedades inusuales como la asimetría de los brazos Fab o en su posición. A menos que se pueda diseñar una vacuna basada en gp120 para provocar anticuerpos con propiedades antivirales fuertemente neutralizantes, existe la preocupación de que la infección avanzada que conduce a la producción humoral de altos niveles de anticuerpos no neutralizantes dirigidos al sitio de unión de CD4 de gp120 se asocie con una progresión más rápida de la enfermedad a SIDA.
Competencia
La proteína gp120 es necesaria durante la unión inicial del VIH a su célula diana. En consecuencia, cualquier cosa que se una a gp120 o sus objetivos puede bloquear físicamente la unión de gp120 a una célula. Solo uno de estos agentes, Maraviroc , que se une al correceptor CCR5, está actualmente autorizado y en uso clínico. Ningún agente que se dirija al primer socio de interacción celular principal de gp120, CD4 , está actualmente autorizado ya que interferir con una molécula tan central del sistema inmunológico puede causar efectos secundarios tóxicos, como el anticuerpo monoclonal anti-CD4 OKT4 . Apuntar a gp120 en sí ha demostrado ser extremadamente difícil debido a su alto grado de variabilidad y blindaje. Fostemsavir (BMS-663068) es un profármaco de metilfosfato del inhibidor de molécula pequeña BMS-626529, que evita la entrada viral al unirse a la envoltura viral gp120 e interferir con la unión del virus al receptor CD4 del huésped.
Demencia por VIH
La proteína viral del VIH gp120 induce la apoptosis de las células neuronales al inhibir los niveles de furina y el activador del plasminógeno tisular, enzimas responsables de convertir pBDNF en mBDNF. gp120 induce proteínas de muerte mitocondrial como las caspasas que pueden influir en la regulación positiva del receptor de muerte Fas que conduce a la apoptosis de las células neuronales, gp120 induce estrés oxidativo en las células neuronales y también se sabe que activa STAT1 e induce interleucinas IL-6 e IL -8 secreción en células neuronales.
Ver también
- Gen de la envoltura del VIH
- Entrada del VIH a la celda
- gp41
- CD4
- CCR5
- Inhibidor de entrada
- Estructura y genoma del VIH
Referencias
Otras lecturas
- Glicoproteína 120 del virus de la inmunodeficiencia humana
- Vashistha H, Husain M, Kumar D, Singhal PC (2009). "La expresión de gp120 de VIH-1 de células tubulares induce la activación de la caspasa 8 y la apoptosis". Ren Fail . 31 (4): 303–12. doi : 10.1080 / 08860220902780101 . PMID 19462280 . S2CID 205593494 .
enlaces externos
- https://web.archive.org/web/20060219135317/http://www.aidsmap.com/en/docs/4406022B-85D7-4A9B-B700-91336CBB6B18.asp
- http://www.mcld.co.uk/hiv/?q=gp120
- http://www.ebi.ac.uk/interpro/IEntry?ac=IPR000777
- Vashistha, H .; Husain, M .; Kumar, D .; Singhal, PC (2009). "La expresión de gp120 del VIH-1 de la célula tubular induce la activación y la apoptosis de la caspasa 8". Insuficiencia renal . 31 (4): 303–312. doi : 10.1080 / 08860220902780101 . PMID 19462280 . S2CID 205593494 .