Apoptosoma - Apoptosome
El apoptosoma es una gran estructura de proteína cuaternaria formada en el proceso de apoptosis . Su formación se desencadena por la liberación de citocromo c de las mitocondrias en respuesta a un estímulo de muerte celular interno (intrínseco) o externo (extrínseco). Los estímulos pueden variar desde daño al ADN e infección viral hasta señales de desarrollo como las que conducen a la degradación de la cola de un renacuajo .
En las células de mamíferos, una vez que se libera el citocromo c , se une a la proteína citosólica Apaf-1 para facilitar la formación de un apoptosoma. Un estudio bioquímico temprano sugiere una proporción de dos a uno de citocromo c a apaf-1 para la formación de apoptosomas. Sin embargo, estudios estructurales recientes sugieren que la proporción de citocromo c a apaf-1 es de uno a uno. También se ha demostrado que el nucleótido dATP como tercer componente se une a apaf-1, sin embargo, su función exacta aún se debate. El apoptosoma de mamífero nunca se había cristalizado, pero en 2002 se obtuvieron imágenes de un apoptosoma de APAF-1 / citocromo-c humano a una resolución más baja (2 nm ) mediante microscopía electrónica de transmisión criogénica , revelando una partícula heptamérica en forma de rueda con simetría de 7 veces. Recientemente, una estructura de resolución media (9,5 Ångström) del apoptosoma humano también se resolvió mediante microscopía crioelectrónica, que permite una inferencia inequívoca de las posiciones de todos los dominios APAF-1 (CARD, NBARC y WD40) y el citocromo c. También existe ahora una estructura cristalina de la subunidad monomérica inactiva Apaf-1 (PDB 3SFZ).
Una vez formado, el apoptosoma puede reclutar y activar la pro-caspasa-9 inactiva . Una vez activada, esta caspasa iniciadora puede activar las caspasas efectoras y desencadenar una cascada de eventos que conducen a la apoptosis.
Historia
El término apoptosoma se introdujo por primera vez en el artículo de 1998 de Yoshihide Tsujimoto "Papel de las proteínas de la familia Bcl-2 en la apoptosis : ¿apoptosomas o mitocondrias ?". Sin embargo, el Apoptosoma se conocía antes de este tiempo como un complejo ternario . Este complejo involucró a caspasa-9 y Bcl-XL, cada uno de los cuales se unió a un dominio Apaf-1 específico . Se creía entonces que la formación de este complejo desempeñaba un papel regulador en la muerte de células de mamíferos . En diciembre del mismo año, se publicó otro artículo en The Journal of Biological Chemistry que indica que Apaf-1 es el regulador de la apoptosis, a través de la activación de la procaspasa-9.
Los criterios para un apoptosoma se establecieron en 1999. En primer lugar, debe ser un complejo grande (más de 1,3 millones de Dalton). En segundo lugar, su formación requiere la hidrólisis de un enlace de alta energía de ATP o dATP. Y por último debe activar la procaspasa-9 en su forma funcional. La formación de este complejo es el punto de no retorno y se producirá la apoptosis. El APAF-1 estable y el complejo mutimérico de citocromo se ajustan a esta descripción y ahora se denomina apoptosoma.
Se pensó que el apoptosoma era un complejo mutimérico por dos razones. En primer lugar, acercar varias moléculas de procaspasa-9 para la escisión. Y en segundo lugar, para elevar el umbral de apoptosis, por lo tanto, la fuga inespecífica de citocromo c no daría lugar a apoptosis.
Una vez que se estableció el apoptosoma como activador de la procaspasa-9, las mutaciones dentro de esta vía se convirtieron en un área de investigación importante. Algunos ejemplos incluyen células de leucemia humana , cáncer de ovario e infecciones virales . Las áreas de investigación actuales para esta vía se discutirán con más detalle. También existen rutas ocultas para la muerte celular, que son independientes de APAF-1 y, por lo tanto, del apoptosoma. Estas rutas también son independientes de la caspasa-3 y 9. Estas rutas ocultas para la apoptosis son más lentas, pero pueden resultar útiles con más investigaciones.
Estructura
El apoptosoma es un complejo holoenzimático multimolecular ensamblado alrededor de la proteína adaptadora Apaf1 (factor activador de proteasa apoptótica 1) tras la apoptosis mediada por mitocondrias que debe ser estimulada por algún tipo de señal de estrés. La formación del apoptosoma requiere la presencia de ATP / dATP y citocromo c en el citosol . Un estímulo de estrés puede desencadenar la liberación de citocromo c en el citoplasma que luego se unirá al extremo C de Apaf-1 dentro de una región que contiene múltiples repeticiones de WD-40. La oligomerización de Apaf-1 parece ir acompañada de un reclutamiento sincronizado de procaspasa-9 al motivo CARD en el extremo N de Apaf-1 . El apoptosoma desencadena la activación de caspasas en la vía intrínseca de la apoptosis .
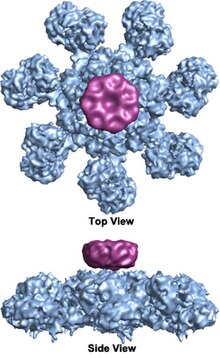
El complejo heptamérico en forma de rueda con estructura de simetría séptuple del apoptosoma se reveló por primera vez con una resolución de 27 Å mediante técnicas de criomicroscopía electrónica y tiene una masa calculada de aproximadamente 1 MDa (Acehan et al. 2002). Esta partícula en forma de rueda tiene siete radios y un cubo central. La región distal del radio tiene una forma de Y pronunciada. El dominio del concentrador está conectado al dominio Y mediante un brazo doblado. Cada dominio Y comprende dos lóbulos (uno grande y uno pequeño) entre los cuales se encuentran los sitios de unión del citocromo c. Debido a que la resolución de la estructura del apoptosoma era relativamente baja, se propusieron dos modelos controvertidos para el ensamblaje del apoptosoma. Un modelo sugiere que los dominios NOD forman el eje central y los dominios CARD forman un anillo más libre en la parte superior de la región NOD. Otro modelo propone que Apaf-1 está organizado de forma extendida de manera que tanto la CARD N-terminal como la región de unión de nucleótidos forman el eje central del apoptosoma, mientras que las 13 repeticiones WD-40 constituyen los dos lóbulos. El lóbulo grande está formado por siete repeticiones y el lóbulo pequeño está formado por seis repeticiones. Cada molécula de caspasa-9 se une a un dominio CARD en el eje central, formando una estructura en forma de cúpula. Esta controversia ha sido resuelta por una estructura reciente de alta resolución del complejo CARD apoptosoma-procaspasa-9 humano. Esta estructura demostró claramente que solo las regiones NOD forman el eje central del apoptosoma (ver imágenes), mientras que CARD está vinculado de manera flexible a la plataforma del apoptosoma y se desordena en el apoptosoma del estado fundamental. Una vez que el apoptosoma se une a la procaspasa-9, las TARJETAS Apaf-1 y las TARJETAS procaspasa-9 forman una estructura flexible en forma de disco que se ubica sobre la plataforma. También se ha demostrado que el número de repeticiones de WD-40 es 15 en lugar de 13, y está compuesto por una hélice beta de 7 palas y una hélice beta de 8 palas.
La evidencia de Wang y sus colegas indica que la relación estequiométrica de procaspasa-9 a Apaf-1 dentro del complejo es de aproximadamente 1: 1. Esto se demostró además mediante análisis cuantitativo de espectrometría de masas. Se demuestra que la estequiometría del citocromo c para Apaf-1 dentro del complejo es 1: 1. Hay algunos debates sobre si se requiere la incorporación estable del citocromo c en el apoptosoma después de la oligomerización, pero datos estructurales recientes favorecen la idea de que el citocromo c estabiliza el apoptosoma oligomérico humano. Sin embargo, el citocromo c puede no ser necesario para el ensamblaje del apoptosoma en especies que no son mamíferos, como gusanos y moscas de la fruta. Además, se ha informado que varias otras moléculas, más notablemente caspasa-3, se co-purifican con el apoptosoma y se ha demostrado que la caspasa-3 es capaz de unirse al complejo apoptosoma-procaspasa-9.
Apaf-1 forma la columna vertebral del apoptosoma. Tiene tres regiones distintas: el dominio de reclutamiento de caspasa N-terminal (CARD, residuos 1-90), una región central de oligomerización y unión de nucleótidos (NB-ARC / NOD, 128-586) y una región C-terminal WD40 ( 613-1248) que componen una proteína de aproximadamente 140 KDa.
- El dominio CARD de Apaf-1 interactúa con la procaspasa-9 y participa en el reclutamiento dentro del apoptosoma.
- La región NB-ARC / NOD exhibe una similitud de secuencia significativa con la proteína C. elegans Ced-4.
- La región C-terminal WD40 de Apaf1 contiene 15 repeticiones WD-40 estructuradas en dos dominios en forma de hélice b. Las repeticiones de WD-40 son secuencias de alrededor de 40 aminoácidos de longitud que terminan en Trp-Asp y generalmente están involucradas en la interacción proteína-proteína.
Un enlazador corto y dominios a / b de unión a nucleótidos (NBD) que contienen cajas Walker conservadas A (p-loop 155-161) y B (239-243) siguen al dominio CARD N-terminal. Las cajas Walker A / B son críticas para la unión de dATP / ATP y Mg2 +. Después del NBD hay un pequeño dominio helicoidal (HD1), un segundo enlazador y un dominio de hélice alada conservado (WHD). La región NOD comprende NBD, HD1 y WHD, creando un dominio ATPasa que es parte de la familia AAA + de ATPasas . Hay un dominio súper helicoidal (HD2) presente en la unión entre las repeticiones NOD y WD-40. Las repeticiones WD40 están en grupos de ocho y siete con enlazadores que las conectan.
Apoptosomas en otros organismos
Las descripciones anteriores son para el apoptosoma humano. Las estructuras complejas de apoptosomas de otros organismos tienen muchas similitudes, pero son de tamaños y números de subunidades bastante diferentes, como se muestra en la figura. El sistema de la mosca de la fruta, llamado Dark, tiene un anillo de 8 subunidades (PDB 4V4L). El apoptosoma del nematodo, llamado CED-4, es octamérico pero mucho más pequeño (PDB 3LQQ) y no incluye las regiones que se unirían al citocromo C.
Mecanismo de acción
Iniciación
El inicio de la acción del apoptosoma se corresponde con los primeros pasos en la vía de la muerte celular programada (PCD) . En los animales, la apoptosis puede catalizarse de dos formas; la vía extrínseca implica la unión de ligandos extracelulares a receptores transmembrana, mientras que la vía intrínseca tiene lugar en las mitocondrias . Esta vía intrínseca implica la liberación de citocromo C de las mitocondrias y la posterior unión a la proteína citosólica Apaf-1 . Por tanto, la liberación del citocromo c es necesaria para el inicio de la acción del apoptosoma; esta liberación está regulada de varias formas, la más importante mediante la detección de los niveles de iones de calcio .
Liberación de citocromo c
Se propone que la liberación del citocromo c tenga lugar de dos formas. En primer lugar, el poro de transición de permeabilidad (PTP) cuando la mitocondria recibe una señal que induce la muerte y libera proteínas del espacio intermembrana (12). El PTP está compuesto por el canal aniónico dependiente de voltaje (VDAC), el translocador de nucleótidos de adenina de proteína de membrana interna (AdNT) y la proteína de matriz ciclofilina D (CyD) (12). Este poro hace que las mitocondrias se hinchen y la membrana mitocondrial externa se rompa (Diamond & McCabe, 2007). Con este cambio en la permeabilidad , proteínas como el citocromo c se liberan en el citosol (12). Este cambio probablemente causa la transición de la permeabilidad mitocondrial (MPT), donde el potencial transmembrana mitocondrial colapsa y cesa la producción de ATP (12). La inhibición de este método por el agente farmacéutico ciclosporina A (CsA), condujo al descubrimiento de la segunda vía (13). El segundo método de liberación del citocromo c es independiente del PTP e involucra solo al VDAC. Los miembros de la familia Bcl-2 de proteínas proapoptóticas pueden inducir la apertura del VDAC (12). Esto provocará la misma liberación de proteínas del espacio intermembrana, incluido el citocromo c, y el subsiguiente MPT (12).
Apaf-1
una. Ausencia de citocromo c
En ausencia del citocromo c, Apaf-1 existe en su forma monomérica ; se cree que el dominio WD-40 permanece plegado sobre la proteína, manteniendo Apaf-1 en un estado autoinhibido . Además, varias áreas están tan unidas que la proteína no puede unirse a ninguna otra cosa. Se ha determinado mediante espectrometría de masas que en el estado autoinhibido o "bloqueado", el ADP está unido al dominio ATPasa de Apaf-1. En este estado, esta proteína es singular e incapaz de activar caspasas .
B. Presencia de citocromo c
El citocromo c se une al dominio WD-40 de Apaf-1. Esto permite que se libere el "bloqueo", lo que significa que este dominio ya no está autoinhibido. Sin embargo, los dominios CARD y NB-ARC permanecen en estado autoinhibido. El dominio CARD solo se liberará de este bloqueo cuando Apaf-1 esté vinculado a (d) ATP / ATP; cuando ATP se une, entonces se permitirá que el dominio CARD se una a Caspase-9. Cuando el ADP está en el dominio ATPasa, se inhibe la oligomerización. Por tanto, la unión de ATP también permite la oligomerización de Apaf-1 en la estructura heptagonal necesaria para la activación de caspasa corriente abajo. Las mutaciones en el dominio ATPasa hacen que la proteína sea inactiva; sin embargo, el método para controlar este intercambio de ADP-ATP no está claro. Por lo tanto, la oligomerización solo puede ocurrir en presencia de 7 moléculas de citocromo c, 7 proteínas Apaf-1 y suficiente (d) ATP / ATP. El dominio ATPasa pertenece a la familia AAA + de ATPasas ; esta familia es conocida por su capacidad para unirse a otros dominios ATPasa y formar hexa- o heptámeros. El apoptosoma se considera activo cuando hay siete moléculas de Apaf-1 dispuestas en una estructura de rueda, orientadas de manera que los dominios NB-ARC descansan en el centro.
Acción activa del apoptosoma
Este apoptosoma funcional puede entonces proporcionar una plataforma de activación de la caspasa 9. La caspasa 9 existe como un cimógeno en el citosol y se cree que se encuentra a 20 nM en las células. Aunque se sabe que el zimógeno no necesita ser escindido para volverse activo, la actividad de la procaspasa-9 puede aumentar significativamente una vez escindido. La primera hipótesis es que el apoptosoma proporciona una ubicación para la dimerización de dos moléculas de caspasa 9 antes de la escisión; esta hipótesis fue favorecida por Reidl & Salvasen en 2007. La segunda es que la escisión tiene lugar mientras la caspasa 9 todavía está en su forma monomérica. En cada caso, la activación de la caspasa 9 conduce a la activación de una cascada de caspasa completa y la posterior muerte celular. Se ha sugerido que la razón evolutiva del complejo proteico multimérico que activa la cascada de caspasas es asegurar que cantidades traza de citocromo c no causen apoptosis accidentalmente.
Áreas de investigación
¿Qué sucede cuando ocurren las mutaciones?
Si bien la apoptosis es necesaria para la función natural del cuerpo, las mutaciones de la vía del apoptosoma provocan efectos catastróficos y cambios en el cuerpo. Las mutaciones de la vía celular pueden promover la muerte celular o impedir la muerte celular creando una gran cantidad de enfermedades en el cuerpo. Las vías de apoptosis mutadas que causan enfermedades son abundantes y tienen una amplia gama desde cáncer, debido a la falta de actividad apoptosómica, enfermedad de Alzheimer debido a demasiada actividad apoptosómica y muchas otras enfermedades neurodegenerativas como la enfermedad de Parkinson y la enfermedad de Huntington . Las enfermedades neurodegenerativas como el Alzheimer, el Parkinson y el Huntington son todas enfermedades relacionadas con la edad e implican un aumento de la apoptosis donde mueren las células que aún pueden funcionar o que contribuyen a mantener la función del tejido. Apaf-1-ALT es un mutante de Apaf-1 que se encuentra en el cáncer de próstata, que no tiene residuos 339-1248. Estudios estructurales recientes del apoptosoma demuestran que Apaf-1-ALT no puede formar apoptosoma ya que pierde componentes estructurales clave para el ensamblaje.
Represión de la apoptosis que causa cáncer
Las anomalías genéticas y bioquímicas dentro de una célula normalmente desencadenan la muerte celular programada para librar al cuerpo de la función y el desarrollo celular irregular; sin embargo, las células cancerosas han adquirido mutaciones que les permiten reprimir la apoptosis y sobrevivir. Se han desarrollado quimioterapias como la radiación ionizante para activar estas vías de PCD reprimidas mediante hiperestimulación para promover la PCD normal.
Mutaciones de P53 en apoptosis
P53 funciona como un supresor de tumores que participa en la prevención del cáncer y se produce de forma natural en las vías apoptóticas. P53 hace que las células entren en apoptosis e interrumpan una mayor división celular, lo que evita que la célula se vuelva cancerosa (16). En la mayoría de los cánceres, es la vía p53 la que se ha mutado, lo que da como resultado la falta de capacidad para acabar con las células disfuncionales. La función de P53 también puede ser responsable de un período de vida limitado en el que las mutaciones del gen p53 provocan la expresión de formas dominantes negativas que producen animales de larga vida. Por ejemplo, en un experimento con C. elegans , se descubrió que el aumento de la vida útil de los mutantes p53 dependía del aumento de la autofagia. En otro experimento que utilizó Drosophilia, la mutación p53 tuvo efectos tanto positivos como negativos en la vida adulta, lo que concluyó que existía un vínculo entre la diferenciación sexual, la PCD y el envejecimiento. Determinar cómo la p53 está afectando la duración de la vida será un área importante para futuras investigaciones.
Dirigirse al apoptosoma para la terapia del cáncer
La inhibición de la apoptosis es una de las características clave del cáncer, por lo que encontrar formas de manipular y superar esta inhibición para formar el apoptosoma y activar las caspasas es importante en el desarrollo de nuevos tratamientos contra el cáncer. La capacidad de causar directamente la activación del apoptosoma es valiosa en las terapias contra el cáncer porque los genes cancerosos infectados no pueden destruirse, lo que provoca la formación de una continuación del cáncer. Al activar el apoptosoma mediante un estímulo externo, puede producirse la apoptosis y deshacerse de las células mutadas. Actualmente se están siguiendo numerosos enfoques para lograr esto, que incluyen biomoléculas recombinantes, estrategias antisentido, terapia génica y química combinatoria orgánica clásica para apuntar a reguladores apoptóticos específicos en el enfoque para corregir la muerte celular excesiva o deficiente en enfermedades humanas.
En general, la regulación positiva de las proteínas antiapoptóticas conduce a la prevención de la apoptosis que puede resolverse mediante inhibidores y la regulación negativa de las proteínas antiapoptóticas conduce a la inducción de la apoptosis, que es revertida por activadores que son capaces de unirse y modificar su actividad. Una molécula diana importante en las terapias basadas en la apoptosis es Bcl-2 para el diseño de fármacos. Bcl-2 fue el primer oncogén que se encontró que causaba apoptosis inhibidora del cáncer. Se sobreexpresa en tumores y es resistente a la quimioterapia. Los científicos han descubierto que la unión de los depresores a las proteínas antiapoptóticas Bcl-2 las inhibe y deja libres a los activadores directos para interactuar con Bax y Bak .
Otra molécula dirigida para la terapia del cáncer involucra a la familia de las caspasas y sus reguladores. La inhibición de la actividad de la caspasa bloquea la muerte celular en enfermedades humanas, incluidos trastornos neurodegenerativos, accidente cerebrovascular, ataque cardíaco y daño hepático. Por lo tanto, los inhibidores de caspasa son una herramienta farmacológica prometedora que proporciona tratamientos para el accidente cerebrovascular y otras enfermedades humanas. Hay varios inhibidores de caspasa que se encuentran actualmente en la etapa preclínica que han mostrado pruebas prometedoras de los efectos revertidos de algunas enfermedades neurodegenerativas. En un estudio reciente, los investigadores desarrollaron un inhibidor de caspasa-3 reversible llamado M-826 y lo probaron en un modelo de ratón donde bloqueó el daño del tejido cerebral. Además, se probó en un ratón con enfermedad de Huntington y el inhibidor previno la muerte de las neuronas estriadas, revelando efectos prometedores para un estudio adicional de este inhibidor de caspasa.
El complejo de apoptosomas ha revelado nuevos objetivos potenciales para la terapia molecular
La formación del apoptosoma Apaf1 / caspasa-9 es un evento crucial en la cascada apoptótica. La identificación de nuevos fármacos potenciales que prevengan o estabilicen la formación del complejo apoptosómico activo es la estrategia ideal para el tratamiento de enfermedades caracterizadas por apoptosis excesiva o insuficiente. Recientemente, se ha descubierto que la taurina previene la apoptosis inducida por isquemia en cardiomiocitos a través de su capacidad para inhibir la formación del apoptosoma Apaf1 / caspasa-9 sin prevenir la disfunción mitocondrial. Se identificó que el posible mecanismo por el cual la taurina inhibe la formación del apoptosoma es capaz de reducir la expresión de caspasa-9, un componente fundamental del apoptosoma. Sin embargo, hay estudios que muestran que Aparf1 y caspasa-9 tienen roles independientes además del apoptosoma, por lo que alterar sus niveles también podría alterar la función celular. Entonces, a pesar de los datos experimentales alentadores, varios problemas siguen sin resolverse y limitan el uso de fármacos experimentales en la práctica clínica.
El descubrimiento de inhibidores de apoptosoma proporcionará una nueva herramienta terapéutica para el tratamiento de enfermedades mediadas por apoptosis. De particular importancia son los nuevos compuestos capaces de inhibir la estabilidad y la actividad del apoptosoma, actuando sobre las interacciones proteína-proteína intracelulares sin alterar los niveles transcripcionales de los componentes del apoptosoma. Los estudios estructurales recientes del apoptosoma pueden proporcionar herramientas valiosas para diseñar terapias basadas en apoptosoma.