Antraciclina - Anthracycline
Las antraciclinas son una clase de medicamentos utilizados en la quimioterapia contra el cáncer que se extraen de la bacteria Streptomyces . Estos compuestos se usan para tratar muchos cánceres, incluidos leucemias , linfomas , cáncer de mama , estómago , útero , ovario , vejiga y pulmón . La primera antraciclina descubierta fue la daunorrubicina (nombre comercial Daunomycin), que es producida naturalmente por Streptomyces peucetius , una especie de actinobacterias . Clínicamente, las antraciclinas más importantes son la doxorrubicina , la daunorrubicina , la epirrubicina y la idarrubicina .
Las antraciclinas se encuentran entre los tratamientos contra el cáncer más eficaces jamás desarrollados y son eficaces contra más tipos de cáncer que cualquier otra clase de agentes quimioterapéuticos. Su principal efecto adverso es la cardiotoxicidad , que limita considerablemente su utilidad. También se ha demostrado que el uso de antraciclinas está asociado significativamente con la neutropenia febril o grave del ciclo 1 . Otros efectos adversos incluyen vómitos.
Los fármacos actúan principalmente intercalando con el ADN e interfiriendo con el metabolismo del ADN y la producción de ARN. La citotoxicidad se debe principalmente a la inhibición de la topoisomerasa II después de que la enzima induce una ruptura en el ADN, lo que evita la re ligadura de la ruptura y conduce a la muerte celular. La estructura básica de las antraciclinas es la de una molécula tetracíclica con un esqueleto de antraquinona conectado a un resto de azúcar por un enlace glicosídico. Cuando es absorbida por una célula, la estructura de cuatro anillos se intercala entre los pares de bases de ADN, mientras que el azúcar se encuentra dentro del surco menor e interactúa con los pares de bases adyacentes.
Historia
La daunorrubicina es un fármaco de pigmentación roja que se descubrió a principios de la década de 1960. Fue aislado de una cepa de Streptomyces peucetius por Di Marco y compañeros de trabajo, que trabajaban para Farmitalia Research Laboratories en Italia, que lo llamaron daunomicina. Aproximadamente al mismo tiempo, Dubost y sus compañeros de trabajo en Francia también descubrieron el compuesto y lo llamaron rubidomicina. Se adoptó la daunorrubicina como nombre internacional. Inicialmente se observó que tenía actividad contra los tumores murinos y luego en los ensayos clínicos se encontró que era activo contra la leucemia y los linfomas .
La doxorrubicina se aisló de una variante mutada de S. peucetius (var. Caesius ). Se diferencia de la daunorrubicina solo por la adición de un grupo hidroxilo en la posición del carbono 14. Esta modificación cambia en gran medida la actividad del fármaco, haciéndolo muy eficaz contra una amplia gama de tumores sólidos, leucemias y linfomas. Es el estándar por el cual se juzgan las nuevas antraciclinas.
Las primeras antraciclinas tuvieron tanto éxito que se han producido miles de análogos en un intento por encontrar compuestos con aplicaciones terapéuticas mejoradas. Solo la epirrubicina y la idarrubicina se han adoptado para su uso en todo el mundo. La epirrubicina tiene una actividad similar a la doxorrubicina, sin embargo, ha reducido los efectos secundarios cardiotóxicos. La idarubicina es una variante liposoluble de la daunorrubicina y está biodisponible por vía oral.
Varios grupos de investigadores se centraron en diseñar compuestos que retuvieran el cromóforo aromático policíclico de las antraciclinas (favoreciendo la intercalación en el ADN) y sustituyendo el residuo de azúcar por cadenas laterales simples. Esto condujo a la identificación de la mitoxantrona, que se clasifica como un compuesto de antracenodiona y se utiliza en la clínica para el tratamiento de varios cánceres. Se ha demostrado que los análogos de disacáridos retienen la actividad anticancerosa y se están investigando más con respecto a su mecanismo de acción.
Aunque han pasado 50 años desde el descubrimiento de las antraciclinas, y a pesar de los avances recientes en el desarrollo de terapias dirigidas para el cáncer, alrededor del 32% de los pacientes con cáncer de mama, el 57% -70% de los pacientes con linfoma de edad avanzada y el 50-60% de los pacientes con cáncer infantil los pacientes son tratados con antraciclinas. Algunos cánceres se benefician de los regímenes neoadyuvantes basados en antraciclinas, y estos incluyen cánceres de mama triple negativos que no responden bien a las terapias dirigidas debido a la falta de receptores disponibles que puedan ser dirigidos. En comparación con las pacientes con cáncer de mama no triple negativo, las pacientes con cáncer de mama triple negativo han mostrado una mejor tasa de respuesta y una mayor tasa de respuesta patológica con el uso de antraciclinas, un indicador utilizado para predecir mejores resultados a largo plazo.
Ensayos clínicos
Las antraciclinas siguen siendo algunos de los agentes quimioterapéuticos más utilizados, pero su potencial está limitado por sus efectos tóxicos limitantes de la dosis. Actualmente, se están realizando muchos estudios en la búsqueda de antraciclinas con mejor eficacia antitumoral o con efectos secundarios reducidos utilizando diferentes sistemas de administración de fármacos basados en nanotecnología.
Mecanismo de acción

Las antraciclinas han sido ampliamente estudiadas por sus interacciones con los componentes celulares y su impacto en los procesos celulares. Esto incluye estudios en células cultivadas y en sistemas animales completos. En la literatura científica se ha documentado una miríada de interacciones fármaco-celular y estas varían con respecto a las propiedades de las células diana, la dosis del fármaco y los productos intermedios del fármaco producidos. Dado que se pueden observar mecanismos de acción artefactos, los siguientes mecanismos que ocurren a concentraciones de fármaco clínicamente relevantes son los más importantes.
Intercalación de ADN
Las células absorben fácilmente las antraciclinas y se localizan en el núcleo . El resto cromóforo de las antraciclinas tiene una función de intercalación y se inserta entre el par de bases adyacentes de ADN. La función de intercalación inhibe la síntesis de ADN y ARN en células de alta replicación, bloqueando posteriormente los procesos de transcripción y replicación.
Veneno de topoisomerasa II
Este es, con mucho, el mecanismo más aceptado para explicar la acción de las antraciclinas, ya que la toxicidad mediada por la topoisomerasa II es evidente a concentraciones de fármaco clínicamente relevantes. La topoisomerasa-II es una enzima que crea roturas temporales de ADN de doble hebra (dsDNA) y las vuelve a sellar después de controlar la torsión de las superenrollamientos de ADN . Las antraciclinas, intercaladas en el ADN, forman un complejo ternario estable de antraciclina-ADN-topoisomerasa II, "envenenando" la enzima e impidiendo la religación de las roturas del ADN de doble hebra. Este daño del ADN mediado por la topoisomerasa-II posteriormente promueve la detención del crecimiento y recluta la maquinaria de reparación del ADN. Cuando falla el proceso de reparación, las lesiones inician la muerte celular programada .
Especies de oxígeno reactivas
El resto quinona de las antraciclinas puede sufrir reacciones redox para generar un exceso de especies reactivas de oxígeno (ROS) en presencia de enzimas oxidorreductoras como la citocromo P450 reductasa , NADH deshidrogenasa y xantina oxidasa . La conversión de quinona en semiquinona produce radicales libres que reaccionan activamente con el oxígeno para generar superóxidos , radicales hidroxilo y peróxidos. Además, la disponibilidad de hierro celular cataliza reacciones redox y genera ROS. El exceso de ROS que no se puede desintoxicar da como resultado estrés oxidativo, daño del ADN y peroxidación de lípidos, lo que desencadena la apoptosis.
Formación de aductos de ADN
Las antraciclinas también pueden formar aductos con el ADN mediante un enlace covalente simple a través de un enlace aminal del amino 3 'de la daunosamina al amino exocíclico de la guanina. El suministro de formaldehído extracelular utilizando profármacos liberadores de formaldehído puede promover la formación de aductos de ADN covalente. Se ha demostrado que tales aductos bloquean factores de transcripción específicos de GpC e inducen respuestas apoptóticas.
Implicaciones clínicas
Los resultados de un metanálisis reciente proporcionan evidencia de que los pacientes con cáncer de mama con duplicación del centrómero 17 o aberraciones en TOP2A , el gen que codifica la topoisomerasa-IIα, se benefician de la quimioterapia adyuvante que incorpora antraciclinas. Esto no incluye subgrupos de pacientes que albergan amplificación de HER2. Las observaciones de este estudio también permiten identificar a los pacientes en los que las antraciclinas podrían omitirse de forma segura en las estrategias de tratamiento.
Efectos secundarios
La administración de antraciclinas a menudo va acompañada de reacciones adversas a los medicamentos que limitan el uso de antraciclinas en las clínicas. Dos de las principales toxicidades de las antraciclinas que limitan la dosis son la mielosupresión y la cardiotoxicidad . Afortunadamente, la introducción de citocinas terapéuticas permite el manejo de la mielosupresión. Por lo tanto, la lesión cardíaca sigue siendo el principal inconveniente de los agentes anticancerosos basados en antraciclinas.
La cardiotoxicidad mediada por antraciclinas es dosis-dependiente y acumulativa, y el daño impuesto al corazón ocurre con la primera dosis y luego se acumula con cada ciclo de antraciclina. Se han descrito cuatro tipos de cardiotoxicidad asociada a antraciclinas.
| Tipos de cardiotoxicidad | Hora de la presentación | Síntomas |
|---|---|---|
| Agudo | Durante e inmediatamente después de la administración del fármaco | Vasodilatación, hipotensión, alteraciones transitorias del ritmo cardíaco |
| Subcrónico | 1-3 días después de la administración del fármaco | Pericarditis-miocarditis |
| Crónica temprana | Menos de 1 año después de completar el tratamiento con antraciclinas | Miocardiopatía dilatada, miocardiopatía restrictiva (poco común), disfunción contráctil del ventrículo izquierdo, insuficiencia cardíaca congestiva |
| Crónico de aparición tardía / tardía | Más de 1 año después de completar el tratamiento con antraciclinas | Miocardiopatía restrictiva, miocardiopatía dilatada, insuficiencia cardíaca congestiva |
En la clínica, se establece una dosis acumulativa máxima recomendada de antraciclinas para prevenir el desarrollo de insuficiencia cardíaca congestiva . A modo de ejemplo, la incidencia de insuficiencia cardíaca congestiva es del 4,7%, 26% y 48% respectivamente cuando los pacientes recibieron doxorrubicina a 400 mg / m 2 , 550 mg / m 2 y 700 mg / m 2 . Por lo tanto, la exposición acumulada de por vida a la doxorrubicina se limita a 400-450 mg / m 2 para reducir la incidencia de insuficiencia cardíaca congestiva a menos del 5%, aunque existe variación en términos de tolerancia a la doxorrubicina entre individuos. Los factores de riesgo que influyen en la extensión de la lesión cardíaca causada por las antraciclinas incluyen la variabilidad genética, la edad (grupos de edad baja o alta), tratamientos previos con medicamentos cardiotóxicos y antecedentes de enfermedades cardíacas. Los niños corren un riesgo especial debido a la actividad de las antraciclinas que puede comprometer el desarrollo del corazón inmaduro.
La lesión cardíaca que ocurre en respuesta a dosis iniciales de antraciclina puede detectarse por un aumento en el nivel de troponina inmediatamente después de la administración. La biopsia también permite la detección temprana de una lesión cardíaca mediante la evaluación de los cambios en la ultraestructura cardíaca. Recibir dosis acumuladas de antraciclina causa disfunción del ventrículo izquierdo y, con la dosis continuada, alcanza un cierto umbral que puede detectarse clínicamente mediante técnicas no invasivas como la ecocardiografía 2D y las imágenes de frecuencia de deformación . Los avances en el desarrollo de técnicas de imagen y biomarcadores más sensibles permiten la detección temprana de la cardiotoxicidad y permiten la intervención cardioprotectora para prevenir la cardiotoxicidad mediada por antraciclinas.
La susceptibilidad predominante del corazón a las antraciclinas se debe en parte a una localización mitocondrial preferencial de las antraciclinas. Esto se atribuye a la interacción de alta afinidad entre las antraciclinas y la cardiolipina, un fosfolípido presente en la membrana mitocondrial del corazón, ya que el tejido cardíaco contiene un número relativamente alto de mitocondrias por célula. El tejido cardíaco también tiene una defensa deteriorada contra el estrés oxidativo, mostrando un bajo nivel de enzimas antioxidantes como la catalasa y la superóxido dismutasa para desintoxicar las ROS mediadas por antraciclinas.
Los mecanismos que explican el daño cardíaco inducido por antraciclinas son complejos e interrelacionados. Primero se reconoció que estaba relacionado con el estrés oxidativo inducido por las antraciclinas. Ha surgido una explicación más reciente, en la que la cardiotoxicidad mediada por antraciclina se debe a la intoxicación por antraciclina-topoisomerasa IIb, lo que conduce a un estrés oxidativo posterior.
Para reducir el impacto de la lesión cardíaca en respuesta a las antraciclinas, se han explorado algunas estrategias cardioprotectoras. Se han desarrollado y utilizado formulaciones liposomales de antraciclinas (discutidas a continuación) para reducir el daño cardíaco. Otros análogos de antraciclina novedosos como la epirrubicina y la idarrubicina también brindan opciones para reducir los eventos cardíacos adversos; estos análogos no han mostrado una actividad anticancerígena superior a los compuestos parentales. Un método de administración de fármacos alternativo que implica una infusión continua durante 72 h en comparación con la administración en bolo proporciona cierta protección y se puede utilizar cuando se anticipan dosis acumulativas elevadas.
Cuando se administran antraciclinas por vía intravenosa, puede resultar en una extravasación accidental en los lugares de inyección. Se estima que la incidencia de extravasación oscila entre el 0,1% y el 6%. La extravasación causa serias complicaciones a los tejidos circundantes con los síntomas de necrosis tisular y ulceración de la piel. El dexrazoxano se usa principalmente para tratar las antraciclinas después de la extravasación al actuar como inhibidor de la topoisomerasa II y como agente quelante para reducir el estrés oxidativo causado por las antraciclinas. El dexrazoxano también se ha utilizado con éxito como compuesto cardioprotector en combinación con doxorrubicina en pacientes con cáncer de mama metastásico que han sido tratadas con más de 300 mg / m 2 de doxorrubicina, así como en pacientes que se prevé que tendrán un efecto beneficioso debido a un alto nivel acumulativo. dosis de doxorrubicina.
No hay evidencia de alta calidad para confirmar si los tratamientos cardioprotectores son efectivos. Los estudios de la naturaleza cardioprotectora del dexrazoxano proporcionan pruebas de que puede prevenir el daño cardíaco sin interferir con los efectos antitumorales del tratamiento con antraciclinas. Los pacientes que recibieron dexrazoxano con su tratamiento con antraciclinas vieron reducido su riesgo de insuficiencia cardíaca en comparación con los tratados con antraciclinas sin dexrazoxano. Sin embargo, no hubo ningún efecto sobre la supervivencia.
La doxorrubicina radiomarcada se ha utilizado como agente de formación de imágenes de lesiones de cáncer de mama en un estudio piloto. Este radioquímico, 99m Tc-doxorrubicina, se localiza en lesiones tumorales mamarias en pacientes femeninas y es un posible radiofármaco para la obtención de imágenes de tumores de mama.
En algunos casos, las antraciclinas pueden ser ineficaces debido al desarrollo de resistencia a los medicamentos . Puede ser resistencia primaria (respuesta insensible a la terapia inicial) o resistencia adquirida (presente después de demostrar una respuesta completa o parcial al tratamiento). La resistencia a las antraciclinas involucra muchos factores, pero a menudo se relaciona con la sobreexpresión de la proteína de salida de fármaco transmembrana glucoproteína P (P-gp) o la proteína de resistencia a múltiples fármacos 1 ( MRP1 ), que elimina las antraciclinas de las células cancerosas. Se ha centrado un gran esfuerzo de investigación en el diseño de inhibidores contra MRP1 para volver a sensibilizar las células resistentes a las antraciclinas, pero muchos de estos fármacos han fallado durante los ensayos clínicos.
Formulaciones clínicas basadas en liposomas
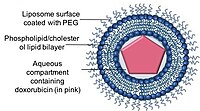
Los liposomas son vesículas de fosfolípidos de forma esférica que pueden formarse con una o más bicapas lipídicas con fosfolípidos o colesteroles. La capacidad de los liposomas para encapsular compuestos de fármacos tanto hidrófobos como hidrófilos permitió que los liposomas fueran sistemas de administración de fármacos eficientes (DDS) para administrar una variedad de fármacos en estos nanoportadores.
Se han desarrollado formulaciones liposomales de antraciclinas para mantener o incluso mejorar la eficacia terapéutica de las antraciclinas al tiempo que reducen sus toxicidades limitantes para los tejidos sanos, particularmente la cardiotoxicidad. Actualmente, hay dos formulaciones liposomales de doxorrubicina disponibles en las clínicas.
Doxil / Caelyx es el primer DDS liposomal aprobado por la FDA, y se usó inicialmente para tratar el sarcoma de Kaposi relacionado con el SIDA en 1995 y ahora se usa para tratar el cáncer de ovario recurrente , el cáncer de mama metastásico con mayor riesgo cardíaco y el mieloma múltiple. La doxorrubicina está encapsulada en un nanoportador conocido como Stealth o liposomas estabilizados estéricamente, que consta de liposomas unilaminares recubiertos con un polímero hidrófilo de polietilenglicol (PEG) que está unido covalentemente a fosfolípidos de liposomas. El recubrimiento de PEG sirve como barrera contra la opsonización , aclaramiento rápido mientras que el fármaco se retiene de forma estable dentro de los nanoportadores a través de un gradiente químico de sulfato de amonio. Una de las principales ventajas del uso de nanoportadores como sistema de administración de fármacos es la capacidad de los nanoportadores de utilizar la vasculatura con fugas de los tumores y su drenaje linfático deteriorado a través del efecto EPR.
La concentración plasmática máxima de doxorrubicina libre después de la administración de Doxil es sustancialmente menor en comparación con la doxorrubicina convencional, lo que explica su bajo perfil de cardiotoxicidad. Sin embargo, Doxil puede causar eritrodisestesia palmo -plantar (EPP, síndrome de manos y pies) debido a su acumulación en la piel. Doxil tiene una dosis máxima tolerable (MTD) más baja a 50 mg / m 2 cada 4 semanas en comparación con la doxorrubicina libre a 60 mg / m 2 cada 3 semanas. A pesar de esto, la dosis máxima acumulada de Doxil es aún mayor en comparación con la doxorrubicina debido a sus características cardioprotectoras.
Myocet es otro complejo de citrato de doxorrubicina encapsulado en liposomas no pegilado aprobado para su uso en combinación con ciclofosfamida en pacientes con cáncer de mama metastásico como tratamiento de primera línea en Europa y Canadá. La doxorrubicina se carga en los liposomas justo antes de la administración a los pacientes con una dosis única máxima de 75 mg / m 2 cada 3 semanas. Myocet tiene una eficacia similar a la doxorrubicina convencional, mientras que reduce significativamente la toxicidad cardíaca.
| Doxil | Myocet | Referencias | |
|---|---|---|---|
| Composición de los liposomas | PEG-fosfolípido
Fosfolípido Colesterol |
Fosfolípido
Colesterol |
|
| Tamaño | 80 nm - 100 nm | 150 nm - 250 nm | |
| Método de carga de fármacos | Gradiente de sal de amonio | Gradiente de ácido cítrico | |
| Farmacocinética | Dosis: dosis única de 10 mg / m 2 - 20 mg / m 2 Concentración plasmática máxima: 7,4 μM - 15,3 μM
Vida media de eliminación: 50,2 h - 54,5 h |
Dosis: dosis única de 60 mg / m 2
Concentración máxima en plasma: 16 μM Vida media de eliminación: 16,4 h |
|
| Indicación clínica | Sarcoma de Kaposi relacionado con el SIDA, cáncer de ovario recurrente y cáncer de mama metastásico | Cáncer de mama metastásico |
Interacciones farmacológicas adversas
Las interacciones farmacológicas con las antraciclinas pueden ser complejas y pueden deberse al efecto, los efectos secundarios o el metabolismo de la antraciclina. Los fármacos que inhiben el citocromo P450 u otras oxidasas pueden reducir el aclaramiento de antraciclinas, prolongando su vida media circulante , lo que puede aumentar la cardiotoxicidad y otros efectos secundarios. Como actúan como antibióticos, las antraciclinas pueden reducir la eficacia de los tratamientos con cultivos vivos, como la terapia con Bacillus Calmette-Guerin para el cáncer de vejiga. Como actúan como mielosupresores, las antraciclinas pueden reducir la eficacia de las vacunas al inhibir el sistema inmunológico.
Varias interacciones son de particular importancia clínica. Aunque el dexrazoxano se puede utilizar para mitigar la cardiotoxicidad o el daño por extravasación de las antraciclinas, también puede reducir su eficacia y la recomendación es no iniciar el tratamiento con dexrazoxano después del tratamiento inicial con antraciclinas. Trastuzumab (un anticuerpo HER2 utilizado para tratar el cáncer de mama) puede aumentar la cardiotoxicidad de las antraciclinas, aunque la interacción puede minimizarse implementando un intervalo de tiempo entre la administración de antraciclina y trastuzumab . Los taxanos (excepto docetaxel) pueden disminuir el metabolismo de las antraciclinas, aumentando las concentraciones séricas de antraciclinas. La recomendación es tratar primero con antraciclinas si se requiere un tratamiento combinado con taxanos.
Ver también
Referencias
![]() Este artículo fue adaptado de la siguiente fuente bajo una licencia CC BY 4.0 ( 2019 ) ( informes de los revisores ):
Alison Cheong; Sean McGrath; Suzanne Cutts (6 de diciembre de 2018). "Antraciclinas". WikiJournal de Medicina . 5 (1): 1. doi : 10.15347 / WJM / 2018.001 . ISSN 2002-4436 . Wikidata Q60638523 .
Este artículo fue adaptado de la siguiente fuente bajo una licencia CC BY 4.0 ( 2019 ) ( informes de los revisores ):
Alison Cheong; Sean McGrath; Suzanne Cutts (6 de diciembre de 2018). "Antraciclinas". WikiJournal de Medicina . 5 (1): 1. doi : 10.15347 / WJM / 2018.001 . ISSN 2002-4436 . Wikidata Q60638523 .
Notas
enlaces externos
-
 Medios relacionados con las antraciclinas en Wikimedia Commons
Medios relacionados con las antraciclinas en Wikimedia Commons