Adenililación - Adenylylation
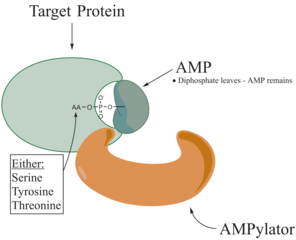
La adenililación , más comúnmente conocida como AMPilación , es un proceso en el que una molécula de monofosfato de adenosina (AMP) se une covalentemente a la cadena lateral de aminoácidos de una proteína . Esta adición covalente de AMP a una cadena lateral de hidroxilo de la proteína es una modificación postraduccional . La adenilación implica un enlace fosfodiéster entre un grupo hidroxilo de la molécula que experimenta la adenilación y el grupo fosfato del nucleótido de monofosfato de adenosina (es decir, ácido adenílico). Las enzimas que son capaces de catalizar este proceso se denominan AMPylators.
Los aminoácidos conocidos a los que se dirige la proteína son la tirosina y la treonina y, a veces, la serina. Cuando las cargas de una proteína experimentan un cambio, afecta las características de la proteína, normalmente alterando su forma a través de interacciones de los aminoácidos que la componen. La AMPilación puede tener varios efectos sobre la proteína. Estas son propiedades de la proteína, estabilidad, actividad enzimática, unión de cofactor y muchas otras capacidades funcionales de una proteína. Otra función de la adenililación es la activación de aminoácidos, que es catalizada por tRNA aminoacil sintetasa. La proteína más comúnmente identificada para recibir AMPilación son GTPasas y glutamina sintetasa .
Adenylylators
Enzimas responsables de AMPylation, llamados AMPylators o adeniltransferasa , se dividen en dos familias diferentes, todo dependiendo de sus propiedades estructurales y mecanismos utilizados. AMPylator se crea mediante dos mitades catalíticas homólogas. La mitad es responsable de catalizar la reacción de adenilación, mientras que la otra mitad cataliza la reacción de desadenilación fosforolítica . Estas dos familias son la ADN- β -polimerasa similar y la familia Fic.
Similar a la ADN- β -polimerasa, es una familia de nucleotidiltransferasas . Más concretamente se la conoce como familia GlnE. Hay un motivo específico que se utiliza para aclarar esta familia en particular. El motivo consiste en una hoja β de tres hebras que forma parte de la coordinación de iones de magnesio y la unión de fosfato. El aspartato es fundamental para que la actividad se produzca en esta familia.
El dominio Fic pertenece a la superfamilia Fido (Fic / Doc) . Se sabe que la familia Fic , que es una filamentación inducida por el dominio AMP cíclico, realiza AMPilación. Esta familia de proteínas se encuentra en todos los dominios de la vida en la tierra. Está mediado por un mecanismo de motivo de hélice alfa del sitio de unión de ATP. Las bacterias infecciosas utilizan este dominio para interrumpir la fagocitosis y causar la muerte celular. Los dominios fic son dominios conservados evolutivamente en procariotas y eucariotas que pertenecen a la superfamilia de dominios Fido.
Se ha demostrado que los AMPiladores son comparables a las quinasas debido a su actividad de hidrólisis de ATP y transferencia reversible del metabolito a una cadena lateral hidroxilo del sustrato proteico. Sin embargo, la AMPilación cataliza un ataque nucleofílico en el grupo α-fosfato, mientras que la quinasa en la reacción de fosforilación se dirige al γ-fosfato. El ataque nucleofílico de la AMPilación conduce a la liberación de Pirofosfato y la proteína modificada con AMP son los productos de la reacción de AMPilación.
De-adenililadores
La des-AMPilación es la reacción inversa en la que la molécula de AMP se separa del lado del aminoácido de una proteína de cadena.
Hay tres mecanismos conocidos para esta reacción. La GS-ATasa bacteriana (GlnE) codifica una proteína bipartita con dominios separados de AMPilación N-terminal y de-AMPilación C-terminal cuya actividad está regulada por P II y modificaciones postraduccionales asociadas. La des-AMPilación de su sustrato La glutamina sintetasa AMPilada se produce mediante una reacción fosforolítica entre la adenil-tirosina de GS y el ortofosfato , que conduce a la formación de ADP y glutamina sintetasa no modificada.
SidD, una proteína introducida en la célula huésped por la bacteria patógena Legionella pneumophila, des-AMPila Rab1, una proteína del huésped AMPilada por una enzima diferente de Legionella pneumophila, la AMPylasa SidM. Si bien el beneficio para el patógeno de introducir estos dos efectores antagonistas en el huésped sigue sin estar claro, la reacción bioquímica llevada a cabo por SidD implica el uso de un dominio similar a la fosfatasa para catalizar la eliminación hidrolítica del AMP de la tirosina 77 del Rab1 del huésped.
En células animales, la eliminación de AMP de la treonina 518 de BiP / Grp78 es catalizada por la misma enzima, FICD, que AMPila BiP. A diferencia de la GS-ATasa bacteriana, FICD lleva a cabo ambas reacciones con el mismo dominio catalítico.
Procariota
Homeostasis bacteriana
La AMPilación participa en la homeostasis bacteriana. El ejemplo más famoso es AMPylator GS-ATase (GlnE), que contribuye en la regulación compleja del metabolismo del nitrógeno a través de la AMPilación de la glutamina sintetasa que se introdujo en las partes de AMPilación y DeAMPilación.
Otro ejemplo de AMPylators que desempeñan un papel en la homeostasis bacteriana son los Fic AMPylators de clase I (FicT), que modifica la subunidad GyrB de la ADN girasa, el residuo de tirosina conservado para la unión de ATP de la subunidad ParE en la topoisomerasa IV. Esta inactivación de la ADN girasa por AMPilación conduce a la activación de la respuesta SOS, que es la respuesta celular al daño del ADN. La actividad de FicT AMPilación es reversible y solo conduce a la detención del crecimiento, pero no a la muerte celular. Por lo tanto, la AMPilación de FicT juega un papel en la regulación del estrés celular, que se muestra en la bacteria Wolbachia que el nivel de FicT aumenta en respuesta a la doxiciclina.
También se encuentra que un NmFic de AMPylator Fic Clase III de N. meningtidis modifica AMPylate GyrB en la tirosina conservada para la unión de ATP. Esto muestra que los dominios Fic están muy conservados, lo que indica el importante papel de la AMPilación en la regulación del estrés celular en las bacterias. La regulación de NmFic implica la monomerización y autoAMPilación dependientes de la concentración para la activación de la actividad de NmFic.
Patogenicidad bacteriana
Se ha demostrado que las proteínas bacterianas, también conocidas como efectoras, usan AMPilación. Se ha demostrado que los efectores como VopS, IbpA y DrrA AMPilan las GTPasas del hospedador y provocan cambios en el citoesqueleto de actina. Las GTPasas son objetivos comunes de AMPylators. Las familias Rho , Rab y Arf GTPasa están involucradas en la dinámica del citoesqueleto de actina y el tráfico vesicular. También juegan un papel en los mecanismos de control celular como la fagocitosis en la célula huésped.
El patógeno potencia o previene su internalización induciendo o inhibiendo la fagocitosis de la célula huésped . Vibrio parahaemolyticus es una bacteria Gram-negativa que causa intoxicación alimentaria como resultado del consumo de mariscos crudos o poco cocidos en humanos. VopS, un efector de tipo III que se encuentra en Vibrio parahaemolyticus , contiene un dominio Fic que tiene un motivo HPFx (D / E) GN (G / K) R conservado que contiene un residuo de histidina esencial para la AMPilación. VopS bloquea el ensamblaje de actina modificando el residuo de treonina en la región del conmutador 1 de Rho GTPasas. La transferencia de un resto de AMP usando ATP al residuo de treonina da como resultado un impedimento estérico y, por lo tanto, evita que las Rho GTPasas interactúen con los efectores posteriores. VopS también adenila RhoA y el ciclo de división celular 42 (CDC42), lo que lleva a una desagregación de la red de filamentos de actina. Como resultado, se desactiva el control del citoesqueleto de actina de la célula huésped, lo que conduce al redondeo celular.
La IbpA se secreta en células eucariotas de H. somni , una bacteria gramnegativa en el ganado que causa infección del epitelio respiratorio. Este efector contiene dos dominios Fic en la región C-terminal. La AMPilación del dominio IbpA Fic de las GTPasas de la familia Rho es responsable de su citotoxicidad. Ambos dominios Fic tienen efectos similares sobre el citoesqueleto de las células huésped como VopS. La AMPilación en un residuo de tirosina de la región del conmutador 1 bloquea la interacción de las GTPasas con sustratos posteriores como PAK.
DrrA es el sustrato del sistema de translocación Dot / Icm tipo IV DrrA de Legionella pneumophila . Es el efector secretado por L. pneumophila para modificar las GTPasas de las células huésped. Esta modificación aumenta la supervivencia de las bacterias en las células huésped. DrrA se compone de un dominio de factor de intercambio de nucleótidos de guanina (GEF) específico de Rab1b , un dominio de unión a lípidos C-terminal y un dominio N-terminal con propiedades citotóxicas poco claras. Los trabajos de investigación muestran que DrrA N-terminal y de longitud completa muestra actividad de AMPylators hacia la proteína Rab1b del huésped (proteína relacionada con Ras), que también es el sustrato del dominio Rab1b GEF. La proteína Rab1b es la GTPasa Rab para regular el transporte de vesículas y la fusión de membranas. La adenilación por las bacterias AMPylators prolonga el estado de unión a GTP de Rab1b. Por lo tanto, el papel del efector DrrA está relacionado con los beneficios de las vacuolas de las bacterias para su replicación durante la infección.
Eucariota
Las plantas y las levaduras no tienen enzimas AMPilantes endógenas conocidas, pero los genomas animales están dotados de una única copia de un gen que codifica una AMPilasa de dominio Fic, que probablemente fue adquirida por un antepasado temprano de animales a través de la transferencia horizontal de genes de un procariota. La proteína humana conocida comúnmente como FICD, se había identificado previamente como proteína E asociada a Huntingtin (HypE; una asignación que surge de una selección de levadura de dos híbridos, pero de relevancia cuestionable, ya que Huntingtin y HypE / FICD se localizan en diferentes compartimentos celulares) . CG9523 También se ha prestado atención a los homólogos de Drosophila melanogaster (CG9523) y C. elegans (Fic-1) . En todos los animales, la FICD tiene una estructura similar. Es una proteína de dominio transmembrana de tipo II , con un dominio citoplásmico corto seguido de un ancla membrtana que mantiene la proteína en el retículo endoplásmico (RE) y una porción C-terminal larga que reside en RE y abarca repeticiones tetratricopeptídicas (TPR) seguidas de un catalizador. Dominio Fic.
Retículo endoplásmico
El descubrimiento de una AMPilasa de células animales, seguido por el descubrimiento de su localización ER y que BiP es un sustrato prominente por su actividad, fueron avances importantes. Se sabe desde hace mucho tiempo que BiP (también conocido como Grp78) se somete a una modificación postraduccional inactivante, pero su naturaleza sigue siendo esquiva. Ampliamente asumido que es ADP-ribosilación , resulta ser AMPilación mediada por FICD, ya que la inactivación del gen FICD en las células abolió toda modificación postraduccional medible de BiP.
BiP es una proteína acompañante localizada en ER cuya actividad está estrechamente regulada a nivel transcripcional a través de un programa de expresión génica conocido como respuesta de proteína desplegada (UPR). La UPR es un proceso homeostático que acopla la tasa de transcripción de BiP (y muchas otras proteínas) a la carga de proteínas desplegadas en el RE (el llamado estrés del RE) para ayudar a mantener la proteostasis del RE . La AMPilación agrega otra capa postraduccional rápida de control de la actividad de BiP, ya que la modificación de Thr518 del dominio de unión al sustrato de BiP con un AMP bloquea la chaperona en una conformación inactiva. Esta modificación se implementa de forma selectiva a medida que disminuye el estrés de ER, para inactivar el exceso de BiP. Sin embargo, a medida que aumenta el estrés del RE, la misma enzima, FICD, cataliza la reacción opuesta, la des-AMPilación de BiP.
Poco a poco está surgiendo una comprensión de la base estructural de la AMPilación y des-AMPilación de BiP, así como pistas sobre el alosterio que podría regular el cambio en la actividad de FICD, pero quedan por descubrir detalles importantes de este proceso tal como ocurre en las células.
El papel de FICD en la AMPilación (y des-AMPilación) de BiP en Thr518 está bien respaldado por estudios bioquímicos y estructurales. También se ha presentado evidencia de que en algunas circunstancias FICD puede AMPilar un residuo diferente, Thr366 en el dominio de unión de nucleótidos de BiP.
Caenorhabditis elegans
Fic-1 es la única proteína Fic presente en el código genético de C. elegans . Se encuentra principalmente en la envoltura nuclear del RE de células adultas de la línea germinal y células embrionarias, pero se pueden encontrar pequeñas cantidades dentro del citoplasma. A este grupo extra-ER de FICD's-1 se le atribuye AMPilación de histonas centrales y factores de traducción de tipo eEF1-A dentro del nematodo.
Aunque los niveles variables de AMPilación no crearon ningún efecto notable dentro del comportamiento o fisiología del nematodo, los gusanos knockout Fic-1 fueron más susceptibles a la infección por Pseudomonas aeruginosa en comparación con las contrapartes con dominios Fic-1 activos, lo que implica un vínculo entre AMPilación de objetivos celulares y respuestas inmunes dentro de los nematodos.
Drosophila melanogaster
Las moscas que carecen de FICD (CG9523) se han descrito como ciegas. Inicialmente, este defecto se atribuyó a un papel de FICD en la superficie celular de las proyecciones capitadas, un sitio putativo de reciclaje de neurotransmisores, sin embargo, un estudio posterior implicó la AMPilación de BiP Thr366 mediada por FICD en el problema visual.
Importancia clínica
Se encontró que la proteína presináptica α-sinucleína es un objetivo para la AMPilación de FICD. Durante la adenilación de αSyn mediada por HypE , la agregación de αSyn disminuye y se descubrió que tanto la neurotoxicidad como el estrés ER disminuyen in vitro . Por lo tanto, la adenilación de αSyn es posiblemente una respuesta protectora al estrés ER y la agregación de αSyn. Sin embargo, como aSyn y FICD residen en compartimentos diferentes, es necesario realizar más investigaciones para confirmar la importancia de estas afirmaciones.
Detección
Mangos químicos
Los mangos químicos se utilizan para detectar proteínas modificadas postraduccionalmente. Recientemente, existe un N6pATP que contiene una etiqueta de alquinilo (propargilo) en la posición N6 de la adenina de ATP. Este N6pATP se combina con la reacción de clic para detectar proteínas AMPiladas. Para detectar proteínas modificadas no reconocidas y marcar sustratos de VopS, se utilizan derivados de ATP con un fluoróforo en la adenina N6 NH2 para hacer eso.
Método basado en anticuerpos
El anticuerpo es famoso por su alta afinidad y selectividad, por lo que es la buena forma de detectar proteínas AMPiladas. Recientemente, los anticuerpos ɑ-AMP se utilizan para detectar y aislar directamente proteínas AMPiladas (especialmente tirosina AMPilada y treonina AMPilada) de células y lisados celulares. La AMPilación es una modificación postraduccional, por lo que modificará las propiedades de la proteína dando el carácter polar de AMP y la hidrofobicidad. Por tanto, en lugar de utilizar anticuerpos que detectan una secuencia de péptidos completa, se prefiere la producción de anticuerpos AMP dirigidos directamente a aminoácidos específicos.
Espectrometría de masas
Anteriormente, muchos trabajos científicos usaban espectrometría de masas (MS) en diferentes modos de fragmentación para detectar péptidos AMPylated. En respuesta a las técnicas de fragmentación distintivas, las secuencias de proteínas AMPiladas se desintegraron en diferentes partes de AMP. Mientras que la disociación por transferencia de electrones (ETD) crea fragmentos mínimos y espectros menos complicados, la disociación inducida por colisión (CID) y la fragmentación por colisión de alta energía (HCD) generan iones característicos adecuados para la identificación de proteínas AMPiladas al generar múltiples fragmentos de AMP. Debido a la estabilidad de AMP, los espectros de fragmentación de péptidos son fáciles de leer manualmente o con motores de búsqueda.
Inhibidores
Inhibidores de la proteína AMPylation con la constante de inhibición (K i ) que va de 6 - 50 micras y la selectividad al menos 30 veces frente a bombo se han descubierto.