Leptospirosis - Leptospirosis
| Leptospirosis | |
|---|---|
| Otros nombres | Fiebre de la rata, fiebre del campo, amarillos del atrapasueños, fiebre pretibial |
 | |
| Leptospira magnificada 200 veces con un microscopio de campo oscuro . | |
| Especialidad | Enfermedad infecciosa |
| Síntomas | Ninguno, dolores de cabeza , dolores musculares , fiebre. |
| Complicaciones | Sangrado de los pulmones , meningitis , insuficiencia renal |
| Inicio habitual | Una a dos semanas |
| Causas | La leptospira se transmite típicamente por roedores. |
| Factores de riesgo | Exposición a animales infectados o agua contaminada |
| Método de diagnóstico | Análisis de sangre para detectar anticuerpos contra la bacteria o su ADN |
| Diagnóstico diferencial | Paludismo , fiebre entérica , rickettsiosis , dengue |
| Prevención | Equipo de protección personal , medidas de higiene, doxiciclina. |
| Tratamiento | Doxiciclina , penicilina , ceftriaxona |
| Pronóstico | Riesgo de muerte ~ 7.5% |
| Frecuencia | Un millón de personas al año |
| Fallecidos | 58,900 por año |
La leptospirosis es una infección de la sangre causada por la bacteria Leptospira . Los signos y síntomas pueden variar de ninguno a leve ( dolores de cabeza , dolores musculares y fiebre ) a severos ( sangrado en los pulmones o meningitis ). La enfermedad de Weil , la forma aguda y grave de leptospirosis, hace que la persona infectada se vuelva ictericia (la piel y los ojos se pongan amarillos), desarrolle insuficiencia renal y sangre. El sangrado de los pulmones asociado con la leptospirosis se conoce como síndrome de hemorragia pulmonar grave .
Más de diez tipos genéticos de Leptospira causan enfermedades en humanos. Tanto los animales salvajes como los domésticos pueden propagar la enfermedad, más comúnmente los roedores . Las bacterias se transmiten a los seres humanos a través de la orina de animales , o el agua y el suelo contaminados con orina de animales, al entrar en contacto con los ojos , la boca, la nariz o las roturas de la piel . En los países en desarrollo, la enfermedad se presenta con mayor frecuencia en agricultores y personas de bajos ingresos que viven en áreas con un saneamiento deficiente. En los países desarrollados, ocurre durante fuertes aguaceros y es un riesgo para los trabajadores del alcantarillado y aquellos involucrados en actividades al aire libre en áreas cálidas y húmedas. Por lo general, el diagnóstico se realiza mediante la prueba de anticuerpos contra las bacterias o la búsqueda de ADN bacteriano en la sangre.
Los esfuerzos para prevenir la enfermedad incluyen equipo de protección para bloquear el contacto cuando se trabaja con animales potencialmente infectados, lavar después del contacto y reducir los roedores en las áreas donde la gente vive y trabaja. El antibiótico doxiciclina es eficaz para prevenir la infección por leptospirosis. Las vacunas humanas son de utilidad limitada; las vacunas para otros animales están más disponibles. El tratamiento cuando se infecta es con antibióticos como doxiciclina, penicilina o ceftriaxona . El riesgo general de muerte es del 5 al 10%. Sin embargo, cuando los pulmones están afectados, el riesgo de muerte aumenta hasta un rango de 50 a 70%.
Se estima que cada año ocurren un millón de casos graves de leptospirosis, que causan alrededor de 58,900 muertes. La enfermedad es más común en áreas tropicales del mundo, pero puede ocurrir en cualquier parte. Los brotes pueden surgir después de fuertes lluvias. La enfermedad fue descrita por primera vez por el médico Adolf Weil en 1886 en Alemania.
Signos y síntomas

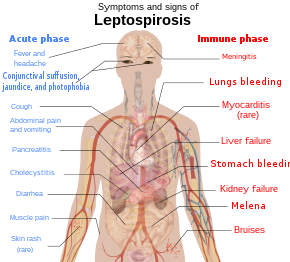
Los síntomas de la leptospirosis suelen aparecer una o dos semanas después de la infección, pero el período de incubación puede durar hasta un mes. La enfermedad es bifásica en la mayoría de los casos sintomáticos. Los síntomas de la primera fase (fase aguda o leptospirémica) duran de cinco a siete días. En la segunda fase (fase inmune), los síntomas se resuelven a medida que se producen anticuerpos contra las bacterias. Se desarrollan síntomas adicionales en la segunda fase. Las fases de la enfermedad pueden no ser distintas, especialmente en pacientes con enfermedad grave. El 90% de los infectados experimenta síntomas leves, mientras que el 10% experimenta leptospirosis grave.
La infección por leptospira en humanos causa una variedad de síntomas , aunque algunas personas infectadas pueden no tener ninguno. La enfermedad comienza repentinamente con fiebre acompañada de escalofríos, dolor de cabeza intenso, dolores musculares intensos y dolor abdominal. Un dolor de cabeza provocado por la leptospirosis causa un dolor punzante y se localiza de manera característica en las regiones frontales o temporales bilaterales de la cabeza . La persona también podría tener dolor detrás de los ojos y sensibilidad a la luz . El dolor muscular suele afectar el músculo de la pantorrilla y la zona lumbar. El rasgo más característico de la leptospirosis es la sufusión conjuntival ( conjuntivitis sin exudado ) que rara vez se encuentra en otras enfermedades febriles . Otros hallazgos característicos en el ojo incluyen hemorragia subconjuntival e ictericia . Rara vez se encuentra una erupción en la leptospirosis. Cuando se encuentra uno, se deben considerar diagnósticos alternativos como el dengue y la fiebre chikungunya . La tos seca se observa en 20 a 57% de las personas con leptospirosis. Por lo tanto, esta característica clínica puede inducir a error al médico a diagnosticar la enfermedad como una enfermedad respiratoria. Además, con frecuencia se presentan síntomas gastrointestinales como náuseas , vómitos, dolor abdominal y diarrea. Los vómitos y la diarrea pueden contribuir a la deshidratación . El dolor abdominal puede deberse a una colecistitis acalculosa o una inflamación del páncreas . En raras ocasiones, los ganglios linfáticos , el hígado y el bazo pueden estar agrandados y palpables.
Habrá una resolución de los síntomas durante uno a tres días. La fase inmunológica comienza después de esto y puede durar de cuatro a 30 días y puede ser cualquier cosa, desde complicaciones cerebrales hasta complicaciones renales. El sello distintivo de la segunda fase es la inflamación de las membranas que recubren el cerebro . Los signos y síntomas de la meningitis incluyen dolor de cabeza intenso y rigidez del cuello. La afectación renal se asocia con una producción de orina reducida o ausente.
La forma clásica de leptospirosis grave, conocida como enfermedad de Weil, se caracteriza por daño hepático (que causa ictericia), insuficiencia renal y hemorragia, que ocurre en 5 a 10% de los infectados. También puede ocurrir daño pulmonar y cerebral. Para aquellos con signos de inflamación de las membranas que cubren el cerebro y el cerebro mismo , puede ocurrir una alteración del nivel de conciencia . Una variedad de problemas neurológicos como parálisis de la mitad del cuerpo , inflamación completa de toda una sección horizontal de la médula espinal y debilidad muscular debido al daño inmunológico de los nervios que irrigan los músculos son las complicaciones. Los signos de sangrado como hematomas no traumáticos a 1 mm (0,039 pulg.) , Hematomas no traumáticos de más de 1 cm (0,39 pulg.) , Hemorragia nasal , heces negruzcas debido a sangrado en el estómago , vómitos de sangre y sangrado de los pulmones pueden también se encuentra. La prolongación del tiempo de protrombina en las pruebas de coagulación se asocia con una manifestación hemorrágica grave. Sin embargo, el recuento bajo de plaquetas no se asocia con hemorragia grave. La hemorragia pulmonar es una hemorragia alveolar (sangrado hacia los alvéolos de los pulmones) que provoca una tos masiva de sangre y causa el síndrome de dificultad respiratoria aguda , en el que el riesgo de muerte es superior al 50%. En raras ocasiones, puede producirse inflamación de los músculos del corazón , inflamación de las membranas que recubren el corazón , anomalías en el marcapasos natural del corazón y ritmos cardíacos anormales .
Porque
Bacterias
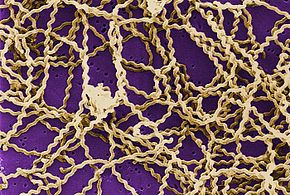
La leptospirosis es causada por bacterias espiroquetas que pertenecen al género Leptospira , que son aeróbicas , helicoidales a la derecha y de 6 a 20 micrómetros de longitud. Al igual que las bacterias Gram-negativas , Leptospira tiene una membrana externa tachonada con lipopolisacárido (LPS) en la superficie, una membrana interna y una capa de pared celular de peptidoglicano . Sin embargo, a diferencia de las bacterias Gram-negativas, la capa de peptidoglicano en Leptospira se encuentra más cerca de la membrana interna que de la externa. Esto da como resultado una membrana externa fluida asociada libremente con la pared celular. Además, las Leptospira tienen un flagelo ubicado en el periplasma , asociado al movimiento en forma de sacacorchos. Los quimiorreceptores en los polos de las bacterias detectan varios sustratos y cambian la dirección de su movimiento. Las bacterias se visualizan tradicionalmente mediante microscopía de campo oscuro sin tinción.
Se ha identificado un total de 66 especies de Leptospira . Según su secuencia genómica, se dividen en dos clados y cuatro subclados: P1, P2, S1 y S2. Los 19 miembros del subclade P1 incluyen las 8 especies que pueden causar enfermedades graves en humanos: L. alexanderi , L. borgpetersenii , L. interrogans , L. kirschneri , L. mayottensis , L. noguchii , L. santarosai y L. weilii . El clado P2 comprende 21 especies que pueden causar una enfermedad leve en humanos. Las 26 especies restantes comprenden los subclados S1 y S2, que incluyen "saprófitos" que se sabe que consumen materia en descomposición ( nutrición saprotrófica ). La leptospira patógena no se multiplica en el medio ambiente. La leptospira requiere mucha humedad para sobrevivir, pero puede permanecer viva en ambientes como agua estancada o suelo contaminado. La bacteria se puede matar a temperaturas de 50 ° C (122 ° F) y se puede inactivar con etanol al 70% , hipoclorito de sodio al 1% , formaldehído , detergentes y ácidos.
Las leptospira también se clasifican según su serovariedad . La diversa composición de azúcares del lipopolisacárido en la superficie de las bacterias es responsable de la diferencia antigénica entre los serovares. Se reconocen más de 250 serovares patógenos de Leptospira , con serovares estrechamente relacionados reunidos en más de 26 serogrupos patógenos. Las cepas de diferentes especies de Leptospira pueden ser miembros del mismo serogrupo debido a la transferencia genética horizontal de genes biosintéticos de LPS entre diferentes especies.
Transmisión
La bacteria se puede encontrar en estanques, ríos, charcos, alcantarillas, campos agrícolas y suelo húmedo. Se ha encontrado Leptospira patógena en forma de biopelículas acuáticas , que pueden ayudar a la supervivencia en el medio ambiente.
La leptospira vive en los riñones de varios animales domésticos y salvajes. Cuando los animales ingieren las bacterias, circulan en el torrente sanguíneo y luego se alojan en los riñones a través de los capilares glomerululares o peritubulares . Las bacterias luego pasan a las luces de los túbulos renales y colonizan el borde en cepillo del túbulo contorneado proximal . Esto provoca la eliminación continua de bacterias en la orina sin que el animal experimente efectos nocivos significativos. Esta relación entre el animal y la bacteria se conoce como relación comensal , y el animal se conoce como huésped reservorio .
La leptospira se encuentra principalmente en mamíferos. Sin embargo, se ha demostrado que los reptiles y los animales de sangre fría como ranas, serpientes, tortugas y sapos tienen la infección. Se desconoce si existen reservorios de infección humana. Las ratas, los ratones y los topos son huéspedes primarios importantes , pero otros mamíferos como perros, ciervos, conejos, erizos, vacas, ovejas, cerdos, mapaches, zarigüeyas y mofetas también pueden transmitir la enfermedad. En África, se han identificado como portadores varios hospedadores de vida silvestre, incluidos la mangosta anillada , el zorro egipcio , el venado Rusa y las musarañas . Existen varios mecanismos mediante los cuales los animales pueden infectarse entre sí. Los perros pueden lamer la orina de un animal infectado de la hierba o el suelo , o beber de un charco infectado. Los perros domésticos que viven en casa han contraído leptospirosis, aparentemente por lamer la orina de ratones infectados en la casa. La leptospirosis también se puede transmitir a través del semen de animales infectados. La duración de la presencia constante de bacterias en la orina de los animales puede persistir durante años.
Los humanos son el anfitrión accidental de Leptospira . Los seres humanos se infectan por contacto con agua o suelo húmedo que contiene orina de animales infectados. Las bacterias entran a través de cortes, abrasiones, ingestión de alimentos contaminados o por contacto con las membranas mucosas del cuerpo (por ejemplo, boca, nariz y ojos). Las ocupaciones en riesgo de contraer leptospirosis incluyen agricultores, pescadores, recolectores de basura y trabajadores de alcantarillado. La enfermedad también está relacionada con el turismo de aventura y las actividades recreativas. Es común entre los entusiastas de los deportes acuáticos en áreas específicas, como triatlones , rafting , piragüismo y natación, ya que la inmersión prolongada en el agua promueve la entrada de bacterias. Sin embargo, es poco probable que Leptospira penetre en la piel intacta. No se sabe que la enfermedad se propague entre humanos, y la diseminación bacteriana en el período de recuperación es extremadamente rara en humanos. Una vez que los seres humanos están infectados, la eliminación de bacterias de los riñones suele persistir hasta por 60 días.
En raras ocasiones, la leptospirosis se puede transmitir a través de un trasplante de órganos. También es posible la infección a través de la placenta durante el embarazo. Puede provocar un aborto espontáneo e infecciones en los bebés . También se ha informado de la transmisión de la leptospirosis a través del consumo de carne cruda de animales silvestres (por ejemplo, pacientes psiquiátricos con alotrofagia).
Patogénesis
La patogenia de la leptospirosis sigue siendo poco conocida a pesar de los esfuerzos de investigación. Las bacterias ingresan al cuerpo humano a través de brechas en la piel o la membrana mucosa y luego en el torrente sanguíneo. Posteriormente, las bacterias se adhieren a las células endoteliales de los vasos sanguíneos y la matriz extracelular (red compleja de proteínas y carbohidratos presentes entre las células). Las bacterias usan sus flagelos para moverse entre las capas celulares. Se unen a células como fibroblastos , macrófagos , células endoteliales y células epiteliales renales. También se unen a varias proteínas humanas, como las proteínas del complemento, la trombina , el fibrinógeno y el plasminógeno, utilizando proteínas similares a las inmunoglobulinas leptospirales (Lig) de superficie , como LigB y LipL32, cuyos genes se encuentran en todas las especies patógenas.
A través del sistema inmunológico innato , las células endoteliales de los capilares del cuerpo humano son activadas por la presencia de estas bacterias. Las células endoteliales producen citocinas y péptidos antimicrobianos contra las bacterias. Estos productos regulan la cascada de coagulación y los movimientos de los glóbulos blancos. Los macrófagos presentados en humanos pueden engullir a Leptospira . Sin embargo, Leptospira puede residir y proliferar en la matriz citoplásmica después de ser ingerida por los macrófagos. Aquellos con leptospirosis severa pueden experimentar un alto nivel de citocinas como la interleucina 6 , el factor de necrosis tumoral alfa (TNF-α) y la interleucina 10 . El alto nivel de citocinas provoca síntomas similares a los de la sepsis que ponen en peligro la vida en lugar de ayudar a combatir la infección. Aquellos que tienen un alto riesgo de sepsis durante una infección por leptospirosis tienen el genotipo HLA-DQ6 , posiblemente debido a la activación del superantígeno , que daña los órganos corporales.
La inmunidad humoral es la principal respuesta inmunitaria contra las células de Leptospira . Los anticuerpos aglutinantes como la inmunoglobulina M y la inmunoglobulina G se producen contra las bacterias. Dichos anticuerpos se dirigen principalmente contra el LPS . Leptospira LPS solo activa el receptor tipo toll 2 (TLR2) en monocitos en humanos. Los receptores TLR4 humanos no reconocen la molécula de lípido A de la bacteria . Por lo tanto, la falta de reconocimiento de Leptospira por los receptores TLR4 probablemente contribuya al proceso de la enfermedad de la leptospirosis en humanos.
Aunque existen varios mecanismos en el cuerpo humano para luchar contra las bacterias, Leptospira está bien adaptada a tal condición inflamatoria creada por ella. En el torrente sanguíneo, puede activar el plasminógeno del huésped para que se convierta en plasmina que descompone la matriz extracelular, degrada los coágulos de fibrina y las proteínas complementarias ( C3b y C5 ) para evitar la opsonización . También puede reclutar reguladores del complemento como el factor H , la proteína de unión a C4b , la proteína de unión al factor H y la vitronectina para prevenir la activación del complejo de ataque a la membrana en su superficie. También secreta proteasas para degradar proteínas del complemento como C3 . Puede unirse a la trombina que disminuye la formación de fibrina. La formación reducida de fibrina aumenta el riesgo de hemorragia. La leptospira también secreta esfingomielinasa y hemolisina que se dirigen a los glóbulos rojos.
La leptospira se propaga rápidamente a todos los órganos a través del torrente sanguíneo. Afectan principalmente al hígado. Invaden los espacios entre los hepatocitos y provocan la apoptosis. Los hepatocitos y las uniones intercelulares de los hepatocitos dañados provocan una fuga de bilis al torrente sanguíneo, lo que provoca niveles elevados de bilirrubina , lo que da lugar a ictericia. Se han notificado sinusoides hepáticos congestionados y espacios perisinusoidales . Mientras tanto, en los pulmones, se pueden encontrar petequias o sangrado franco en el tabique alveolar y los espacios entre los alvéolos. Leptospira secreta toxinas que causan insuficiencia renal leve o grave o nefritis intersticial . La insuficiencia renal puede recuperarse por completo o provocar atrofia y fibrosis . La inflamación de los músculos del corazón, las arterias coronarias y la aorta es rara.
Diagnóstico

Pruebas de laboratorio
Para aquellos que están infectados, un hemograma completo puede mostrar un recuento alto de glóbulos blancos y un recuento bajo de plaquetas. Cuando hay un recuento bajo de hemoglobina junto con un recuento bajo de glóbulos blancos y trombocitopenia , se debe considerar la supresión de la médula ósea . La velocidad de sedimentación globular y la proteína C reactiva también pueden estar elevadas.
Los riñones suelen estar implicados en la leptospirosis. Los niveles de urea y creatinina en sangre estarán elevados. La leptospirosis aumenta la excreción de potasio en la orina, lo que conduce a un nivel bajo de potasio y un nivel bajo de sodio en la sangre. El análisis de orina puede revelar la presencia de proteínas , glóbulos blancos y hematuria microscópica . Debido a que las bacterias se depositan en los riñones, los urocultivos serán positivos para leptospirosis a partir de la segunda semana de la enfermedad hasta los 30 días de la infección.
Para aquellos con afectación hepática, las transaminasas y la bilirrubina directa están elevadas en las pruebas de función hepática . El serogrupo Icterohaemorrhagiae se asocia con ictericia y niveles elevados de bilirrubina. La anemia hemolítica contribuye a la ictericia. Una característica de la leptospirosis es la anemia hemolítica aguda y la hiperbilirrubinemia conjugada , especialmente en pacientes con deficiencia de glucosa-6-fosfato deshidrogenasa . Los niveles séricos anormales de amilasa y lipasa (asociados con pancreatitis) se encuentran en aquellos que ingresan al hospital debido a leptospirosis. La función renal alterada con un aclaramiento de creatinina inferior a 50 ml / min se asocia con un aumento de las enzimas pancreáticas.
Para aquellos con dolor de cabeza severo que muestran signos de meningitis, se puede intentar una punción lumbar . Si está infectado, el examen del líquido cefalorraquídeo (LCR) muestra predominio de linfocitos con un recuento de células de aproximadamente 500 / mm 3 , proteínas entre 50 y 100 mg / ml y niveles normales de glucosa. Estos hallazgos son consistentes con meningitis aséptica .
Pruebas serológicas
La detección rápida de Leptospira se puede realizar cuantificando los anticuerpos IgM mediante ELISA . Normalmente, el antígeno de L. biflexa se usa para detectar los anticuerpos IgM. Esta prueba puede determinar rápidamente el diagnóstico y ayudar en el tratamiento temprano. Sin embargo, la especificidad de la prueba depende del tipo de antígeno utilizado y de la presencia de anticuerpos de infecciones previas. La presencia de otras enfermedades como la infección por el virus de Epstein-Barr , la hepatitis viral y la infección por citomegalovirus pueden producir resultados falsos positivos. Se han desarrollado otras pruebas de detección rápida como las tiras reactivas, el látex y las pruebas de aglutinación en portaobjetos.
La prueba de aglutinación microscópica (MAT) es la prueba de referencia para el diagnóstico de leptospirosis. MAT es una prueba en la que se mezclan diluciones seriadas de sueros de pacientes con diferentes serovares de Leptospira . Luego, la mezcla se examina bajo un microscopio de campo oscuro para buscar aglutinación . El resultado es la dilución más alta en la que se produce una aglutinación del 50%. Los títulos de MAT de 1: 100 a 1: 800 son diagnósticos de leptospirosis. Un aumento de cuatro veces o más en el título de dos sueros tomados al inicio de los síntomas y de tres a 10 días después del inicio de la enfermedad confirma el diagnóstico. Durante la fase aguda de la enfermedad, MAT no es específico para detectar un serotipo de Leptospira debido a la reactividad cruzada entre los serovares. En la fase de convalecencia , MAT es más específico en la detección de tipos de serovariedades. MAT requiere un panel de antígenos vivos y requiere un trabajo laborioso.
Pruebas moleculares
El ADN de Leptospira se puede amplificar mediante la reacción en cadena de la polimerasa (PCR) a partir de muestras de suero, orina, humor acuoso , LCR y autopsia. La PCR puede detectar el ADN de Leptospira en sangre incluso antes de que se desarrolle la respuesta de anticuerpos. Dado que la PCR detecta la presencia de ADN de Leptospira , resulta útil incluso después de que se ha iniciado el tratamiento con antibióticos.
Imagen
En aquellos que tienen afectación pulmonar, una radiografía de tórax puede mostrar opacidades alveolares difusas.
Criterios de diagnóstico
En 1982, la Organización Mundial de la Salud (OMS) propuso los criterios de Faine para el diagnóstico de leptospirosis. Consta de tres partes: A (hallazgos clínicos), B (factores epidemiológicos) y C (hallazgos de laboratorio y datos bacteriológicos). Dado que los criterios de Faine originales solo incluían cultivo y MAT en la parte C, que es difícil y complejo de realizar, los criterios de Faine modificados se propusieron en 2004 para incluir ELISA y pruebas de aglutinación en portaobjetos que son más fáciles de realizar. En 2012, se propuso modificar los criterios de Faine (con enmiendas) para incluir dificultad para respirar y tos con sangre en el diagnóstico. En 2013, India recomendó modificar los criterios de Faine en el diagnóstico de leptospirosis.
Prevención


Las tasas de leptospirosis se pueden reducir mejorando los estándares de vivienda, infraestructura y saneamiento. Los esfuerzos de reducción de roedores y los proyectos de mitigación de inundaciones también pueden ayudar a prevenirlo. El uso adecuado del equipo de protección personal (EPP) por parte de personas que tienen un alto riesgo de exposición ocupacional puede prevenir las infecciones por leptospirosis en la mayoría de los casos.
No existe una vacuna humana adecuada para su uso en todo el mundo. Solo Cuba, Japón, Francia y China han aprobado el uso de vacunas contra la leptospirosis, y se administran solo a quienes tienen ocupaciones de alto riesgo y en respuesta a inundaciones y epidemias. Las vacunas están compuestas de Leptospira muerta y confieren inmunidad solo al serovar contenido en la vacuna. Se han informado efectos secundarios como náuseas, enrojecimiento en el lugar de la inyección e hinchazón después de la inyección de la vacuna. Dado que la inmunidad inducida por un serovar de Leptospira solo protege contra ese específico, se han desarrollado vacunas trivalentes . La inmunidad después de la vacunación dura aproximadamente un año.
La doxiciclina se administra una vez a la semana como profilaxis y es eficaz para reducir la tasa de infecciones por leptospirosis entre personas de alto riesgo en áreas propensas a inundaciones. En un estudio, redujo el número de casos de leptospirosis en personal militar que realiza ejercicios en las selvas. En otro estudio, redujo el número de casos sintomáticos después de la exposición a la leptospirosis bajo fuertes lluvias en áreas endémicas .
Tratamiento
La mayoría de los casos de leptospiras se resuelven espontáneamente. El inicio temprano de antibióticos puede prevenir la progresión a una enfermedad grave. Por lo tanto, en entornos con recursos limitados, los antibióticos pueden iniciarse una vez que se sospecha leptospirosis después de la anamnesis y el examen.
Para la leptospirosis leve, las recomendaciones de antibióticos como doxiciclina, azitromicina , ampicilina y amoxicilina se basaron únicamente en pruebas in vitro . En 2001, la OMS recomendó la doxiciclina oral (2 mg / kg hasta 100 mg cada 12 horas) durante cinco a siete días para aquellos con leptospirosis leve. En tales casos, también se pueden usar tetraciclina , ampicilina y amoxicilina. Sin embargo, en áreas donde la rickettsia y la leptospirosis son endémicas, la azitromicina y la doxiciclina son los fármacos de elección.
Según un estudio de 1988, se recomienda la bencilpenicilina intravenosa (IV) (también conocida como penicilina G) para el tratamiento de la leptospirosis grave. La bencilpenicilina intravenosa (30 mg / kg hasta 1,2 g cada seis horas) se usa durante cinco a siete días. También se pueden usar amoxicilina, ampicilina y eritromicina para casos graves. La ceftriaxona (1 g IV cada 24 horas durante siete días) también es eficaz para la leptospirosis grave. La cefotaxima (1 g IV cada seis horas durante siete días) y la doxiciclina (200 mg inicialmente seguidos de 100 mg IV cada 12 horas durante siete días) son igualmente efectivas que la bencilpenicilina (1,5 millones de unidades IV cada seis horas durante siete días). Por lo tanto, no hay evidencia de diferencias en la reducción de muertes cuando se compara la bencilpenicilina con ceftriaxona o cefotaxima. Otro estudio realizado en 2007 tampoco mostró diferencias en la eficacia entre la doxiciclina (200 mg inicialmente seguidos de 100 mg por vía oral cada 12 horas durante siete días) o la azitromicina (2 g el día uno seguido de 1 g al día durante dos días más) por sospecha de leptospirosis . No hubo diferencia en la resolución de la fiebre y la azitromicina se tolera mejor que la doxiciclina.
Los pacientes ambulatorios reciben doxiciclina o azitromicina. La doxiciclina puede acortar la duración de la leptospirosis en dos días, mejorar los síntomas y prevenir la eliminación de organismos en la orina. Se administra azitromicina y amoxicilina a mujeres embarazadas y niños. En raras ocasiones, se puede desarrollar una reacción de Jarisch-Herxheimer en las primeras horas después de la administración de antibióticos. Sin embargo, según un metanálisis realizado en 2012, el beneficio de los antibióticos en el tratamiento de la leptospirosis no estaba claro, aunque el uso de antibióticos puede reducir la duración de la enfermedad de dos a cuatro días. Otro metanálisis realizado en 2013 llegó a una conclusión similar.
Para aquellos con leptospirosis severa, incluida la pérdida de potasio con disfunción de la producción renal alta, la hidratación intravenosa y los suplementos de potasio pueden prevenir la deshidratación y la hipopotasemia . Cuando se produce una insuficiencia renal aguda , el inicio temprano de la hemodiálisis o la diálisis peritoneal puede ayudar a mejorar la supervivencia. Para aquellos con insuficiencia respiratoria, la intubación traqueal con volumen corriente bajo mejora las tasas de supervivencia.
Se ha propuesto que los corticosteroides suprimen la inflamación en la leptospirosis porque la infección por Leptospira puede inducir la liberación de señales químicas que promueven la inflamación de los vasos sanguíneos en los pulmones. Sin embargo, no hay pruebas suficientes para determinar si el uso de corticosteroides es beneficioso.
Pronóstico
El riesgo general de muerte por leptospirosis es de 5 a 10%. Para aquellos con ictericia, la letalidad puede aumentar hasta en un 15%. Para aquellos infectados que presentan confusión y signos neurológicos, existe un alto riesgo de muerte. Otros factores que aumentan el riesgo de muerte incluyen la reducción de la producción de orina, la edad mayor de 36 años y la insuficiencia respiratoria. Con el cuidado adecuado, la mayoría de los infectados se recuperarán por completo. Las personas con insuficiencia renal aguda pueden sufrir una insuficiencia renal leve persistente después de recuperarse. En aquellos con afectación pulmonar grave, el riesgo de muerte es de 50 a 70%.
En un estudio, el 30% de los pacientes que se recuperaron de la leptospirosis aguda se quejaron de fatiga prolongada, malestar, debilidad, dolor muscular y dolores de cabeza. En el 21% de estos pacientes, estos síntomas duraron más de 2 años. Los problemas oculares ocurren en el 10% de los que se recuperaron de la leptospirosis. Estas complicaciones van desde una uveítis anterior leve hasta una panuveítis grave (que involucra las tres capas vasculares del ojo) después de la recuperación. Hasta en un 80% de los infectados, el ADN de Leptospira se detecta en el humor acuoso del ojo. Los problemas oculares suelen tener un buen pronóstico tras el tratamiento o son autolimitados.
Epidemiología
Se estima que anualmente ocurren un millón de casos severos de leptospirosis, con 58,900 muertes. Los casos graves representan del 5 al 15% de todos los casos de leptospirosis. La leptospirosis se encuentra tanto en áreas urbanas como rurales en regiones tropicales , subtropicales y templadas . La carga de salud mundial de la leptospirosis se puede medir por año de vida ajustado por discapacidad (AVAD). La puntuación es de 42 por cada 100.000 personas por año, que es más que otras enfermedades como la rabia y la filariasis .
La enfermedad se observa de forma persistente en partes de Asia, Oceanía, el Caribe, América Latina y África. La Antártida es el único lugar que no se ve afectado por la leptospirosis. En los Estados Unidos, había de 100 a 150 casos de leptospirosis al año. En 1994, la leptospirosis dejó de ser una enfermedad de declaración obligatoria en los Estados Unidos, excepto en 36 estados / territorios donde prevalece, como Hawái, Texas, California y Puerto Rico. Aproximadamente el 50% de los casos reportados ocurrieron en Puerto Rico. En enero de 2013, la leptosprirosis se restableció como una enfermedad de declaración obligatoria a nivel nacional en los Estados Unidos.
Las tasas mundiales de leptospirosis se han subestimado porque la mayoría de los países afectados carecen de notificación o la notificación no es obligatoria. Distinguir los signos clínicos de la leptospirosis de otras enfermedades y la falta de servicios de diagnóstico de laboratorio son otros problemas. La situación socioeconómica de gran parte de la población mundial está estrechamente relacionada con la malnutrición; la subsiguiente falta de micronutrientes puede conducir a un mayor riesgo de infección y muerte debido a la infección por leptospirosis. Los micronutrientes como el hierro , el calcio y el magnesio representan áreas importantes para la investigación futura.
El número de casos de leptospirosis está directamente relacionado con la cantidad de lluvia, lo que hace que la enfermedad sea estacional en climas templados y durante todo el año en climas tropicales. El riesgo de contraer leptospirosis depende del riesgo de ser portador de la enfermedad en la comunidad y de la frecuencia de exposición. En las zonas rurales, la agricultura y la ganadería son los principales factores de riesgo de contraer leptospirosis. La vivienda deficiente y el saneamiento inadecuado también aumentan el riesgo de infección. En áreas tropicales y semitropicales, la enfermedad a menudo se generaliza después de lluvias intensas o después de inundaciones.
Historia
La enfermedad fue descrita por primera vez por Adolf Weil en 1886 cuando informó de una "enfermedad infecciosa aguda con agrandamiento del bazo, ictericia y nefritis ". Antes de la descripción de Weil, la enfermedad se conocía como " ictericia de los campos de arroz " en el texto chino antiguo, "fiebre de otoño", "fiebre de siete días" y " fiebre nanukayami " en Japón; en Europa y Australia, la enfermedad se asoció con ciertas ocupaciones y nombres como "enfermedad del cortador de caña", "enfermedad del rebaño porcino" y " Schlammfieber " (fiebre del barro). Se ha conocido históricamente como "ictericia negra" o "fiebre de las granjas lecheras" en Nueva Zelanda. La leptospirosis se postuló como la causa de una epidemia entre los nativos americanos a lo largo de la costa de lo que ahora es Nueva Inglaterra durante 1616-19. Lo más probable es que los europeos trajeran la enfermedad al Nuevo Mundo .
La leptospira se observó por primera vez en 1907 en un corte de tejido renal post mortem por Arthur Stimson utilizando la técnica de tinción por deposición de plata . Llamó al organismo Spirocheta interrogans porque la bacteria se parecía a un signo de interrogación. En 1908, un grupo de investigación japonés dirigido por Ryukichi Inada y Yutaka Ito identificó por primera vez a esta bacteria como el agente causante de la leptospirosis y notó su presencia en ratas en 1916. Los trabajadores de las minas de carbón japonesas contrajeron con frecuencia leptospirosis. En Japón, el organismo se denominó Spirocheta icterohaemorrhagiae . El grupo japonés también experimentó con los primeros estudios de inmunización contra leptospiras en cobayas. Demostraron que inyectando sueros de humanos o cabras convalecientes a los conejillos de indias infectados , se podría proporcionar inmunidad pasiva a los conejillos de indias. En 1917, el grupo japonés descubrió a las ratas como portadoras de leptospirosis. Sin conocer el trabajo del grupo japonés, dos grupos alemanes publicaron de forma independiente y casi simultáneamente su primera demostración de transmisión de la infección por leptospira en cobayas en octubre de 1915. Llamaron al organismo Spirochaeta nodosa y Spirochaeta Icterogenes respectivamente.
La leptospirosis se reconoció posteriormente como una enfermedad de todas las especies de mamíferos. En 1933, los trabajadores holandeses informaron del aislamiento de Leptospira canicola, que infecta específicamente a los perros. En 1940, la cepa que infecta específicamente al ganado se informó por primera vez en Rusia. En 1942, se registró que los soldados de Fort Bragg , Carolina del Norte , tenían una enfermedad infecciosa que les causaba un sarpullido en las espinillas . Más tarde se supo que esta enfermedad era causada por leptospirosis. En la década de 1950, el número de serovares que infectaban a varios mamíferos se había expandido significativamente. En la década de 1980, la leptospirosis fue reconocida como una enfermedad veterinaria de gran importancia económica.
En 1982, había alrededor de 200 serovares de Leptospira disponibles para su clasificación. El subcomité de taxonomía de Leptospira del Comité Internacional de Bacteriología Sistemática propuso clasificar estos serovares en dos grandes grupos: L. interrogans que contiene serovares patógenos y L. biflexa que contiene serovares saprofitos. En 1979, se propuso la familia de las leptospiras de Leptospiraceae . En el mismo año, Leptospira illini fue reclasificada como el nuevo género Leptonema . En 2002, se acuñó el "síndrome de Lepthangamushi" para describir una serie de síntomas superpuestos de leptospirosis con fiebre hemorrágica por hantavirus con síndrome renal y tifus de los matorrales causado por Orientia tsutsugamushi . En 2005, Leptospira parva se clasificó como Turneriella . Con la tecnología de hibridación ADN-ADN , L. interrogans se dividió en siete especies. Desde entonces se han descubierto más especies de Leptospira . La OMS estableció el Grupo de Referencia de Epidemiología de la Carga de la Leptospirosis (LERG) para revisar los últimos datos epidemiológicos de la leptospirosis, formular un modelo de transmisión de la enfermedad e identificar lagunas en el conocimiento y la investigación. La primera reunión se convocó en 2009. En 2011, LERG estimó que la tasa anual mundial de leptospirosis es de cinco a 14 casos por 100.000 habitantes.
Otros animales
Los animales infectados pueden presentar síntomas leves, graves o nulos; los síntomas de presentación pueden variar según el tipo de animal. En algunos animales, las bacterias viven en el tracto reproductivo, lo que lleva a la transmisión durante el apareamiento.
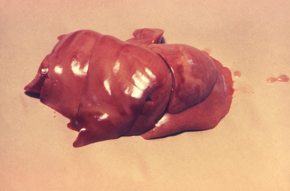
Los animales también presentan características clínicas similares en comparación con los humanos. Los signos clínicos pueden aparecer en 5 a 15 días en perros. El período de incubación se puede prolongar en gatos. La leptospirosis puede causar abortos después de 2 a 12 semanas en el ganado y de 1 a 4 semanas de infección en los cerdos. La enfermedad tiende a ser más leve en huéspedes reservorios. Los órganos más comúnmente afectados son los riñones, el hígado y el sistema reproductivo, pero otros órganos pueden verse afectados. En los perros, los signos clínicos agudos incluyen fiebre, pérdida de apetito , escalofríos, dolor muscular, debilidad y síntomas urinarios. También pueden presentarse vómitos, diarrea y dolor abdominal. Pueden observarse petequias y equimosis en las membranas mucosas. También se puede observar sangrado de los pulmones en perros. En presentaciones crónicas, el perro afectado puede no presentar síntomas. En los animales que han muerto de leptospirosis, sus riñones pueden estar hinchados con manchas grises y blancas, moteadas o cicatrices. Su hígado puede agrandarse con áreas de muerte celular . Se pueden encontrar petequias y equimosis en varios órganos. También son posibles la inflamación de los vasos sanguíneos , la inflamación del corazón, las capas meníngeas que cubren el cerebro y la médula espinal y la uveítis . La uveítis recurrente equina (URE) es la enfermedad más común asociada con la infección por Leptospira en caballos en América del Norte y puede provocar ceguera. ERU es una enfermedad autoinmune en la que los anticuerpos contra las proteínas de Leptospira LruA y LruB reaccionan de forma cruzada con las proteínas oculares. La Leptospira viva se puede recuperar del líquido acuoso o vítreo de muchos caballos con ERU asociada a Leptospira . El riesgo de muerte o discapacidad en los animales infectados varía según la especie y la edad de los animales. En cerdos y bovinos adultos, los signos reproductivos son los signos más comunes de leptospirosis. Hasta el 40% de las vacas pueden tener un aborto espontáneo. Los animales más jóvenes suelen desarrollar enfermedades más graves. Aproximadamente el 80% de los perros pueden sobrevivir con tratamiento, pero la tasa de supervivencia se reduce si los pulmones están afectados.
Las pruebas ELISA y de aglutinación microscópica se utilizan con mayor frecuencia para diagnosticar la leptospirosis en animales. Las bacterias pueden detectarse en sangre, orina y leche o en muestras de hígado, riñón u otros tejidos mediante técnicas de inmunofluorescencia o inmunohistoquímica o reacción en cadena de la polimerasa. La tinción con plata o inmuno-tinción con plata se utiliza para detectar Leptospira en cortes de tejido. Los organismos se tiñen mal con la tinción de Gram . La microscopía de campo oscuro se puede utilizar para detectar Leptospira en los fluidos corporales, pero no es sensible ni específica para detectar el organismo. Un cultivo positivo para leptospirosis es definitivo, pero la disponibilidad es limitada y los resultados del cultivo pueden tardar entre 13 y 26 semanas para obtener un resultado, lo que limita su utilidad. Se prefieren las muestras pareadas de pacientes agudos y convalecientes para el diagnóstico serológico de leptospirosis en animales. Una muestra serológica positiva de un feto abortado también es diagnóstica de leptospirosis.
Se han utilizado varios antibióticos como doxiciclina, penicilinas, dihidroestreptomicina y estreptomicina para tratar la leptospirosis en animales. En caso de enfermedad grave, es posible que se requiera fluidoterapia, transfusión de sangre y asistencia respiratoria. Para los caballos con ERU, el tratamiento principal es con medicamentos antiinflamatorios.
Las vacunas contra la leptospirosis están disponibles para animales como cerdos, perros, ganado, ovejas y cabras. Las vacunas para bovinos suelen contener Leptospira serovar Hardjo y Pomona, para perros, las vacunas suelen contener serovar Icterohaemorrhagiae y Canicola. Las vacunas que contienen múltiples serovariedades no funcionan tan bien en el ganado bovino como las vacunas que contienen un solo serovar, pero las vacunas multivalentes continúan vendiéndose. El aislamiento de animales infectados y los antibióticos profilácticos también son eficaces para prevenir la transmisión de leptospirosis entre animales. El control ambiental y el saneamiento también reducen las tasas de transmisión.
Referencias
enlaces externos
- "Leptospirosis" . Centro de Prevención y Control de Enfermedades de EE. UU. 21 de noviembre de 2018.
- " Leptospira " . Navegador de taxonomía NCBI. 171.
| Clasificación | |
|---|---|
| Recursos externos |