Mancha del sur - Southern blot
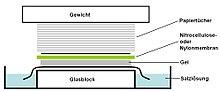


Un Southern blot es un método utilizado en biología molecular para la detección de una secuencia de ADN específica en muestras de ADN. La transferencia Southern combina la transferencia de fragmentos de ADN separados por electroforesis a una membrana de filtro y la posterior detección de fragmentos mediante hibridación de sonda .
El método lleva el nombre del biólogo británico Edwin Southern , quien lo publicó por primera vez en 1975. Otros métodos de transferencia (es decir, transferencia occidental , transferencia septentrional , transferencia oriental , transferencia suroeste ) que emplean principios similares, pero que utilizan ARN o proteínas, se han utilizado posteriormente. nombrado en referencia al nombre de Edwin Southern. Como la etiqueta es epónima , Southern se escribe con mayúscula, como es convencional de los nombres propios . Los nombres de otros métodos de transferencia pueden seguir esta convención, por analogía.
Método
- Las endonucleasas de restricción se utilizan para cortar cadenas de ADN de alto peso molecular en fragmentos más pequeños.
- A continuación, los fragmentos de ADN se someten a electroforesis en un gel de agarosa para separarlos por tamaño.
- Si algunos de los fragmentos de ADN tienen un tamaño superior a 15 kb , antes de la transferencia, el gel puede tratarse con un ácido, como HCl diluido . Esto depuriza los fragmentos de ADN, rompiendo el ADN en trozos más pequeños, lo que permite una transferencia más eficiente del gel a la membrana.
- Si se utilizan métodos de transferencia alcalina, el gel de ADN se coloca en una solución alcalina (que normalmente contiene hidróxido de sodio ) para desnaturalizar el ADN de doble hebra. La desnaturalización en un ambiente alcalino puede mejorar la unión de los residuos de timina cargados negativamente del ADN a un grupo amino cargado positivamente de la membrana, separándolo en cadenas simples de ADN para la hibridación posterior con la sonda (ver más abajo) y destruye cualquier ARN residual que pueda todavía estar presente en el ADN. Sin embargo, la elección de métodos de transferencia alcalinos sobre neutrales es a menudo empírica y puede dar lugar a resultados equivalentes.
- Se coloca una lámina de nitrocelulosa (o, alternativamente, nailon ) membrana encima (o debajo, según la dirección de la transferencia) del gel. La presión se aplica de manera uniforme al gel (ya sea mediante succión o colocando una pila de toallas de papel y un peso encima de la membrana y el gel), para asegurar un buen y uniforme contacto entre el gel y la membrana. Si se transfiere por succión, se usa tampón SSC 20X para asegurar un sellado y evitar que el gel se seque. La transferencia de tampón por acción capilar desde una región de alto potencial hídrico a una región de bajo potencial hídrico (generalmente papel de filtro y pañuelos de papel) se usa luego para mover el ADN del gel a la membrana; Las interacciones de intercambio iónico unen el ADN a la membrana debido a la carga negativa del ADN y la carga positiva de la membrana.
- Luego, la membrana se cuece al vacío o en un horno regular a 80 ° C durante 2 horas (condiciones estándar; nitrocelulosa o membrana de nailon) o se expone a radiación ultravioleta (membrana de nailon) para unir permanentemente el ADN transferido a la membrana.
- Luego, la membrana se expone a una sonda de hibridación, un solo fragmento de ADN con una secuencia específica cuya presencia en el ADN diana debe determinarse. El ADN de la sonda se marca para que pueda detectarse, normalmente incorporando radiactividad o marcando la molécula con un tinte fluorescente o cromogénico . En algunos casos, la sonda de hibridación puede estar hecha de ARN, en lugar de ADN. Para asegurar la especificidad de la unión de la sonda al ADN de la muestra, los métodos de hibridación más comunes utilizan ADN de esperma de salmón o arenque para bloquear la superficie de la membrana y el ADN diana, formamida desionizada y detergentes como SDS para reducir la unión no específica de la sonda.
- Después de la hibridación, el exceso de sonda se lava de la membrana (normalmente usando tampón SSC ) y el patrón de hibridación se visualiza en una película de rayos X por autorradiografía en el caso de una sonda radiactiva o fluorescente, o por desarrollo de color en la membrana si se utiliza un método de detección cromogénico.
Resultado
La hibridación de la sonda con un fragmento de ADN específico en la membrana del filtro indica que este fragmento contiene una secuencia de ADN que es complementaria a la sonda. El paso de transferencia del ADN del gel de electroforesis a una membrana permite unir fácilmente la sonda de hibridación marcada al ADN fraccionado por tamaño. También permite la fijación de los híbridos objetivo-sonda, necesarios para el análisis por autorradiografía u otros métodos de detección. Las transferencias Southern realizadas con ADN genómico digerido con enzimas de restricción pueden usarse para determinar el número de secuencias (por ejemplo, copias de genes) en un genoma . Una sonda que se hibrida solo con un solo segmento de ADN que no ha sido cortado por la enzima de restricción producirá una sola banda en una transferencia Southern, mientras que es probable que se observen múltiples bandas cuando la sonda hibrida con varias secuencias muy similares (p. Ej., Aquellas que puede ser el resultado de la duplicación de la secuencia). Se puede usar la modificación de las condiciones de hibridación (por ejemplo, aumentando la temperatura de hibridación o disminuyendo la concentración de sal) para aumentar la especificidad y disminuir la hibridación de la sonda con secuencias que son menos del 100% similares.
Aplicaciones
La transferencia de transferencia de Southern puede usarse para la clonación basada en homología sobre la base de la secuencia de aminoácidos del producto proteico del gen diana. Los oligonucleótidos se diseñan para que sean similares a la secuencia diana. Los oligonucleótidos se sintetizan químicamente, se marcan radiactivamente y se utilizan para cribar una biblioteca de ADN u otras colecciones de fragmentos de ADN clonados. Las secuencias que hibridan con la sonda de hibridación se analizan adicionalmente, por ejemplo, para obtener la secuencia de longitud completa del gen diana.
La transferencia Southern también se puede usar para identificar sitios metilados en genes particulares. Particularmente útiles son las nucleasas de restricción MspI y HpaII , ambos de los que reconocen y escinden dentro de la misma secuencia. Sin embargo, HpaII requiere que una C dentro de ese sitio esté metilado, mientras que MspI escinde solo el ADN no metilado en ese sitio. Por lo tanto, cualquier sitio metilado dentro de una secuencia analizada con una sonda particular será escindido por la primera, pero no por la última, enzima.
Ver también
- Electroforesis en gel de ácidos nucleicos
- Fragmento de restricción
- Huella genética
- Mancha del norte
- Western blot
- Mancha oriental
- Mancha suroeste
- Mancha del noroeste
Referencias
- ^ "Southern Blot" .
- ^ Southern, Edwin Mellor (5 de noviembre de 1975). "Detección de secuencias específicas entre fragmentos de ADN separados por electroforesis en gel". Revista de Biología Molecular . 98 (3): 503–517. doi : 10.1016 / S0022-2836 (75) 80083-0 . ISSN 0022-2836 . PMID 1195397 .
- ^ Towbin; Staehelin, T; Gordon, J; et al. (1979). "Transferencia electroforética de proteínas desde geles de poliacrilamida a láminas de nitrocelulosa: procedimiento y algunas aplicaciones" . PNAS . 76 (9): 4350–4. Código Bibliográfico : 1979PNAS ... 76.4350T . doi : 10.1073 / pnas.76.9.4350 . PMC 411572 . PMID 388439 .
- ^ Burnette, W. Neal (abril de 1981). "Western Blot: transferencia electroforética de proteínas de geles de poliacrilamida-dodecil sulfato de sodio a nitrocelulosa no modificada y detección radiográfica con anticuerpo y proteína A radioyodada". Bioquímica analítica . 112 (2): 195-203. doi : 10.1016 / 0003-2697 (81) 90281-5 . ISSN 0003-2697 . PMID 6266278 .
- ^ Bioquímica tercera edición, Matthews, Van Holde et al, Addison Wesley Publishing, pg 977
enlaces externos
|
Recursos de la biblioteca sobre Southern blot |

