Protamina - Protamine
| Protamina 1 | |||||||
|---|---|---|---|---|---|---|---|
| Identificadores | |||||||
| Símbolo | PRM1 | ||||||
| Gen NCBI | 5619 | ||||||
| HGNC | 9447 | ||||||
| OMIM | 182880 | ||||||
| RefSeq | NM_002761 | ||||||
| UniProt | P04553 | ||||||
| Otros datos | |||||||
| Lugar | Chr. 16 p13.13 | ||||||
| |||||||
| Protamina 2 | |||||||
|---|---|---|---|---|---|---|---|
| Identificadores | |||||||
| Símbolo | PRM2 | ||||||
| Gen NCBI | 5620 | ||||||
| HGNC | 9448 | ||||||
| OMIM | 182890 | ||||||
| RefSeq | NM_002762 | ||||||
| UniProt | P04554 | ||||||
| Otros datos | |||||||
| Lugar | Chr. 16 p13.13 | ||||||
| |||||||
Las protaminas son proteínas nucleares pequeñas, ricas en arginina , que reemplazan a las histonas al final de la fase haploide de la espermatogénesis y se cree que son esenciales para la condensación de la cabeza de los espermatozoides y la estabilización del ADN . Pueden permitir un empaquetamiento más denso de ADN en el espermatozoide que las histonas, pero deben descomprimirse antes de que los datos genéticos puedan usarse para la síntesis de proteínas. Sin embargo, en los humanos y tal vez en otros primates, el 10-15% del genoma del esperma está empaquetado por histonas que se cree que se unen a genes que son esenciales para el desarrollo embrionario temprano.
Las proteínas protamina y similares a protamina (PL) se conocen colectivamente como proteínas básicas nucleares específicas de los espermatozoides (SNBP). Las proteínas PL son de estructura intermedia entre la protamina y la histona H1 . El dominio C-terminal de PL podría ser el precursor de la protamina de vertebrados.
Espermatogénesis
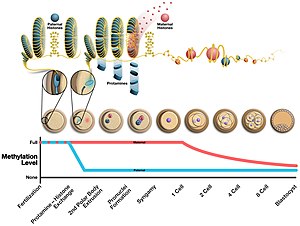
Durante la formación de los espermatozoides, la protamina se une a la columna vertebral de fosfato del ADN utilizando el dominio rico en arginina como ancla. Luego, el ADN se pliega en un toroide , una estructura en forma de O, aunque se desconoce el mecanismo. Un espermatozoide puede contener hasta 50.000 estructuras en forma de toroide en su núcleo y cada toroide contiene alrededor de 50 kilobases. Antes de que se forme el toroide, las histonas se eliminan del ADN mediante proteínas nucleares de transición , de modo que la protamina pueda condensarlo. Los efectos de este cambio son 1) un aumento en la hidrodinámica de los espermatozoides para un mejor flujo a través de los líquidos al reducir el tamaño de la cabeza 2) una disminución en la aparición de daño en el ADN 3) la eliminación de los marcadores epigenéticos que ocurren con las modificaciones de histonas.
La estructura de la cabeza del esperma también está relacionada con los niveles de protamina. Se ha descubierto que la proporción de protamina 2 a protamina 1 y proteínas nucleares de transición cambia la forma de la cabeza del esperma en varias especies de ratones, al alterar la expresión de protamina 2 a través de mutaciones en su región promotora. Se ha descubierto que una disminución en la proporción aumenta la capacidad competitiva de los espermatozoides en las especies de Mus . Sin embargo, se requieren más pruebas para determinar cómo esta relación influye en la forma de la cabeza y si la monogamia influye en esta selección. En los seres humanos, los estudios muestran que los hombres que tienen Prm1 / Prm2 desequilibrados son subfértiles o infértiles. La protamina 2 está codificada como una proteína más larga que necesita su N-terminal escindido antes de volverse funcional. La protamina humana y de chimpancé ha experimentado una rápida evolución.
Usos médicos
Cuando se mezclan con insulina , las protaminas ralentizan el inicio y aumentan la duración de la acción de la insulina (ver Insulina NPH ).
La protamina se usa en cirugía cardíaca, cirugía vascular y procedimientos de radiología intervencionista para neutralizar los efectos anticoagulantes de la heparina . Los efectos adversos incluyen aumento de la presión arterial pulmonar y disminución de la presión arterial periférica, consumo de oxígeno del miocardio, gasto cardíaco y frecuencia cardíaca.
El sulfato de protamina es un antídoto para la sobredosis de heparina , pero puede producirse una alergia grave. Una versión de cadena corta de protamina también actúa como un potente antagonista de la heparina, pero con una antigenicidad notablemente reducida . Se produce inicialmente como una mezcla hecha por termolisina digestión de protamina, pero la parte de péptido eficaz real VSRRRRRRGGRRRRdesde entonces ha sido aislado. También se ha producido un análogo de este péptido.
En la terapia génica, la capacidad del sulfato de protamina para condensar el ADN plasmídico junto con su aprobación por la Administración de Drogas y Alimentos de los EE. UU . (FDA) lo ha convertido en un candidato atractivo para aumentar las tasas de transducción mediante la administración mediada por virus y no virales (por ejemplo, utilizando liposomas catiónicos). mecanismos.
La protamina se puede utilizar como fármaco para prevenir la obesidad. Se ha demostrado que la protamina disuade los aumentos de peso corporal y las lipoproteínas de baja densidad en ratas de dieta alta en grasas. Este efecto se produce a través de la inhibición de la actividad de la lipasa , una enzima responsable de la digestión y absorción de triacilglicerol , lo que resulta en una disminución en la absorción de las grasas de la dieta. No se encontró daño hepático cuando las ratas fueron tratadas con protamina. Sin embargo, la emulsificación de ácidos grasos de cadena larga para la digestión y absorción en el intestino delgado es menos constante en los seres humanos que en las ratas, lo que variará la eficacia de la protamina como fármaco. Además, las peptidasas humanas pueden degradar la protamina a diferentes velocidades, por lo que se requieren más pruebas para determinar la capacidad de la protamina para prevenir la obesidad en los seres humanos.
Distribución de especies e isoformas
Los ratones, los seres humanos y ciertos peces tienen dos o más protaminas diferentes, mientras que los espermatozoides de toro y jabalí tienen una forma de protamina debido a una mutación en el gen PRM2. En la rata, aunque el gen de PRM2 está presente, la expresión de esta proteína es extremadamente pequeña debido a la transcripción limitada debido a un promotor ineficaz además del procesamiento alterado de la transcripción del ARNm.
Mamíferos
Las 2 protaminas humanas se denominan PRM1 y PRM2 . En ratones y humanos, PRM1, PRM2 y TRN2 se encuentran en el mismo grupo de genes .
Los mamíferos euterios generalmente tienen tanto PRM1 como PRM2. Los metaterianos, por otro lado, solo tienen un homólogo de P1.
Pez
Ejemplos de protaminas de pescado son:
- salmín y sulfato de protamina de salmón
- clupeína de esperma de arenque ( Clupea )
- iridina de trucha arcoiris
- thinnine de atún ( Thunnus )
- stelline de esturión estrellado ( Acipenser stellatus )
- scylliorhinine de mielga ( Scylliorhinus )
Las protaminas de pescado son generalmente más cortas que las de los mamíferos, con una mayor cantidad de arginina.
Secuencia
| Protamina P1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | Protamine_P1 | ||||||||
| Pfam | PF00260 | ||||||||
| InterPro | IPR000221 | ||||||||
| PROSITE | PDOC00047 | ||||||||
| |||||||||
| Protamina P2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | Protamine_P2 | ||||||||
| Pfam | PF00841 | ||||||||
| InterPro | IPR000492 | ||||||||
| |||||||||
La estructura primaria de la protamina P1, la protamina utilizada para empaquetar el ADN en los espermatozoides, en los mamíferos placentarios suele tener una longitud de 49 o 50 aminoácidos. Esta secuencia se divide en tres dominios separados: un dominio rico en arginina para la unión de ADN flanqueado por secuencias de péptidos más cortas que contienen principalmente residuos de cisteína. El dominio rico en arginina consta de 3-11 residuos de arginina y se conserva entre las secuencias de protamina de pez y protamina 1 de mamífero en aproximadamente un 60-80% de identidad de secuencia.
Estructura
Después de la traducción, la estructura de la protamina P1 se fosforila inmediatamente en los tres dominios mencionados anteriormente. Otra ronda de fosforilación ocurre cuando los espermatozoides ingresan al óvulo, pero la función de estas fosforilaciones es incierta.
La estructura secundaria y terciaria exacta de la protamina no se conoce con certeza, pero se han publicado varias propuestas desde la década de 1970. El amplio consenso es que la protamina forma estructuras de cadena beta que luego se entrecruzan a través de enlaces disulfuro (y potencialmente enlaces ditirosina y cisteína-tirosina). Cuando la protamina P1 se une al ADN, la cisteína del extremo amino de una protamina P1 forma enlaces disulfuro con la cisteína del extremo carboxi de otra protamina P1. Al neutralizar la carga de la columna vertebral, la protamina permite que el ADN se enrolle más firmemente. Los enlaces disulfuro funcionan para evitar la disociación de la protamina P1 del ADN hasta que los enlaces se reducen cuando el esperma entra en el óvulo. Estos polímeros de protamina largos pueden luego envolver el ADN dentro del surco principal.
Ver también
Referencias
enlaces externos
- Protaminas en los títulos de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .
- V03AB14 ( OMS )

