Plasmodium knowlesi -Plasmodium knowlesi
| Plasmodium knowlesi | |
|---|---|
|
|
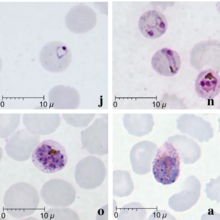
| Frotis teñidos con Giemsa de Plasmodium knowlesi que infectan glóbulos rojos humanos | |
|
clasificación cientifica |
|
| (no clasificado): | Diaphoretickes |
| Clade : | ZAR |
| Clade : | SAR |
| Infrareino: | Alveolata |
| Filo: | Apicomplexa |
| Clase: | Aconoidasida |
| Pedido: | Hemospororida |
| Familia: | Plasmodiidae |
| Género: | Plasmodium |
| Especies: |
P. knowlesi
|
| Nombre binomial | |
|
Plasmodium knowlesi Sinton y Mulligan 1932
|
|
Plasmodium knowlesi es un parásito que causa malaria en humanos y otros primates. Se encuentra en todo el sudeste asiático y es la causa más común de paludismo humano en Malasia . Como otrasespecies de Plasmodium , P. knowlesi tiene un ciclo de vida que requiere la infección tanto de un mosquito como de un huésped de sangre caliente. Si bien los huéspedes naturales de sangre caliente de P. knowlesi son probablemente varios monos del Viejo Mundo , los humanos pueden ser infectados por P. knowlesi si son alimentados por mosquitos infectados. P. knowlesi es un eucariota del filo Apicomplexa , género Plasmodium y subgénero Plasmodium . Está más estrechamente relacionado con el parásito humano Plasmodium vivax , así como con otrasespecies de Plasmodium que infectan a primates no humanos.
Los seres humanos infectados con P. knowlesi pueden desarrollar un paludismo grave o sin complicaciones similar al causado por Plasmodium falciparum . El diagnóstico de la infección por P. knowlesi es un desafío, ya que P. knowlesi se parece mucho a otras especies que infectan a los seres humanos. El tratamiento es similar a otros tipos de paludismo, por lo que normalmente se recomienda una terapia combinada de cloroquina o artemisinina . El paludismo por P. knowlesi es una enfermedad emergente que antes se pensaba que era poco común en los seres humanos, pero que se reconoce cada vez más como una importante carga para la salud en el sudeste asiático.
P. knowlesi se describió por primera vez como una especie distinta y como una posible causa de paludismo humano en 1932. Se utilizó brevemente a principios del siglo XX para causar fiebre como tratamiento para la neurosífilis . A mediados del siglo XX, P. knowlesi se hizo popular como herramienta para estudiar la biología de Plasmodium y se utilizó para la investigación básica, la investigación de vacunas y el desarrollo de fármacos. P. knowlesi todavía se utiliza como modelo de laboratorio para la malaria, ya que infecta fácilmente al primate modelo, el macaco rhesus , y puede cultivarse en cultivo celular en sangre humana o de macaco.
Ciclo vital
Al igual que otros parásitos de Plasmodium , P. knowlesi tiene un ciclo de vida que requiere que se transmita entre los huéspedes mamíferos y los huéspedes insectos. Los primates se infectan a través de la picadura de un mosquito Anopheles infectado que lleva una etapa de parásito llamada esporozoito en sus glándulas salivales. Esporozoitos siguen el flujo de sangre al hígado de primates donde se desarrollan y replicarán a través de cinco a seis días antes de estallar, liberando miles de células hijas llamadas merozoitos en la sangre (a diferencia de los relacionados con P. vivax , P. knowlesi no hace latentes hipnozoítos en el hígado). Los merozoitos en la sangre se adhieren e invaden los glóbulos rojos del primate . Dentro del glóbulo rojo, el parásito progresa a través de varias etapas morfológicamente distinguibles, llamadas etapa de anillo, trofozoíto y esquizonte. Los glóbulos rojos infectados con esquizontes eventualmente explotan, liberando hasta 16 nuevos merozoitos en el torrente sanguíneo que infectan nuevos glóbulos rojos y continúan el ciclo. P. knowlesi completa este ciclo de glóbulos rojos cada 24 horas, lo que lo hace excepcionalmente rápido entre las especies de Plasmodium que infectan a los primates (que generalmente demoran entre 48 y 72 horas). Ocasionalmente, los parásitos que invaden los glóbulos rojos entran en un ciclo sexual, desarrollándose durante aproximadamente 48 horas en formas sexuales distintas llamadas microgametocitos o macrogametocitos. Estos gametocitos permanecen en la sangre para ser ingeridos por los mosquitos.
Un mosquito ingiere gametocitos cuando ingiere sangre de un primate huésped infectado. Una vez dentro del intestino del mosquito, los gametocitos se convierten en gametos y luego se fusionan para formar un cigoto diploide . El cigoto madura en un ookinete , que migra a través de la pared del intestino del mosquito y se convierte en un ooquiste . Luego, el ooquiste libera miles de esporozoitos, que migran a través del mosquito a las glándulas salivales. Todo este proceso en el mosquito toma de 12 a 15 días.
Biología Celular
P. knowlesi se parece mucho a otras especies de Plasmodium en su biología celular. Su genoma consta de 23,5 megabases de ADN separadas en 14 cromosomas . Contiene aproximadamente 5200 genes que codifican proteínas, 80% de los cuales tienen ortólogos presentes en P. falciparum y P. vivax . El genoma contiene dos grandes familias de genes que son exclusivas de P. knowlesi : la familia SICAvar (variante de aglutinación de células infectadas por esquizontes), que participa en la exhibición de diferentes antígenos en la superficie del parásito para evadir el sistema inmunológico, y el Kir (knowlesi intercalado repetir) familia, involucrada en la adhesión de glóbulos rojos parasitados a las paredes de los vasos sanguíneos.
Como apicomplexano , P. knowlesi tiene varias estructuras distintivas en su extremo apical que están especializadas para invadir las células huésped. Éstos incluyen las grandes roptrías bulbosas , las microagujas más pequeñas y los gránulos densos dispersos , cada uno de los cuales secreta efectores para entrar y modificar la célula huésped. Al igual que otros apicomplejos, P. knowlesi también tiene dos orgánulos de origen endosimbiótico : una única mitocondria grande y el apicoplasto , ambos involucrados en el metabolismo del parásito .
Evolución y taxonomía
A pesar de su similitud morfológica con P. malariae , P. knowlesi está más estrechamente relacionado con P. vivax , así como con otras especies de Plasmodium que infectan primates no humanos. El último ancestro común de todas las cepas modernas de P. knowlesi vivió hace aproximadamente entre 98.000 y 478.000 años. Entre los parásitos humanos, P. knowlesi está más estrechamente relacionado con P. vivax , del que se separó hace entre 18 y 34 millones de años. A continuación se muestra un árbol filogenético que compara las especies de Plasmodium que infectan a los humanos:
| Subgénero Plasmodium |
|
||||||||||||||||||
La población de parásitos de P. knowlesi es genéticamente más diversa que la de P. falciparum o P. vivax . Dentro de P. knowlesi hay tres subpoblaciones genéticamente distintas. Dos están presentes en las mismas áreas de Borneo malasio y pueden infectar a diferentes mosquitos. El tercero se ha encontrado solo en aislamientos de laboratorio procedentes de otras partes del sudeste asiático. Las poblaciones de P. knowlesi aisladas de macacos son genéticamente indistinguibles de las aisladas de infecciones humanas, lo que sugiere que las mismas poblaciones de parásitos pueden infectar a humanos y macacos indistintamente.
Se han descrito tres subespecies de P. knowlesi en función de las diferencias en su apariencia en los frotis de sangre teñidos: P. knowlesi edesoni , P. knowlesi sintoni y P. knowlesi arimai , que se aislaron de Malasia, Java y Taiwán, respectivamente. La relación entre estas subespecies descritas y las poblaciones descritas en la literatura moderna no está clara.
Distribución
Plasmodium knowlesi se encuentra en todo el sudeste asiático , donde infecta principalmente al macaco de cola larga , al macaco de cola de cerdo y al surili de Sumatra , así como a los mosquitos vectores Anopheles hackeri en Malasia peninsular y Anopheles latens en Sarawak . Los macacos de cola larga en la naturaleza pueden infectarse con P. knowlesi sin ninguna enfermedad aparente, incluso cuando están infectados simultáneamente con varias otras especies de Plasmodium . P. knowlesi rara vez se encuentra fuera del sudeste asiático, probablemente porque los mosquitos que infecta están restringidos a esa región.
Papel en la enfermedad humana
P. knowlesi puede causar paludismo grave y sin complicaciones en los seres humanos. Los infectados casi siempre experimentan fiebre y escalofríos . Las personas con paludismo por P. knowlesi no complicado a menudo también experimentan dolores de cabeza, dolor en las articulaciones, malestar y pérdida de apetito. Con menos frecuencia, las personas informan tos, dolor abdominal, diarrea, náuseas y vómitos. Las pruebas de laboratorio de las personas infectadas casi siempre muestran un recuento de plaquetas bajo , aunque esto rara vez conduce a problemas de sangrado. A diferencia de otras malarias humanas, la malaria por P. knowlesi tiende a tener fiebres que aumentan cada 24 horas y, por lo tanto, a menudo se la denomina malaria diaria o "cotidiana". El paludismo por P. knowlesi no complicado se puede tratar con medicamentos antipalúdicos .
Al menos el 10% de las personas infectadas por P. knowlesi desarrollan paludismo grave. El paludismo grave por P. knowlesi se parece al paludismo grave causado por P. falciparum . Las personas con una enfermedad grave pueden experimentar dificultad para respirar, dolor abdominal y vómitos. A medida que avanza la enfermedad, los parásitos se replican a niveles muy altos en la sangre, probablemente causando daño renal agudo, ictericia , shock y dificultad respiratoria. La acidosis metabólica es poco común, pero puede ocurrir en casos particularmente graves. A diferencia del paludismo por P. falciparum , el paludismo grave por P. knowlesi rara vez causa coma o anemia grave . Aproximadamente el 1-2% de los casos son fatales.
Diagnóstico
La malaria se diagnostica tradicionalmente examinando frotis de sangre teñidos con Giemsa bajo un microscopio; sin embargo, diferenciar P. knowlesi de otras especies de Plasmodium de esta manera es un desafío debido a su apariencia similar. Los parásitos en etapa de anillo de P. knowlesi teñidos con Giemsa se asemejan a las etapas de anillo de P. falciparum y aparecen como un círculo con uno o dos puntos oscuros de cromatina . Los trofozoítos más viejos aparecen más dispersos, formando una forma rectangular que se extiende a través de la célula huésped llamada "forma de banda" que se asemeja a la etapa similar de P. malariae . Durante esta etapa, a veces aparecen puntos a través del glóbulo rojo del huésped, llamados "punteado de Sinton y Mulligans". Los esquizontes aparecen, de manera similar a otras especies de Plasmodium , como grupos de merozoitos púrpuras que rodean un pigmento central de color oscuro.
Debido a la similitud morfológica entre las especies de Plasmodium , es común el diagnóstico erróneo de la infección por P. knowlesi como P. falciparum , P. malariae o P. vivax . Si bien algunas pruebas de diagnóstico rápido pueden detectar P. knowlesi , tienden a tener poca sensibilidad y especificidad y, por lo tanto, no siempre son confiables. La detección de ácido nucleico por PCR o PCR en tiempo real es el método más confiable para detectar P. knowlesi y diferenciarlo de la infección por otras especies de Plasmodium . Sin embargo, debido a la naturaleza relativamente lenta y costosa de la PCR, esta no está disponible en muchas áreas endémicas. También se han desarrollado métodos de amplificación isotérmica mediada por bucles de detección de P. knowlesi , pero todavía no se utilizan ampliamente.
Tratamiento
Debido a que P. knowlesi tarda solo 24 horas en completar su ciclo eritrocítico, puede resultar rápidamente en niveles muy altos de parasitemia con consecuencias fatales. Para aquellos con malaria sin complicaciones , la Organización Mundial de la Salud recomienda el tratamiento con terapia combinada a base de artemisinina (ACT) o cloroquina . Para aquellos con paludismo grave , la Organización Mundial de la Salud recomienda la administración de artesunato intravenoso durante al menos 24 horas, seguido de un tratamiento con ACT. Además, los primeros ensayos de fármacos han sugerido que las combinaciones de cloroquina y primaquina , artesunato y mefloquina , arteméter y lumefantrina , y la cloroquina sola podrían ser tratamientos eficaces para el paludismo por P. knowlesi no complicado . No hay evidencia de que P. knowlesi desarrolle resistencia a los antipalúdicos actuales.
Epidemiología
P. knowlesi es la causa más común de paludismo en Malasia y se han notificado casos de paludismo por P. knowlesi en la mayoría de los países del sudeste asiático, así como en viajeros de la región.
La infección por P. knowlesi está asociada con factores socioeconómicos y de estilo de vida que llevan a las personas a los densos bosques donde comúnmente se encuentran los mosquitos huéspedes. En particular, quienes trabajan en el bosque o en sus márgenes, como agricultores, cazadores y madereros, tienen un mayor riesgo de infección. Probablemente por esta razón, los hombres se infectan con más frecuencia que las mujeres y los adultos se infectan con más frecuencia que los niños.
Investigar
P. knowlesi se ha utilizado durante mucho tiempo como modelo de investigación para estudiar la interacción entre el parásito y el huésped y desarrollar vacunas y fármacos antipalúdicos. Su utilidad como modelo de investigación se debe en parte a su capacidad para infectar macacos rhesus, un primate modelo común de laboratorio. Los macacos Rhesus son muy susceptibles a P. knowlesi y pueden infectarse por picadura de mosquito, inyección de esporozoitos o inyección de parásitos en etapa sanguínea. Los monos infectados desarrollan algunas características de la malaria humana, incluida la anemia y el agrandamiento del bazo y el hígado. La infección suele ser fatal si no se trata, y la causa de la muerte parece ser una falla circulatoria caracterizada por la adhesión de glóbulos rojos infectados a las paredes de los vasos sanguíneos . Los monos pueden curarse de la infección mediante el tratamiento con antipalúdicos; la infección repetida seguida de la curación da como resultado que los monos desarrollen cierta inmunidad a la infección, un tema que también ha sido objeto de una investigación sustancial.
P. knowlesi también se utiliza para la investigación in vitro de la biología celular de Plasmodium . Los esporozoitos aislados pueden infectar hepatocitos rhesus primarios , lo que permite el estudio in vitro del estadio hepático del parásito. Además, P. knowlesi y P. falciparum son las únicas especies de Plasmodium que se pueden mantener continuamente en glóbulos rojos cultivados , tanto rhesus como humanos. Para facilitar la investigación en biología molecular, el genoma de P. knowlesi se ha secuenciado y está disponible en PlasmoDB y otros repositorios en línea. P. knowlesi puede modificarse genéticamente en el laboratorio mediante transfección en el sistema modelo del macaco rhesus o en cultivo de células sanguíneas. Los estadios que infectan la sangre y los esporozoitos se pueden almacenar a largo plazo mediante la congelación con glicerolito , lo que permite la preservación de las cepas de interés.
Historia
El médico italiano Giuseppe Franchini describió por primera vez lo que pudo haber sido P. knowlesi en 1927 cuando notó un parásito distinto de P. cynomolgi y P. inui en la sangre de un macaco de cola larga. En 1931, HGM Campbell volvió a ver el parásito en un macaco de cola larga durante su trabajo sobre kala azar ( leishmaniasis visceral ) en Calcuta ; El colega de Campbell, Lionel Everard Napier, extrajo sangre del mono afectado e inoculó a tres monos de laboratorio, uno de los cuales era un macaco rhesus que desarrolló una infección grave. Campbell y Napier le dieron el mono infectado a Biraj Mohan Das Gupta, quien pudo mantener el parásito mediante pases seriados a través de monos. En 1932, Das Gupta y su supervisor Robert Knowles describieron la morfología del parásito en sangre de macaco y demostraron que podía infectar a tres pacientes humanos (en cada caso se utilizó para inducir fiebre con la esperanza de tratar otra infección). También en 1932, John Sinton y HW Mulligan describieron con más detalle la morfología del parásito en las células sanguíneas, determinaron que era una especie distinta de otras descritas y lo llamaron Plasmodium knowlesi en honor a Robert Knowles.
Poco después, en 1935 CE, Van Rooyen y George R. Pile informaron sobre el uso de la infección por P. knowlesi para tratar la parálisis general en pacientes psiquiátricos. P. knowlesi se seguiría utilizando como agente pirético general para diversas enfermedades, en particular la neurosífilis, para la que se utilizó al menos hasta 1955. Aunque Cyril Garnham sugirió en 1957 que P. knowlesi podría infectar a los seres humanos de forma natural, el primer caso documentado de un humano infectado naturalmente con P. knowlesi fue en 1965 en un topógrafo del ejército de los EE. UU. que desarrolló escalofríos y fiebre después de un despliegue de cinco días en Malasia. Sobre la base de este hallazgo, un equipo del Instituto de Investigación Médica de Malasia peninsular realizó una encuesta entre las personas que vivían cerca de los macacos, pero no pudo encontrar pruebas de que la malaria en los simios se estuviera transmitiendo a los humanos.
Durante las décadas de 1960 y 1970, los grupos de investigación científica utilizaron P. knowlesi como modelo de investigación para hacer descubrimientos fundamentales sobre la malaria. En 1965 y 1972, varios grupos caracterizaron cómo la variación antigénica de P. knowlesi contribuía a la evasión inmunitaria y la infección crónica. En 1975, Louis H. Miller y otros demostraron que P. knowlesi requería factor Duffy en la superficie de los glóbulos rojos para invadirlos (continuarían mostrando el mismo requisito para P. vivax un año después).
El trabajo sobre P. knowlesi como parásito de la malaria humana se revitalizó en 2004, cuando Balbir Singh y otros utilizaron la PCR para demostrar que más de la mitad de un grupo de seres humanos diagnosticados con malaria por P. malariae en el Borneo de Malasia estaban realmente infectados con P. knowlesi . Durante la década siguiente, varios investigadores utilizaron métodos de detección molecular capaces de distinguir P. knowlesi de parásitos morfológicamente similares para atribuir una proporción cada vez mayor de casos de paludismo a P. knowlesi en todo el sudeste asiático. El trabajo con muestras de archivo ha demostrado que la infección por este parásito se ha producido en Malasia al menos desde la década de 1990.
Referencias
enlaces externos
- Página de los CDC sobre la malaria
- Página de la OMS sobre el paludismo
- Datos del genoma de P. knowlesi
- Cortometraje sobre el descubrimiento del papel de P. knowlesi en la malaria humana
| Scholia tiene un perfil de tema para Plasmodium knowlesi . |