Ácido nitrilotriacético - Nitrilotriacetic acid
|
|
| Nombres | |
|---|---|
|
Nombre IUPAC preferido
2,2 ′, 2 ′ ′ - Ácido nitrilotriacético |
|
| Otros nombres
N , N- Bis (carboximetil) glicina Ácido
2- [bis (carboximetil) amino] acético Triglicina |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| 1710776 | |
| CHEBI | |
| ChemSpider | |
| DrugBank | |
| Tarjeta de información ECHA |
100.004.869 |
| Número CE | |
| 3726 | |
| KEGG | |
| Malla | Ácido nitrilotriacético + |
|
PubChem CID
|
|
| Número RTECS | |
| UNII | |
| un numero | 2811 |
|
Tablero CompTox ( EPA )
|
|
|
|
|
|
| Propiedades | |
| C 6 H 9 N O 6 | |
| Masa molar | 191.14 |
| Apariencia | Cristales blancos |
| Punto de fusion | 246 ° C (475 ° F; 519 K) |
| Insoluble. <0.01 g / 100 mL a 23 ℃ | |
| Termoquímica | |
| −1,3130–−1,3108 MJ mol −1 | |
| Peligros | |
| Pictogramas GHS |
 
|
| Palabra de señal GHS | Advertencia |
| H302 , H319 , H351 | |
| P281 , P305 + 351 + 338 | |
| punto de inflamabilidad | 100 ° C (212 ° F; 373 K) |
| Dosis o concentración letal (LD, LC): | |
|
LD 50 ( dosis mediana )
|
1,1 g kg -1 (oral, rata) |
| Compuestos relacionados | |
|
Ácidos alcanoicos relacionados
|
|
|
Compuestos relacionados
|
|
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencias de Infobox | |
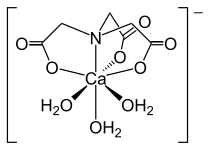
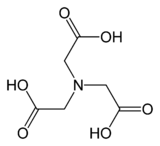
El ácido nitrilotriacético (NTA) es el ácido aminopolicarboxílico con la fórmula N (CH 2 CO 2 H) 3 . Es un sólido incoloro que se utiliza como agente quelante , que forma compuestos de coordinación con iones metálicos (quelatos) como Ca 2+ , Co 2+ , Cu 2+ y Fe 3+ .
Producción y uso
El ácido nitrilotriacético está disponible comercialmente como ácido libre y como sal de sodio. Se produce a partir de amoníaco , formaldehído y cianuro de sodio o cianuro de hidrógeno . La capacidad mundial se estima en 100 mil toneladas por año. El NTA también se cogenera como impureza en la síntesis de EDTA , que surge de las reacciones del coproducto de amoníaco.
Química y aplicaciones de la coordinación
NTA es un ligando trianiónico tetradentado tripodal.
Los usos de NTA son similares a los de EDTA, siendo ambos agentes quelantes. Se utiliza para ablandar el agua y como reemplazo del trifosfato de sodio y potasio en detergentes y limpiadores.
En una aplicación, el NTA como agente quelante elimina el Cr, Cu y As de la madera que ha sido tratada con arseniato de cobre cromado .
Usos de laboratorio
En el laboratorio, este compuesto se utiliza en valoraciones complexométricas. Se utiliza una variante de NTA para el aislamiento y la purificación de proteínas en el método His-tag . El NTA modificado se utiliza para inmovilizar níquel sobre un soporte sólido. Esto permite la purificación de proteínas que contienen una etiqueta que consta de seis residuos de histidina en cada extremo.
El his-tag une el metal de los complejos quelantes de metales . Anteriormente, se usaba ácido iminodiacético para ese propósito. Ahora, el ácido nitrilotriacético se usa más comúnmente.
Para usos de laboratorio Ernst Hochuli et al. 1987 acopló el ligando NTA y los iones de níquel a perlas de agarosa . Esta agarosa Ni-NTA es la herramienta más utilizada para purificar sus proteínas etiquetadas mediante cromatografía de afinidad.
- Complejos NTA
Toxicidad y medio ambiente
El ácido nitriloacético puede irritar los ojos, la piel y las vías respiratorias; y puede causar daño a los riñones y la vejiga. Se prevé que el compuesto tenga el potencial de causar cánceres humanos.
A diferencia del EDTA, el NTA es fácilmente biodegradable y se elimina casi por completo durante el tratamiento de las aguas residuales. Los impactos ambientales de NTA son mínimos. A pesar de su uso generalizado en productos de limpieza, la concentración en el suministro de agua es demasiado baja para tener un impacto considerable en la salud humana o la calidad ambiental.