Modelos de ratón de metástasis de cáncer de mama - Mouse models of breast cancer metastasis
Los modelos de ratón metastásico de cáncer de mama son enfoques experimentales en los que los ratones se manipulan genéticamente para desarrollar un tumor mamario que conduce a lesiones focales distantes del epitelio mamario creadas por metástasis . Los cánceres de mama en ratones pueden ser causados por mutaciones genéticas que se han identificado en el cáncer humano. Esto significa que se pueden generar modelos basados en lesiones moleculares compatibles con la enfermedad humana.
Metástasis de cáncer de mama
La metástasis es un proceso de migración de células tumorales desde el sitio del cáncer primario a un lugar distante donde las células cancerosas forman tumores secundarios. El cáncer de mama metastásico representa el atributo más devastador del cáncer y se considera un evento en estadio avanzado. El cáncer de mama humano hace metástasis en múltiples órganos distantes como el cerebro , los pulmones , los huesos y el hígado .
Diversidad genética entre tumor primario y metastásico.
La teoría clásica desarrollada a principios de los años 70 anticipó que la metástasis se debe a subpoblaciones determinadas genéticamente en los tumores primarios. La variación genética entre focos metastásicos es significativa solo para un locus particular y dentro de poblaciones celulares específicas o solo una población celular muestra diferencias y algunos loci son divergentes solo en una subpoblación celular. Esto explica el concepto de heterogeneidad tumoral y el orden de los eventos genéticos durante la evolución del tumor . Muchos de los genes que impulsan el crecimiento en el sitio primario pueden determinar la diseminación y colonización en el sitio ectópico . El cáncer de mama se considera genéticamente y clínicamente como una enfermedad heterogénea, ya que refleja la heterogeneidad del tejido mamario normal en su origen17873350. Deben ocurrir varios eventos genéticos discretos para permitir que las células tumorales individuales tengan la capacidad de crecer en un sitio ectópico. La progresión metastásica depende de la regulación de los programas de desarrollo y los eventos ambientales. El potencial metastásico de las subpoblaciones dentro de las células mamarias de ratón se considera ahora como un evento relativamente temprano y la diseminación se produce al mismo tiempo que las lesiones preinvasivas o microinvasivas. Los perfiles genéticos de las lesiones primarias y metastásicas en los carcinomas de mama muestran un gran grado de pertinencia clonal entre lesiones. Existen varios patrones de prevalencia de mutaciones genéticas en los genomas del tumor de mama primario y sus metástasis. También confirma la heterogeneidad genética entre la neoplasia primaria de pacientes con cáncer de mama y sus respectivas metástasis.
Genes implicados en metástasis de órganos específicos
Los fenotipos del cáncer de mama expresan periódicamente genes en metástasis que son indispensables para el proceso metastásico. La diversidad metastásica está mediada por la activación de genes que actúan como acoplamiento al crecimiento de órganos específicos. El crecimiento de las lesiones en el sitio ectópico depende de múltiples interacciones complejas entre las células metastásicas y los mecanismos homeostáticos del huésped . Las interacciones letales proteína-proteína en el sitio metastásico ayudan a la supervivencia de las células adaptadas .
Generación de modelos de ratón de cáncer de mama
La expresión dirigida de oncogenes en células epiteliales mamarias de ratón es una forma de modelar el cáncer de mama humano. La mutación o sobreexpresión de oncogenes se puede mantener bajo expresión controlada en un contexto celular muy específico en lugar de en todo el organismo. Otra forma de modelar el cáncer de mama humano se realiza mediante la inhibición dirigida de un gen supresor de tumores.
Ratones en la investigación genética
- En 1909, Clarence C. Little desarrolló la primera cepa endogámica, el ratón DBA (Dilute, brown non-Agouti).
- En 1915, NM Haldane identificó el primer enlace en ratón entre ratones albinos y la dilución de conjuntivitis en el cromosoma siete.
- En 1921, C57BL se convirtió en uno de los ratones más utilizados en genética y fue la primera cepa en secuenciar su genoma .
- En 1982, Palmiter y Brinster implantaron un gen extraño en el huevo fertilizado , finalmente la generación de la primera transgénico ratones genéticamente por ingeniería para expresar oncogenes dominantes.
- En 1982, la estimulación de la expresión del MMTV-LTR (virus de tumor mamario de ratón-repetición terminal larga) se realizó mediante múltiples rondas de embarazo y lactancia para evaluar la relevancia de un protooncogén celular , c-myc .
Humano y ratón: una comparación genómica
Los estudios genéticos de enfermedades comunes en humanos adolecen de importantes limitaciones por razones prácticas y éticas . Las líneas celulares humanas se pueden utilizar para modelar enfermedades, pero es difícil estudiar los procesos a nivel de tejido , dentro de un órgano o en todo el cuerpo. Los ratones pueden ser una buena representación de enfermedades en humanos porque:
- Existen grandes similitudes de fisiología , desarrollo y biología celular entre ratones y humanos.
- Tanto los seres humanos como los ratones tienen alrededor de 30.000 genes que codifican proteínas. El número de genes de ratón sin un homólogo humano correspondiente es inferior al 1%.
- El 90% de los genomas humanos y de ratón son sinténicos .
- El 40% de los genomas humanos y de ratón se pueden alinear a nivel de nucleótidos .
- Los ratones tienen períodos de gestación relativamente cortos .
- Los ratones tardan un breve tiempo en alcanzar la madurez sexual.
- Los ratones tienen una camada grande.
- La disponibilidad de cientos de mutaciones que afectan a casi todos los tejidos y aspectos del desarrollo.
Es posible que los ratones no sean un modelo ideal para el cáncer de mama. Esto se debe principalmente a la falta de precisión en muchos de los modelos. Al observar la metástasis, es difícil determinar la ubicación precisa y su frecuencia. Otro problema gira en torno a los subtipos epiteliales y la incapacidad de apuntarlos específicamente al apuntar a una mutación. Un ejemplo de esto sería determinar el desarrollo de tumores en ratones K14-Cre BRCA2. En un caso estándar, la escisión de BRCA2 no produjo tumorgénesis, pero si p53 se mutaba e inactivaba, se produciría tumorgénesis. Por tanto, no hay una respuesta definitiva en cuanto al origen del tumor, debido a la mutación extra en p53.
Líneas celulares de carcinoma mamario de ratón metastásico
Varias líneas celulares de carcinoma mamario de ratón, como 4T1 y TS / A , son metastásicas en ratones inmunocompetentes singénicos y pueden usarse para identificar genes y vías involucradas en el proceso metastásico.
Modelos simples de trasplante de tumores
El trasplante de células tumorales en ratones inmunodeficientes es una herramienta para estudiar el cáncer de mama y sus efectos metastásicos. El trasplante se realiza como alotrasplantes o trasplantes xenográficos . Comúnmente, las células humanas se inoculan en un receptor murino inmunodeprimido . Inoculación de células mediante trasplantes intraductales, mediante inyecciones de almohadilla de grasa mamaria depurada o mediante trasplantes en la vena de la cola. Se pueden sembrar diferentes órganos con células de cáncer de mama según la vía de inyección.
- Inyección cardíaca: hueso
- Inyección en la vena de la cola: pulmón
- Inyección esplénica: hígado
- Inyección de la arteria carótida: cerebro
Modelos de trasplante de tejido tumoral
Los ratones inmunodeficientes específicos que se utilizaron fueron el ratón NOD / SCID (diabético no obeso / inmunodeficiente condicional grave). Estas mutaciones permiten la integración de nuevo tejido de xenoinjerto. Primero se deben humanizar las almohadillas de grasa mamarias del ratón inyectando fibroblastos del estroma mamario humano inmortalizados con telemorasa (fibroblastos RMF / EG) en las almohadillas de grasa mamarias. Sin esta inyección, las células epiteliales mamarias humanas injertadas en la almohadilla no pueden colonizar ni crecer. Luego, el fibroblasto RMF / EG debe irradiarse para permitir la expresión de proteínas clave y factores de crecimiento. Después de 4 semanas de desarrollo, las células epiteliales mamarias humanas recién injertadas se expandieron dentro de la almohadilla de grasa.
Ratones modificados genéticamente para estudiar la metástasis
Los ratones modificados genéticamente se construyen para modelar fenotipos y patologías humanos . Los ratones mutantes pueden incluir transgenes utilizando diferentes métodos de administración:
- El uso de un sistema inducible por tetraciclina derivado de bacterias que permite el encendido o apagado (sistema Tet-On / Tet-Off)
- Mutaciones dirigidas por knock in gen y knock out secuencia mediante el uso del sistema de recombinación Cre-Lox
- Introducción de víricas retro mutaciones
- Introducción de mutaciones inducidas químicamente
Modelos de ratón transgénico de cáncer de mama
Los ratones que experimentan el proceso de transgénesis se conocen como ratones transgénicos. Un transgén básico tiene una región promotora , una secuencia codificadora de proteínas, un intrón y un codón de terminación . El virus del tumor mamario del ratón (MMTV), es un retrovirus que ha sido un conocido promotor de causar tumores de mama una vez activados. MMTV es un mutágeno somático hereditario cuyo rango objetivo es limitado. Alberga una secuencia de ADN reguladora llamada repetición terminal larga (LTR), que promueve la transcripción inducible por hormonas esteroides. La tumorgénesis que fue inducida por el virus del tumor mamario de ratón también se puede realizar mediante la integración del genoma viral. Se sabe que los sitios de integración son genes críticos para la regulación celular. La proteína de suero ácido (WAP) es otro promotor común que se utiliza para generar modelos de cáncer de mama en ratones. Para obtener una lista de otros promotores específicos de glándulas mamarias y modelos de ratón, consulte.
MMTV-PyMT
MMTV-PyMT es el modelo de metástasis del cáncer de mama, en el que se utiliza MMTV-LTR para impulsar la expresión del antígeno T medio del poliomavirus específico de la glándula mamaria , lo que conduce a un rápido desarrollo de tumores altamente metastásicos. MMTV-PyMT es el modelo más utilizado para el estudio de la progresión y metástasis de tumores mamarios. Luego, los ratones MMTV-PyMT se cruzan con otros ratones modificados genéticamente para generar varios tipos de modelos de cáncer de mama, que incluyen:
- La señalización de PI3K / Akt en metástasis se puede demostrar en MMTV-PyMT; Akt1 - / - ratones.
- Bucle paracrino quimioatractivo de factor-1 estimulante de colonias (CSF-1) y ligandos EGF entre macrófagos asociados a tumores (TAM) y células tumorales, y la metástasis pulmonar se puede estudiar cruzando ratones MMTV-PyMT con Csf-1 - / - ratones.
- El papel de una respuesta inmune innata y adaptativa para ayudar a la metástasis se puede estudiar en MMTV-PyMT; Ratones Rag1 - / - en los que las células T CD4 + se pierden selectivamente. Interleucina-4 (IL4) que carece del modelo de MMTV-PyMT; Ratones IL4 - / -.
- Papel de la molécula de adhesión CD44 en la metástasis pulmonar.
- La ablación condicional en células de cáncer de mama MMTV-PyMT se ha realizado para revelar acciones pro-metastásicas de los factores angiogénicos , factor de crecimiento endotelial vascular A (VEGF-A).
- El papel de la señalización del factor de crecimiento transformante autocrino beta 1 (TGF-β1) sobre la motilidad y la supervivencia en células PymT derivadas de un cáncer de mama de ratón MMTV-PymT.
- Otros son MMTV-PyMT; uPA - / - y MMTV-PyMT; MEKK1 - / -.
MMTV- HER2 / neu
El MMTV-LTR también se puede usar para promover el receptor tirosina-proteína quinasa ErbB2 para transformar el epitelio mamario del ratón. ErbB2 es un oncogén amplificado y sobreexpresado en alrededor del 20% de los cánceres de mama humanos. Los ratones que albergan este oncogén desarrollan adenocarcinomas multifocales con metástasis pulmonares aproximadamente 15 semanas después del embarazo. Para crear una representación más precisa de las mutaciones del gen HER2, los investigadores han fusionado el gen de ratón que contiene neu y un gen de rata que contiene neu. Esto aborda el problema en términos de modelar la amplificación de HER2 en el desarrollo de ratones. En el ratón no fusionado, la glándula mamaria volvería a ser casi virgen, pero con esta adición la glándula mamaria mantuvo la función desarrollada.
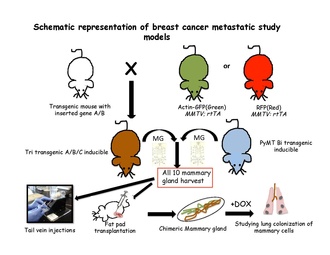
Modelos bi-transgénicos
Los modelos de ratón que tienen dos transgenes se denominan bi transgénicos. Para comprobar la cooperación de dos oncogenes, Tim Stewert y su grupo hicieron los primeros modelos de ratón bi-transgénico en 1987, se cruzaron ratones MMTV- Myc y MMTV- Ras con una aceleración resultante en la tumorigénesis. Expresión de TGFβ en las células de cáncer de mama de MMTV-ErbB2; Los ratones doble transgénicos MMTV-TGFβ pueden inducir niveles más altos de células tumorales circulantes y metástasis pulmonar. El gen Ras se puede combinar con rtTA (transactivador de tetraciclina inverso) para generar un modelo de ratón inducible bi-transgénico a través de la activación transcripcional controlada por tetraciclina, por ejemplo, ratones que portan TetO-KrasG12D (TOR) y MMTV-rtTA (MTB), viene con el transgén que expresa el reverso transactivador de tetraciclina (rtTA) en células epiteliales mamarias.
Modelos tri-transgénicos
Los modelos de ratón tritransgénicos están formados por más de dos genes. Se realizan múltiples combinaciones y modificaciones genéticas de tal manera que uno o todos los genes se ponen en un estado de expresión continua, o de forma controlada para activarlos en diferentes momentos. Por ejemplo, TOM (TetO-myc); COLINA; Ratones MTB, donde los genes myc (M) y ras (R) están bajo el control de operadores de tetraciclina. También pueden activarse o desactivarse añadiendo doxiciclina. Otras combinaciones a este respecto son TOM; Kras; MTB, donde myc puede inducirse y no inducirse en varios puntos de tiempo mientras Kras está en estado expresado continuo, y myc; COLINA; El modelo de MTB es al revés.
Aplicaciones de ratones modificados genéticamente para estudiar metástasis
La cascada metastásica se puede estudiar manteniendo la activación del gen bajo control o agregando un gen indicador, por ejemplo, Beta actina GFP (proteína verde fluorescente) o RFP (proteína roja fluorescente).
Identificación de genes que regulan la metástasis
Al anular / anular genes específicos mediante recombinación homóloga, se puede medir la extensión de la metástasis y se puede lograr la identificación de nuevos genes diana, por ejemplo, un gen que regula consistentemente el comportamiento metastásico de las células cancerosas es TGF-β1. La ablación aguda de la señalización de TGF-β en células tumorales mamarias MMTV-PyMT conduce a un aumento de cinco veces en la metástasis pulmonar. También se pueden analizar ciertas regiones potenciadoras y se puede determinar que son una parte crucial de la proliferación celular, por ejemplo, una región potenciadora que está asociada con un gen p53 crítico para el cáncer que se determinó mediante CRISPR-Cas9.
Rastreo de linaje en modelos de metástasis
Las estrategias de rastreo de linaje cuantitativo han demostrado ser exitosas en la resolución de destinos celulares en tejidos epiteliales normales, ya sea utilizando transgenes específicos de tejido o específicos de células madre . Para realizar un experimento de rastreo de linaje inducible, se deben diseñar dos componentes en el genoma del ratón: un interruptor y un reportero. El cambio es comúnmente una forma regulada por fármacos de la enzima bacteriana Cre-recombinasa. Esta enzima reconoce secuencias específicas, llamadas sitios LoxP. Las proteínas que son capaces de mejorar la identificación de células marcadas o una población específica en células no marcadas son codificadas por los transgenes informadores. Después de recolectar las diez glándulas mamarias de los ratones transgénicos, generalmente se hace una suspensión de células individuales y se trasplanta en la vena de la cola de los ratones receptores no transgénicos o en la almohadilla de grasa eliminada de ratones no transgénicos que repoblan la almohadilla de grasa mamaria. Estas células se siguen luego en el torrente sanguíneo, pulmones, médula ósea e hígado para buscar el sitio favorable de metástasis. Estas células transgénicas se pueden rastrear de acuerdo con sus características especiales de fluorescencia o inducidas colocando a los receptores en alimentos con doxiciclina.
Células tumorales circulantes
Otra herramienta para estudiar la metástasis del cáncer de mama es buscar células tumorales circulantes en ratones transgénicos, por ejemplo, los ratones MMTV-PyMT pueden responder a diversas terapias para eliminar las células tumorales en la sangre que conducen a la metástasis pulmonar. No sólo en la sangre, sino que se pueden detectar células en la médula ósea, por ejemplo, se identificaron células positivas a citoqueratina en la médula ósea de ratones transgénicos MMTV-pyMT y MMTV-Neu, pero no en los controles de tipo salvaje.
Limitaciones
En ausencia de marcadores específicos para células mamarias, los modelos con marcaje genético de células tumorales dan la mejor ventaja experimental, sin embargo el bajo volumen de sangre periférica que se puede obtener de animales vivos limita la aplicación de esta técnica.
Imágenes in vivo de modelos de ratones metastásicos
Se pueden obtener imágenes de modelos de ratones transgénicos mediante diversas técnicas no invasivas.
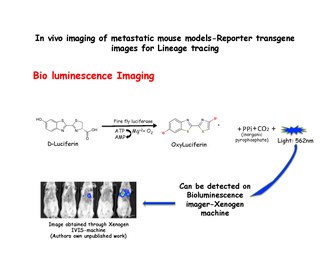
Imágenes de bioluminiscencia
Las imágenes de bioluminiscencia se basan en la detección de la luz producida por la oxidación enzimática de un sustrato exógeno. El sustrato luciferina, se oxida a oxiluciferina en presencia de luciferasa y emite luz, que puede detectarse usando un sistema IVIS como una máquina Xenogen. Células mamarias disociadas de MMTV-PyMT: IRES: Luc; Los animales MTB ( sitio de entrada de ribosoma interno : luciferina ) (que no fueron expuestos a doxiciclina) pueden inyectarse en las venas laterales de la cola de ratones inmunodeficientes con una dieta libre de doxiciclina. No se observará ninguna señal de bioluminiscencia en los pulmones de los ratones receptores hasta que se les administre alimento con doxiciclina. La bioluminiscencia se puede detectar en el tórax dentro de las 2 semanas posteriores al inicio de la exposición a la doxiciclina. La luciferasa se inyecta justo antes de tomar las imágenes.
Imágenes fluorescentes
La microscopía intravital con excitación de fotones múltiples es una técnica para visualizar células modificadas genéticamente directamente in vivo. Las cascadas metastásicas de varios pasos se pueden visualizar marcando con un color fluorescente único bajo un microscopio de fluorescencia .
Imágenes radioisotópicas
La tomografía por emisión de positrones (PET), la tomografía computarizada por emisión de fotón único (SPECT) y la tomografía computarizada (TC) se han utilizado para comparar la eficiencia de estas imágenes in vivo para detectar lesiones en una etapa temprana y evaluar la respuesta a la quimioterapia.
Imágenes de resonancia magnética
La resonancia magnética requiere el uso de nanopartículas (liposomas) y un agente de contraste de resonancia magnética llamado gadolinio. A continuación, las partículas se colocaron en vesículas mediante un filtro de membrana de policarbonato. Las nanopartículas se inyectan en los ratones evolucionados con metástasis y se dejan allí durante veinticuatro horas. Luego, estos ratones se escanean y en el software de imágenes hay acumulaciones de estas partículas en ciertas áreas donde las células han hecho metástasis.
Ver también
- Ensembl base de datos del genoma de organismos modelo
- Mapeo del destino
- Luciferina de luciérnaga
- Orientación genética
- Atrapamiento de genes
- Recombinación genética
- Historia de los organismos modelo
- Recombinación homóloga
- Intercambio de casetes mediado por recombinasa
- Tecnología de recombinasa específica del sitio
Referencias
enlaces externos
- http://www.la-press.com/tetracycline-regulated-systems-in-functional-oncogenomics-article-a200 Una descripción detallada de los sistemas Tet en oncogenómica funcional