Melioidosis - Melioidosis
| Melioidosis | |
|---|---|
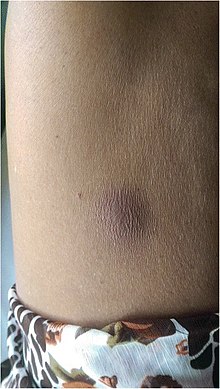 | |
| Absceso de melioidosis en el abdomen | |
| Especialidad |
Enfermedad infecciosa |
| Síntomas | Ninguno, fiebre, neumonía , abscesos múltiples |
| Complicaciones | Encefalomielitis , shock séptico , pielonefritis aguda , artritis séptica , osteomielitis |
| Inicio habitual | 1-21 días después de la exposición |
| Causas | Burkholderia pseudomallei se propaga por contacto con el suelo o el agua |
| Factores de riesgo | Diabetes mellitus , talasemia , alcoholismo , enfermedad renal crónica |
| Método de diagnóstico | Cultivo de bacterias en medios de cultivo. |
| Diagnóstico diferencial | Tuberculosis |
| Prevención | Prevención de la exposición a agua contaminada, profilaxis antibiótica. |
| Tratamiento | Ceftazidima , meropenem , cotrimoxazol |
| Frecuencia | 165.000 personas al año |
| Fallecidos | 89.000 personas al año |
Melioidosis es una enfermedad infecciosa causada por un Gram-negativos bacteria llamada Burkholderia pseudomallei . La mayoría de las personas infectadas con B. pseudomallei no experimentan síntomas, pero las que sí los experimentan tienen signos y síntomas que van desde leves, como fiebre , cambios en la piel, neumonía y abscesos , hasta graves con inflamación del cerebro , inflamación de las articulaciones. y presión arterial peligrosamente baja que causa la muerte. Aproximadamente el 10% de las personas con melioidosis desarrollan síntomas que duran más de dos meses, denominados "melioidosis crónica".
Los seres humanos se infectan con B. pseudomallei por contacto con agua contaminada. Las bacterias ingresan al cuerpo a través de heridas, inhalación o ingestión. La transmisión de persona a persona o de animal a humano es extremadamente rara. La infección está constantemente presente en el sudeste asiático, particularmente en el noreste de Tailandia y el norte de Australia. En países desarrollados, como Europa y Estados Unidos, los casos de melioidosis generalmente se importan de países donde la melioidosis es más común. Los signos y síntomas de la melioidosis se parecen a los de la tuberculosis y es común que se diagnostiquen erróneamente. El diagnóstico generalmente se confirma por el crecimiento de B. pseudomallei a partir de la sangre u otro fluido corporal de una persona infectada. Aquellos con melioidosis se tratan primero con un ciclo de "fase intensiva" de antibióticos intravenosos (más comúnmente ceftazidima ) seguido de un ciclo de tratamiento de varios meses con cotrimoxazol . Incluso si se trata adecuadamente, alrededor del 10% de las personas con melioidosis mueren a causa de ella. Si se trata de manera inadecuada, la tasa de mortalidad podría llegar al 40%.
Los esfuerzos para prevenir la melioidosis incluyen usar equipo de protección al manipular agua contaminada, practicar la higiene de las manos, beber agua hervida y evitar el contacto directo con el suelo, el agua o las lluvias intensas. El antibiótico cotrimoxazol se usa como preventivo solo para personas con alto riesgo de contraer melioidosis después de haber estado expuestas a la bacteria. No se ha aprobado ninguna vacuna para la melioidosis.
Aproximadamente 165.000 personas se infectan por melioidosis por año, lo que resulta en unas 89.000 muertes. La diabetes es un factor de riesgo importante para la melioidosis; más de la mitad de los casos de melioidosis se dan en personas con diabetes. El aumento de las precipitaciones se asocia con un mayor número de casos de melioidosis en áreas endémicas . Fue descrito por primera vez por Alfred Whitmore en 1912 en la actual Myanmar .
Signos y síntomas
Agudo
La exposición a Burkholderia pseudomallei comúnmente puede causar que se produzcan anticuerpos contra ella sin ningún síntoma. De los pacientes que desarrollan una infección clínica, el 85% experimenta síntomas agudos por una adquisición reciente de la bacteria. El período medio de incubación de la melioidosis aguda es de 9 días (rango de 1 a 21 días). Sin embargo, los síntomas de la melioidosis pueden aparecer en 24 horas para aquellos que están infectados durante un casi ahogamiento en agua contaminada. Los afectados presentan síntomas de sepsis (predominantemente fiebre) con o sin neumonía , o absceso localizado u otro foco de infección. La presencia de signos y síntomas inespecíficos ha hecho que la melioidosis sea apodada "la gran imitadora".
Las personas con diabetes mellitus o exposición regular a la bacteria tienen un mayor riesgo de desarrollar melioidosis. La enfermedad debe considerarse en quienes se encuentran en áreas endémicas y desarrollan fiebre, neumonía o abscesos en el hígado, el bazo, la próstata o las glándulas parótidas. La manifestación clínica de la enfermedad puede variar desde simples cambios en la piel hasta problemas graves de órganos. Los cambios cutáneos pueden ser abscesos o ulceraciones inespecíficas. En el norte de Australia, el 60% de los niños infectados presentaba solo lesiones cutáneas, mientras que el 20% presentaba neumonía. Los órganos afectados con mayor frecuencia son el hígado, el bazo, los pulmones, la próstata y los riñones. Entre los signos clínicos más comunes se encuentran la presencia de bacterias en la sangre (en 40 a 60% de los casos), neumonía (50%) y shock séptico (20%). Las personas que solo tienen neumonía pueden tener tos prominente con esputo y dificultad para respirar. Sin embargo, aquellos con shock séptico junto con neumonía pueden tener tos mínima. Los resultados de una radiografía de tórax pueden variar desde infiltrados nodulares difusos en aquellos con shock séptico hasta solidificación progresiva de los pulmones en los lóbulos superiores para aquellos con neumonía solamente. El exceso de líquido en la cavidad pleural y la acumulación de pus dentro de una cavidad son más comunes para la melioidosis que afecta los lóbulos inferiores de los pulmones. En el 10% de los casos, las personas desarrollan neumonía secundaria causada por otras bacterias después de la infección primaria.
Dependiendo del curso de la infección, se desarrollan otras manifestaciones graves. Aproximadamente del 1 al 5% de los infectados desarrollan inflamación del cerebro y la cubierta del cerebro o acumulación de pus en el cerebro ; 14 a 28% desarrollan inflamación bacteriana de los riñones , abscesos renales o abscesos prostáticos; 0 a 30% desarrollan cuello o de la glándula salival abscesos; Del 10 al 33% desarrollan abscesos hepáticos, esplénicos o paraintestinales; 4 a 14% desarrollan artritis séptica y osteomielitis . Las manifestaciones raras incluyen enfermedad de los ganglios linfáticos parecida a la tuberculosis, masas mediastínicas , acumulación de líquido en la cubierta del corazón , dilatación anormal de los vasos sanguíneos debido a una infección e inflamación del páncreas . En Australia, hasta el 20% de los varones infectados desarrollan un absceso prostático caracterizado por dolor al orinar , dificultad para orinar y retención urinaria que requiere cateterismo . El tacto rectal muestra inflamación de la próstata . En Tailandia, el 30% de los niños infectados desarrollan abscesos parotídeos. La encefalomielitis puede ocurrir en personas sanas sin factores de riesgo. Aquellos con encefomielitis por melioidosis tienden a tener tomografías computarizadas normales , pero una señal T2 aumentada por imágenes de resonancia magnética , que se extiende al tronco encefálico y la médula espinal . Los signos clínicos incluyen: debilidad unilateral de las extremidades de la motoneurona superior , signos cerebelosos y parálisis de los pares craneales (parálisis de los nervios VI , VII y parálisis bulbar ). Algunos casos se presentaron solo con parálisis flácida . En el norte de Australia, todos los casos de melioidosis con encefalomielitis tenían glóbulos blancos elevados en el líquido cefalorraquídeo (LCR), en su mayoría células mononucleares con proteínas del LCR elevadas.
Crónico
La melioidosis crónica generalmente se define por síntomas que duran más de dos meses y ocurre en aproximadamente el 10% de los pacientes. Las presentaciones clínicas incluyen fiebre, pérdida de peso y tos productiva con o sin esputo sanguinolento, que puede simular tuberculosis . Además, también pueden presentarse abscesos de larga duración en múltiples sitios del cuerpo. Se debe considerar la tuberculosis si los ganglios linfáticos están agrandados en la raíz del pulmón . La melioidosis crónica puede presentarse con neumonía cavitada que se asemeja a la tuberculosis pulmonar crónica. La neumonía causada por melioidosis rara vez causa cicatrices y calcificación de los pulmones, a diferencia de la tuberculosis.
Latente
En la infección latente, las personas inmunocompetentes pueden eliminar la infección sin mostrar ningún síntoma, pero menos del 5% de todos los casos de melioidosis tienen activación después de un período de latencia. Los pacientes con melioidosis latente pueden estar asintomáticos durante décadas. Inicialmente, se pensaba que el período más largo entre la presunta exposición y la presentación clínica era de 62 años en un prisionero de guerra de la Segunda Guerra Mundial en Birmania-Tailandia-Malasia. Sin embargo, el posterior genotipado del aislado bacteriano de un veterano de la guerra de Vietnam mostró que el aislado puede no haber venido del sudeste asiático , sino de América del Sur. Esto restablece otro informe que establece el período de latencia más largo para la melioidosis en 29 años. El potencial de una incubación prolongada se reconoció en los militares estadounidenses involucrados en la guerra de Vietnam y se denominó la "bomba de tiempo de Vietnam". En Australia, el período de latencia más largo registrado es de 24 años. Varias comorbilidades como diabetes, insuficiencia renal y alcoholismo pueden predisponer a la reactivación de la melioidosis.
Porque
Bacterias
La melioidosis es causada por una bacteria saprofítica gramnegativa móvil llamada Burkholderia pseudomallei . La bacteria también puede ser un oportunista , facultativa intracelular patógeno. También es positivo en la prueba aeróbica y oxidasa . Una vacuola en el centro de la bacteria hace que se parezca a un "imperdible" cuando se tiñe con Gram. Las bacterias emiten un fuerte olor a suelo después de 24 a 48 horas de crecimiento en cultivo. B. pseudomallei produce una cápsula de polisacárido glucocáliz que la hace resistente a muchos tipos de antibióticos. Generalmente es resistente a gentamicina y colistina , pero sensible a amoxicilina / ácido clavulánico (co-amoxiclav). B. pseudomallei es un patógeno de nivel 3 de bioseguridad que requiere un manejo de laboratorio especializado. En los animales, otro organismo similar llamado Burkholderia mallei es el agente causante de la enfermedad del muermo . B. pseudomallei se puede diferenciar de otra especie estrechamente relacionada, pero menos patógena, B. thailandensis , por su capacidad para asimilar arabinosa . B. pseudomallei es muy adaptable a varios entornos de hospedadores que van desde el interior de las esporas de hongos micorrízicos hasta las amebas . Su adaptabilidad puede darle una ventaja de supervivencia en el cuerpo humano.
El genoma de B. pseudomallei consta de dos replicones : el cromosoma 1 codifica las funciones domésticas de las bacterias, como la síntesis de la pared celular, la movilidad y el metabolismo; el cromosoma 2 codifica funciones que permiten que las bacterias se adapten a varios entornos. La transferencia horizontal de genes entre bacterias ha dado lugar a genomas muy variables en B. pseudomallei . Se ha sugerido que Australia es el primer reservorio de B. pseudomallei debido a la alta variabilidad genética de las bacterias que se encuentran en esta región. Las bacterias aisladas de África y América Central y del Sur parecen tener un ancestro común que vivió entre los siglos XVII y XIX. B. mallei es un clon de B. pseudomallei que ha perdido porciones sustanciales de su genoma al adaptarse para vivir exclusivamente en mamíferos.
Transmisión
B. pseudomallei se encuentra normalmente en el suelo y en las aguas superficiales, y es más abundante a profundidades del suelo de 10 cm a 90 cm. Se ha encontrado en suelos, estanques, arroyos, estanques, agua estancada y arrozales. Puede sobrevivir en condiciones de escasez de nutrientes, como agua destilada, suelo desértico y suelo con pocos nutrientes, durante más de 16 años. También puede sobrevivir en soluciones antisépticas y detergentes, entornos ácidos ( pH 4,5 durante 70 días) y entornos a temperaturas que oscilan entre 24 y 32 ° C (72 a 89,6 ° F). Las bacterias no sobreviven en presencia de luz ultravioleta.
Las bacterias pueden ingresar al cuerpo a través de heridas, inhalación e ingestión de agua contaminada. La transmisión de persona a persona es extremadamente rara. La melioidosis es una enfermedad reconocida en animales, incluidos gatos, perros, cabras, ovejas y caballos. Se considera que el ganado, los búfalos de agua y los cocodrilos son relativamente resistentes a la melioidosis a pesar de su exposición constante al agua y al suelo infectados. Las aves también son resistentes a la melioidosis. La transmisión de animales a humanos es rara.
La cloración inadecuada del suministro de agua se ha asociado con el brote de B. pseudomallei en el norte y el oeste de Australia. Las bacterias también se han encontrado en un suministro de agua sin cloro en las zonas rurales de Tailandia. El líquido de irrigación contaminado con B. pseudomallei se asocia con la infección de la herida nosocomial en los hospitales. Sobre la base de la secuenciación completa del genoma de la bacteria, los humanos pueden desempeñar un papel en el traslado de B. pseudomallei de un lugar a otro.
Patogénesis
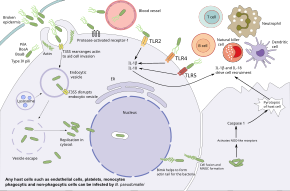
B. pseudomallei tiene la capacidad de infectar varios tipos de células y de evadir las respuestas inmunitarias humanas. Las bacterias entran primero por una ruptura en la piel o la membrana mucosa y se replican en las células epiteliales. A partir de ahí, utilizan la motilidad flagelar para propagarse e infectar varios tipos de células. En el torrente sanguíneo, las bacterias pueden infectar tanto a los fagocitos como a los no fagocitos . B. pseudomallei usa flagelos para moverse cerca de las células huésped , luego se adhiere a las células usando varias proteínas de adhesión, incluida la proteína pilus de tipo IV PilA y las proteínas de adhesión BoaA y BoaB. Además, la adhesión de las bacterias depende parcialmente de la presencia del receptor 1 activado por proteasa de la proteína del huésped , que está presente en la superficie de las células endoteliales , las plaquetas y los monocitos . Una vez unidas, las bacterias ingresan a las células huésped a través de endocitosis y terminan dentro de una vesícula endocítica . A medida que la vesícula se acidifica, B. pseudomallei usa su sistema de secreción de tipo 3 (T3SS) para inyectar proteínas efectoras en la célula huésped, interrumpiendo la vesícula y permitiendo que las bacterias escapen al citoplasma del huésped . Dentro del citoplasma del huésped, las bacterias evitan ser destruidas por la autofagia del huésped utilizando varias proteínas efectoras de T3SS. Las bacterias se replican en el citoplasma del hospedador.
Dentro de la célula huésped, las bacterias se mueven induciendo la polimerización de la actina del huésped detrás de ellas, impulsando a las bacterias hacia adelante. Esta motilidad mediada por actina se logra con el autotransportador BimA, que interactúa con la actina en el extremo de la cola de la bacteria. Impulsadas por la actina, las bacterias empujan contra la membrana del huésped, creando protuberancias que se extienden hacia las células vecinas. Estas protuberancias hacen que las células vecinas se fusionen, lo que lleva a la formación de células gigantes multinucleadas (MNGC). Cuando MNGCs lisan, forman placas (un área clara central con un anillo de células fusionadas) que proporcionan refugio para las bacterias para su posterior replicación o infección latente . Este mismo proceso en las neuronas infectadas puede permitir que las bacterias viajen a través de las raíces nerviosas en la médula espinal y el cerebro, lo que lleva a la inflamación del cerebro y la médula espinal . Además de propagarse de una célula a otra, las bacterias también pueden propagarse a través del torrente sanguíneo y causar sepsis. Las bacterias pueden sobrevivir en células presentadoras de antígenos y células dendríticas . Por lo tanto, estas células actúan como vehículos que transportan las bacterias al sistema linfático, provocando una diseminación generalizada de las bacterias en el cuerpo humano.
Si bien B. pseudomallei puede sobrevivir en células fagocíticas, estas células pueden destruir B. pseudomallei mediante varios mecanismos. Los macrófagos activados por interferón gamma han mejorado la destrucción de B. pseudomallei mediante la producción de óxido nítrico sintasa inducible . También es posible la acidificación del endosoma y la degradación de las bacterias, sin embargo, la cápsula bacteriana y el LPS hacen que B. pseudomallei sea resistente a la degradación lisosómica. Una vez que B. pseudomallei se escapa al citosol del huésped, puede ser reconocido por receptores de reconocimiento de patrones como los receptores tipo NOD , lo que desencadena la formación del inflamasoma y la activación de la caspasa 1 , que induce la muerte de la célula huésped por piroptosis y una mayor activación de el sistema inmune. Varias defensas sistémicas del huésped también contribuyen a la respuesta inmunitaria. B. pseudomallei desencadena tanto el sistema del complemento como la cascada de coagulación ; sin embargo, la cápsula bacteriana gruesa previene la acción del complejo de ataque de la membrana del complemento .
Elementos adicionales del sistema inmunológico son activados por los receptores tipo toll del huésped , como TLR2, TLR4 y TLR5, que reconocen las partes conservadas de las bacterias, como LPS y flagelos. Esta activación da como resultado la producción de citocinas como la interleucina 1 beta (IL-1β) y la interleucina 18 (IL-18). La IL-18 aumenta la producción de IFN a través de las células asesinas naturales , mientras que la IL-1beta reduce la producción de IFN. Estas moléculas inmunitarias impulsan el reclutamiento de otras células inmunitarias, como neutrófilos , células dendríticas , células B y células T, hacia el sitio de la infección. Las células T parecen ser particularmente importantes para controlar B. pseudomallei ; El número de células T aumenta en los supervivientes y el número bajo de células T se asocia con un alto riesgo de muerte por melioidosis. A pesar de esto, la infección por VIH no es un factor de riesgo de melioidosis. Aunque los macrófagos muestran respuestas de citocinas desreguladas en individuos con infección por VIH, la internalización bacteriana y la destrucción intracelular siguen siendo eficaces. Las personas infectadas con B. pseudomallei desarrollan anticuerpos contra la bacteria, y las personas que viven en áreas endémicas tienden a tener anticuerpos en la sangre que reconocen B. pseudomallei , pero la efectividad de estos anticuerpos para prevenir la melioidosis no está clara.
B. pseudomallei puede permanecer latente en el cuerpo humano de 19 a 29 años hasta que se reactiva durante la inmunosupresión o la respuesta al estrés. El sitio de las bacterias durante la infección latente y el mecanismo por el cual evitan el reconocimiento inmunológico durante años no están claros. Entre los mecanismos sugeridos se encuentran el residir en el núcleo de la célula para evitar ser digerido, entrar en una etapa de crecimiento más lento, resistencia a los antibióticos y adaptación genética al entorno del huésped. Los granulomas (que contienen neutrófilos, macrófagos, linfocitos y células gigantes multinucleadas) formados en el sitio de infección en la melioidosis se han asociado con infección latente en humanos.
Diagnóstico
El cultivo bacteriano es el diagnóstico definitivo de melioidosis. B. pseudomallei nunca forma parte de la flora humana. Por lo tanto, cualquier crecimiento de la bacteria es diagnóstico de melioidosis. Los hemocultivos son las muestras más comunes para el diagnóstico, ya que las bacterias se pueden detectar en la sangre en el 50 al 60% de los casos de melioidosis. Otras muestras, como garganta, hisopos rectales, pus de abscesos y esputo, también se pueden utilizar para cultivo. Cuando las bacterias no crecen en personas con fuerte sospecha de melioidosis, se deben tomar cultivos repetidos, ya que los cultivos posteriores pueden resultar positivos. B. pseudomallei puede ser cultivada en agar de sangre de oveja, agar MacConkey , medio de Ashdown (que contiene gentamicina ), o caldo de Ashdown (que contiene colistina ). Las placas de agar para melioidosis deben incubarse a 37 ° C (98,6 ° F) en el aire y deben inspeccionarse diariamente durante cuatro días. En las placas de agar, B. pseudomallei forma colonias cremosas, no hemolíticas , después de 2 días de incubación. Después de 4 días de incubación, las colonias aparecen secas y arrugadas. Las colonias de B. pseudomallei que se cultivan en medio Francis (una modificación del medio Ashdown con una concentración de gentamicina aumentada a 8 mg / l) son amarillas. Para laboratorios ubicados fuera de áreas endémicas, se puede usar agar selectivo para Burkholderia cepacia o agar selectivo para Pseudomonas si no se dispone de medio de Ashdown. Es importante no malinterpretar el crecimiento bacteriano como Pseudomonas o Bacillus spp. También se pueden usar otras herramientas de detección bioquímica para detectar B. pseudomallei , incluido el kit bioquímico API 20NE o 20E combinado con tinción de Gram, prueba de oxidasa , características de crecimiento típicas y resistencia a ciertos antibióticos de la bacteria. Los métodos moleculares como las sondas de rDNA 16S y la reacción en cadena de la polimerasa también se pueden utilizar para detectar B. pseudomallei en cultivo, pero solo están disponibles en laboratorios de investigación y de referencia.
Los análisis de sangre generales en personas con melioidosis muestran recuentos bajos de glóbulos blancos (indica infección), enzimas hepáticas elevadas, niveles elevados de bilirrubina (indica disfunción hepática) y niveles elevados de urea y creatinina (indica disfunción renal). La hipoglucemia y la acidosis predice un peor pronóstico en las personas con melioidosis. Sin embargo, otras pruebas como la proteína C reactiva y los niveles de procalcitonina no son confiables para predecir la gravedad de la infección por melioidosis.
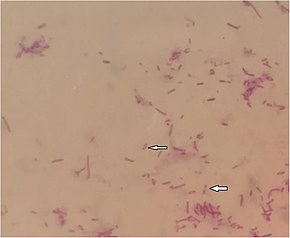
Por microscopía, B. pseudomallei se ve como gramnegativo y con forma de varilla, con una tinción bipolar similar en apariencia a un imperdible. En ocasiones, las bacterias pueden verse directamente en muestras clínicas de personas infectadas, pero la identificación por microscopía óptica no es específica ni sensible . La microscopía de inmunofluorescencia es muy específica para detectar bacterias directamente a partir de muestras clínicas, pero tiene una sensibilidad inferior al 50%. Se ha desarrollado un inmunoensayo de flujo lateral, pero no se ha evaluado de forma exhaustiva. Un número cada vez mayor de laboratorios utiliza espectrometría de masas de ionización / desorción láser asistida por matriz para identificar las bacterias con precisión.
Se han utilizado pruebas serológicas como la hemaglutinación indirecta para detectar la presencia de anticuerpos contra B. pseudomallei . Sin embargo, diferentes grupos de personas tienen niveles muy diferentes de anticuerpos, por lo que la interpretación de estas pruebas depende de la ubicación. En Australia, menos del 5% de las personas tienen anticuerpos contra B. pseudomallei , por lo que la presencia de incluso cantidades relativamente bajas de anticuerpos es inusual y podría sugerir melioidosis. En Tailandia, muchas personas tienen anticuerpos contra B. pseudomallei , por lo que solo una cantidad relativamente alta de anticuerpos en la sangre sugiere melioidosis. Tailandia también utiliza la prueba de anticuerpos inmunofluorescentes directa (IFAT) y la aglutinación con látex. En IFAT, tanto el antígeno de B. pseudomallei como el B. thailandensis pueden usarse para cuantificar la cantidad de anticuerpos producidos contra la bacteria. Por lo tanto, los resultados deben interpretarse con precaución, ya que se puede encontrar una reacción falsa positiva si alguien ha estado expuesto previamente a B. thailandensis no patógena . Aglutinación de látex es útil en la detección de sospechosos B. pseudomallei colonias. Los kits comerciales de ELISA para melioidosis ya no están disponibles en el mercado debido a la baja sensibilidad a la detección de anticuerpos humanos.
Varias modalidades de imágenes también pueden ayudar con el diagnóstico de melioidosis. En la melioidosis aguda con propagación de la bacteria a través del torrente sanguíneo, la radiografía de tórax muestra lesiones nodulares multifocales. También puede mostrar nódulos fusionados o cavitaciones . Para aquellos con melioidosis aguda sin diseminación al torrente sanguíneo, la radiografía de tórax muestra consolidación del lóbulo superior o cavitaciones. En la melioidosis crónica, la progresión lenta de la consolidación del lóbulo superior de los pulmones se asemeja a la tuberculosis. Para los abscesos ubicados en otras partes del cuerpo además de los pulmones, especialmente en el hígado y el bazo, la tomografía computarizada tiene una mayor sensibilidad en comparación con una ecografía. En los abscesos hepáticos y esplénicos, una ecografía muestra lesiones "en forma de diana", mientras que la tomografía computarizada muestra un "signo de panal de abeja" en los abscesos hepáticos. Para la melioidosis que afecta al cerebro, la resonancia magnética tiene mayor sensibilidad que una tomografía computarizada para diagnosticar la lesión. La resonancia magnética muestra lesiones con realce en anillo para la melioidosis cerebral.
Prevención
La melioidosis es una enfermedad de declaración obligatoria en Australia. Esto permite al país monitorear la carga de morbilidad y contener los brotes. La melioidosis solo ha sido una afección de declaración obligatoria en Tailandia desde junio de 2016. Sin embargo, Australia también se embarcó en campañas de concienciación para aumentar la comprensión de la enfermedad por parte de la comunidad. En los Estados Unidos, los trabajadores de laboratorio pueden manipular muestras clínicas de B. pseudomallei en condiciones BSL-2 , mientras que la producción en masa de tales organismos requiere precauciones BSL-3 . Además, se han informado varios casos de infección de melioidosis adquirida en el hospital, por lo que se recomienda a los proveedores de atención médica que practiquen la higiene de las manos y las precauciones universales .
La cloración del agua a gran escala ha tenido éxito en la reducción de B. pseudomallei en el agua en Australia. En los países de ingresos medios a bajos, el agua debe hervirse antes de consumirla. En los países de ingresos altos, el agua podría tratarse con luz ultravioleta para quienes corren el riesgo de contraer melioidosis. Aquellos que corren un alto riesgo de contacto con las bacterias deben usar equipo de protección (como botas y guantes) durante el trabajo. Quienes permanezcan en áreas endémicas deben evitar el contacto directo con el suelo y la exposición al aire libre a lluvias intensas o nubes de polvo. Se prefiere el agua embotellada o hervida para beber.
La profilaxis posterior a la exposición
Después de la exposición a B. pseudomallei (particularmente después de un accidente de laboratorio), se recomienda el tratamiento con cotrimoxazol. Alternativamente, se pueden usar co-amoxiclav y doxiciclina para aquellos que son intolerantes al cotrimoxazol. Dado que el cotrimoxazol puede causar efectos secundarios graves, solo las personas de alto riesgo tienden a recibir dichos tratamientos. En cambio, las personas de bajo riesgo recibirían un seguimiento frecuente.
Vacunación
Se han probado varias vacunas candidatas en modelos animales. Sin embargo, no se ha probado ninguna vacuna candidata en humanos. Los principales obstáculos de las vacunas son la eficacia limitada en modelos animales, el establecimiento del mejor método de administración de vacunas en humanos y los problemas logísticos y financieros para establecer ensayos en humanos en áreas endémicas.
Tratamiento
El tratamiento de la melioidosis se divide en dos etapas, una fase intensiva intravenosa y una fase de erradicación para prevenir la recurrencia. La elección de los antibióticos depende de la susceptibilidad de las bacterias a varios antibióticos. B. pesudomallei generalmente es susceptible a ceftazidima, meropenem, imipenem y co-amoxiclav. Estos medicamentos están diseñados para matar las bacterias. También es susceptible a la doxiciclina, cloranfenicol y cotrimoxazol. Estos medicamentos están diseñados para inhibir el crecimiento de bacterias. Las bacterias son resistentes a la penicilina, ampicilina, de primera y segunda generación de cefalosporina , gentamicina, estreptomicina, tobramicina, macrólidos y polimixinas. Sin embargo, los aislados de B. pseudomallei de la región de Sarawak , Malasia , son susceptibles a la gentamicina.
Fase intensiva
La ceftazidima intravenosa es el fármaco de elección actual para el tratamiento de la melioidosis aguda y debe administrarse durante al menos 10 días. El meropenem , el imipenem y la combinación cefoperazona - sulbactam (sulperazona) también son eficaces. Se puede usar amoxicilina-clavulánico (co-amoxiclav) intravenoso si ninguno de los cuatro fármacos anteriores está disponible; co-amoxiclav previene la muerte por melioidosis, al igual que la ceftazidima. Se administran antibióticos intravenosos durante un mínimo de 10 días. El tiempo medio de desaparición de la fiebre en la melioidosis es de 9 días.
El meropenem es la terapia antibiótica preferida para la melioidosis neurológica y aquellos con shock séptico ingresados en unidades de cuidados intensivos . El cotrimoxazol se recomienda para la melioidosis neurológica, la osteomielitis, la artritis séptica, las infecciones cutáneas y gastrointestinales y los abscesos profundamente asentados. Para infecciones profundas como abscesos de órganos internos, osteomielitis, artritis séptica y melioidosis neurológica, la duración de la administración de antibióticos debe ser más prolongada (hasta 4 a 8 semanas). El tiempo necesario para que se resuelva la fiebre puede ser de más de 10 días en aquellos con una infección profunda. La resistencia a ceftazidima, carbapenémicos y co-amoxiclav es rara en la fase intensiva, pero es más prominente durante la terapia de erradicación. No se observan diferencias entre el uso de cefoperazona / sulbactam o ceftazidima para tratar la melioidosis, ya que ambos muestran tasas de muerte y progresión de la enfermedad similares después del tratamiento. Para aquellos con insuficiencia renal, se debe reducir la dosis de ceftazidima, meropenem y cotrimoxazol. Una vez que la condición clínica mejoró, meropenem se puede cambiar nuevamente a ceftazidima. No está claro si la terapia de combinación de ceftazidima o meropenem reduce las tasas de recaída en la fase inicial de la terapia.
Fase de erradicación
Después del tratamiento de la enfermedad aguda, el tratamiento de erradicación (o mantenimiento) con cotrimoxazol es el fármaco de elección y debe utilizarse durante al menos 3 meses. Para aquellos con melioidosis neurológica y osteomielitis , los medicamentos deben administrarse durante más de 6 meses. Co-amoxiclav y doxiciclina son fármacos de segunda elección. El cotrimoxazol no debe usarse en personas con deficiencia de glucosa-6-fosfato deshidrogenasa , ya que puede causar anemia hemolítica . Otros efectos secundarios, como erupción cutánea, hiperpotasemia , disfunción renal y síntomas gastrointestinales, deberían impulsar la reducción de las dosis de cotrimoxazol. El cloranfenicol ya no se recomienda de forma rutinaria para este propósito. Co-amoxiclav es una alternativa para los pacientes que no pueden tomar cotrimoxazol y doxiciclina (por ejemplo, mujeres embarazadas y niños menores de 12 años), pero no es tan eficaz y tiene una mayor tasa de recaídas. El tratamiento de fármaco único con fluoroquinolona (p. Ej., Ciprofloxacina ) o doxiciclina para la fase de mantenimiento oral es ineficaz.
En Australia, el cotrimoxazol se usa en niños y madres embarazadas después de las primeras 12 semanas de embarazo. Mientras tanto, en Tailandia, el co-amoxiclav es el fármaco preferido por los niños y las mujeres embarazadas. Sin embargo, B. pseudomallei a menudo adquiere resistencia cuando se usa co-amoxiclav. También se han informado casos en los que la melioidosis se trata con éxito con cotrimoxazol durante 3 meses sin pasar por una terapia intensiva siempre que solo se observen manifestaciones cutáneas sin la afectación de órganos internos o sepsis. La resistencia al cotrimoxazol es rara en Australia.
Cirugía
El drenaje quirúrgico está indicado para abscesos grandes y únicos en el hígado, los músculos y la próstata. Sin embargo, para los abscesos múltiples en el hígado, el bazo y el riñón, el drenaje quirúrgico puede no ser posible o necesario. Para la artritis séptica, se requiere lavado y drenaje de artrotomía . Puede ser necesario un desbridamiento quirúrgico . Para aquellos con aneurisma micótico , se requiere cirugía urgente para injertos vasculares protésicos. Puede ser necesaria una terapia de por vida con cotrimoxazol para aquellos con injertos vasculares protésicos. Rara vez es necesario drenar otros abscesos porque la mayoría de ellos pueden resolverse con tratamiento con antibióticos. En Australia, el absceso de próstata puede requerir imágenes y drenaje de rutina.
Otros
Las terapias inmunomoduladoras como el factor estimulante de colonias de granulocitos , la interleucina 7 y el anti-PDI ( muerte celular programada ) podrían ser útiles en el tratamiento de la melioidosis, especialmente para aquellos con shock séptico. Esto se debe a que estos medicamentos podrían ayudar a estimular la función inmunológica del cuerpo humano contra las bacterias.
Pronóstico
En entornos con buenos recursos, donde la enfermedad puede detectarse y tratarse temprano, el riesgo de muerte es del 10%. En entornos de escasos recursos, el riesgo de muerte por la enfermedad es superior al 40%.
Para aquellos con tratamiento incompleto, puede ocurrir la reaparición de los síntomas después de un período de remisión de la enfermedad (" recrudescencia "). Luego, es necesario el ingreso hospitalario para recibir antibióticos por vía intravenosa. Para aquellos que han completado el tratamiento con éxito, la recurrencia también puede ocurrir debido a un recrudecimiento o una nueva infección por melioidosis. Con mejores terapias, la tasa de recrudescencia se ha reducido del 10 al 5%. La nueva infección es ahora más común que el recrudecimiento. Los factores de riesgo de recrudescencia incluyen la gravedad de la enfermedad (los pacientes con hemocultivos positivos o enfermedad multifocal tienen un mayor riesgo de recaída), la elección del antibiótico para la terapia de erradicación (la monoterapia con doxiciclina y la terapia con fluoroquinolonas no son tan efectivas), el cumplimiento deficiente de la terapia de erradicación y duración de la terapia de erradicación menos de 8 semanas.
Las condiciones médicas subyacentes como la diabetes mellitus, la enfermedad renal crónica y el cáncer pueden empeorar la supervivencia y la discapacidad a largo plazo de quienes se recuperan de una infección. La complicación más grave de la melioidosis es la encefalomielitis . Puede causar cuadriparesia (debilidad muscular en todas las extremidades), paraparesia flácida parcial (debilidad muscular de ambas piernas) o pie caído. Para aquellos con infecciones óseas y articulares asociadas a melioidosis previas, pueden ocurrir complicaciones como infección de los senos nasales , deformidades óseas y articulares con rango de movimiento limitado.
Epidemiología
La melioidosis es una enfermedad poco estudiada que sigue siendo endémica en los países en desarrollo. En 2015, se formó la Sociedad Internacional de Melioidosis para crear conciencia sobre la enfermedad. En 2016, se desarrolló un modelo estadístico que mostró que el número es de 165,000 casos por año, de los cuales 138,000 ocurren en Asia Oriental y Meridional y el Pacífico. En aproximadamente la mitad de esos casos (54% o 89.000), la gente morirá. La subnotificación es un problema común, ya que solo se notificaron 1.300 casos en todo el mundo desde 2010, lo que representa menos del 1% de la incidencia proyectada según el modelo. La falta de capacidades de diagnóstico de laboratorio y la falta de conciencia sobre la enfermedad entre los proveedores de atención médica también causa un infradiagnóstico. Incluso si los cultivos bacterianos resultan positivos para B. pesudomallei , pueden descartarse como contaminantes, especialmente en laboratorios en áreas no endémicas. A partir de 2018, la melioidosis no está incluida en la lista de enfermedades tropicales desatendidas de la OMS .
La melioidosis es endémica en partes del sudeste asiático (incluidos Tailandia, Laos, Singapur, Brunei, Malasia, Myanmar y Vietnam), el sur de China, Taiwán y el norte de Australia. Las fuertes lluvias pueden aumentar su extensión hacia el centro de Australia. India y casos esporádicos en América del Sur. La verdadera carga de la melioidosis en África y Oriente Medio sigue siendo desconocida debido a la escasa cantidad de datos. Hubo 24 países africanos y tres países del Medio Oriente que se pronosticaron que serían endémicos con melioidosis, sin embargo, no se informó un solo caso de ellos. Se notificaron un total de 51 casos de melioidosis en Bangladesh entre 1961 y 2017. Sin embargo, la falta de conciencia y de recursos da lugar a un infradiagnóstico de la enfermedad en el país. En los Estados Unidos, se han informado dos casos históricos (1950 y 1971) y tres casos recientes (2010, 2011, 2013) entre personas que no viajaron al extranjero. A pesar de extensas investigaciones, nunca se confirmó el origen de la melioidosis. Una posible explicación es que la importación de productos de plantas medicinales o reptiles exóticos podría haber dado lugar a la introducción de la melioidosis en los Estados Unidos. En Europa, más de la mitad de los casos de melioidosis se importan de Tailandia.
La melioidosis se encuentra en todos los grupos de edad. Para Australia y Tailandia, la edad media de infección es de 50 años; Del 5 al 10% de los pacientes tienen menos de 15 años. El factor de riesgo más importante para desarrollar melioidosis es la diabetes mellitus, seguida del consumo peligroso de alcohol, la enfermedad renal crónica y la enfermedad pulmonar crónica. Más del 50% de las personas con melioidosis tienen diabetes; los diabéticos tienen un riesgo 12 veces mayor de contraer melioidosis. La diabetes disminuye la capacidad de los macrófagos para combatir las bacterias y reduce la producción de células T colaboradoras . La liberación excesiva de factor de necrosis tumoral alfa e interleucina 12 por las células mononucleares aumenta el riesgo de shock séptico. El medicamento para la diabetes glibenclamida también puede mitigar las respuestas inflamatorias de los monocitos. Otros factores de riesgo incluyen talasemia , exposición ocupacional (por ejemplo, agricultores de arroz ), exposición recreativa al suelo, agua, ser hombre, edad mayor de 45 años y uso prolongado de esteroides / inmunosupresión, pero el 8% de los niños y el 20% de los adultos con melioidosis no tienen factores de riesgo. La infección por VIH no predispone a la melioidosis. Se han notificado casos de lactantes posiblemente debido a la transmisión de madre a hijo, una infección adquirida en la comunidad o una infección asociada a la atención sanitaria. Aquellos que están bien también pueden infectarse con B. pseudomallei . Por ejemplo, el 25% de los niños que se quedaron en áreas endémicas comenzaron a producir anticuerpos contra B. pseudomallei entre los 6 meses y los 4 años, lo que sugiere que estuvieron expuestos durante este tiempo. Esto significa que muchas personas sin síntomas darán positivo en las pruebas serológicas en áreas endémicas. En Tailandia, la tasa de seropositividad supera el 50%, mientras que en Australia, la tasa de seropositividad es solo del 5%. La enfermedad está claramente asociada con un aumento de las precipitaciones, y el número de casos aumenta después del aumento de las precipitaciones. Las lluvias intensas aumentan la concentración de bacterias en la capa superior del suelo, lo que aumenta el riesgo de transmitir las bacterias a través del aire.
Historia
El patólogo Alfred Whitmore y su asistente Krishnaswami informaron por primera vez sobre la melioidosis entre los mendigos y los adictos a la morfina en una autopsia en Rangún, actual Myanmar , en un informe publicado en 1912. Arthur Conan Doyle pudo haber leído el informe de 1912 antes de escribir un cuento que involucraba a los ficticios. enfermedad tropical "Fiebre de Tapanuli" en una aventura de Sherlock Holmes . En la historia de 1913 de " El detective moribundo ", Holmes recibió una caja diseñada para inocular a la víctima con "fiebre de Tapanuli" al abrirla. Muchos pensaban que la “fiebre de Tapanuli” representaba la melioidosis. El término "melioidosis" se acuñó por primera vez en 1921. Se distinguía del muermo, una enfermedad de humanos y animales que es similar en presentación, pero causada por un microorganismo diferente. B. pseudomallei , también conocido como bacilo de Whitmore, fue identificado en 1917 en Kuala Lumpur . El primer caso humano de melioidosis se notificó en Sri Lanka en 1927. En 1932, se notificaron 83 casos en Asia meridional y sudoriental con una mortalidad del 98%. En 1936, se notificó el primer caso de melioidosis en animales (ovejas) en Madagascar, Sudáfrica. En 1937, el suelo y el agua fueron identificados como hábitats de B. pseudomallei . Durante la Guerra de Vietnam 1967-1973, se registraron 343 soldados estadounidenses con melioidosis, con cerca de 50 casos transmitidos a través de la inhalación. Se pensaba que un brote de melioidosis en el zoológico de París en la década de 1970 (conocido como L'affaire du jardin des plantes ) se originó a partir de un panda o caballos importados de Irán. La primera evidencia de B. pseudomallei (en el suelo) en Brasil se informó en 1983.
Antes de 1989, el tratamiento estándar para la melioidosis aguda era una combinación de tres fármacos de cloranfenicol, cotrimoxazol y doxiciclina; este régimen está asociado con una tasa de mortalidad del 80% y ya no se usa a menos que no haya otras alternativas disponibles. Los tres fármacos son bacteriostáticos (detienen el crecimiento de la bacteria, pero no la matan) y la acción del cotrimoxazol antagoniza tanto al cloranfenicol como a la doxiciclina. Aerosolizada B. pseudomallei primero fue aislado en 1989. En el mismo año, ceftazidima había sido demostrado que reduce el riesgo de muerte de melioidosis del 74% al 37%. B. pseudomallei se clasificó previamente como parte del género Pseudomonas hasta 1992. En 1992, el patógeno se denominó formalmente B. pseudomallei . El nombre melioidosis se deriva del griego melis (μηλις) que significa "un moquillo de asnos" con los sufijos -oid que significa "similar a" y -osis que significa "una condición", es decir, una condición similar al muermo. En 2002, B. pseudomallei se clasificó como "agente de categoría B". El mismo año se desarrolló una vacuna viva atenuada en ratones. En 2003, se desarrolló la tipificación de secuencias multilocus para B. pseudomallei . En 2012, los Centros para el Control de Enfermedades de EE. UU. Clasificaron a B. pseudomallei como un "agente selecto de nivel 1". En 2014, se estableció cotrimoxazol como terapia de erradicación oral. En 2015, se detectó ADN de B. pseudomallei en aire filtrado mediante PCR cuantitativa. En 2016, se desarrolló un modelo estadístico para predecir la ocurrencia de melioidosis global por año. En 2017, la secuenciación del genoma completo sugirió a Australia como el primer reservorio de melioidosis.
Sinónimos
- Pseudoglanders
- Enfermedad de Whitmore (después del Capitán Alfred Whitmore , quien describió por primera vez la enfermedad)
- Enfermedad del jardinero de Nightcliff ( Nightcliff es un suburbio de Darwin, Australia, donde la melioidosis es endémica)
- Enfermedad de los arrozales
- Septicemia del inyector de Morphia
Guerra biológica
Se ha expresado interés en la melioidosis porque tiene el potencial de desarrollarse como arma biológica . Los alemanes utilizaron otra bacteria similar, B. mallei , en la Primera Guerra Mundial para infectar el ganado enviado a los países aliados. Durante la Segunda Guerra Mundial, los japoneses llevaron a cabo la infección deliberada de prisioneros de guerra humanos y animales con B. mallei en el distrito de Pingfang de China . Según se informa, la Unión Soviética usó B. mallei durante la guerra soviético-afgana en 1982 y 1984. B. pseudomallei , como B. mallei , fue estudiada tanto por Estados Unidos como por la Unión Soviética como un potencial agente de guerra biológica, pero nunca se utilizó como arma. Otros países como Irán, Irak, Corea del Norte y Siria pueden haber investigado las propiedades de B. pseudomallei para armas biológicas. La bacteria está fácilmente disponible en el medio ambiente y su producción es rentable. También puede aerosolizarse y transmitirse por inhalación. Sin embargo, B. pseudomallei nunca se ha utilizado en la guerra biológica.
Referencias
enlaces externos
| Clasificación | |
|---|---|
| Recursos externos |
- Genomas de Burkholderia pseudomallei e información relacionada en PATRIC , un Centro de Recursos de Bioinformática financiado por NIAID
- Monografía sobre Melioidosis ( ISBN 978-0-444-53479-8 ); Elsevier Press, 2012, https://www.researchgate.net/publication/354857974_Monograph_Melioidosis-a-century-of-observation-and-research_ISBN_978-0-444-53479-8