Compuestos de magnesio de baja valencia - Low valent magnesium compounds
Se conocen varios compuestos estables de magnesio de baja valencia que contienen un enlace metal-metal, Mg-Mg, donde el magnesio exhibe el estado de oxidación formal de +1. Estos compuestos generalmente tienen la fórmula L 2 Mg 2 , donde L representa un ligando voluminoso. Los primeros ejemplos de estos compuestos estables de magnesio (I) se informaron en 2007. La química del Mg está dominada por el estado de oxidación +2 y antes de 2007 solo ejemplos de compuestos cristalinos con distancias cortas de Mg-Mg que pueden indicar un Mg-Mg Se conocían enlaces, como los hidruros metálicos ternarios Mg 2 RuH 4 , Mg 3 RuH 3 y Mg 4 IrH 5 y diboruro de magnesio . Los cálculos también habían indicado la estabilidad del catión Mg 2 2+ .
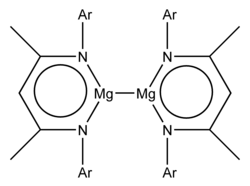
La preparación de los primeros compuestos realizados implicó la reducción de complejos de yodo Mg II con potasio metálico y los ligandos voluminosos fueron:
- un guanidinato, "priso", [(Ar) NC (NPr i 2 ) N (Ar)] - donde Ar = 2,6-diisopropilfenilo y Pr i = isopropilo
- un cetiminato, " nacnac ", {[(Ar) NC (Me)] 2 CH} - , - donde Ar = 2,6-diisopropilfenilo y Me = metilo
Ambos ejemplos tienen la fórmula L 2 Mg 2 , donde L representa el ligando bidentado aniónico voluminoso . Los estudios cristalográficos de rayos X mostraron una longitud de enlace Mg-Mg de 285,1 pm y 284,6 pm. Los estudios teóricos indican una formulación esencialmente iónica Mg 2 2+ (L - ) 2 . El ion Mg 2 2+ es el análogo del grupo 2 del grupo 12 Hg 2 2+ (presente, por ejemplo, en el cloruro de mercurio (I) ) y los iones Cd 2 2+ (presentes en el tetracloroaluminato de cadmio (I) ).
Desde entonces se han preparado una variedad de compuestos de Mg (I) estables, algunos se funden por encima de 200 ° C, algunos son incoloros, otros coloreados, pero todos involucran ligandos muy voluminosos. También se han preparado complejos de LMgMgL con ligandos monodentados y en estos la coordinación del átomo de Mg aumenta de tres a cuatro. Los dímeros de magnesio (I) han demostrado ser agentes reductores útiles, por ejemplo, en la preparación de compuestos de estaño (I).