Oxidación de Jones - Jones oxidation
| Oxidación de Jones | |
|---|---|
| Lleva el nombre de | Ewart Jones |
| Tipo de reacción | Reacción redox orgánica |
| Identificadores | |
| Portal de química orgánica | Jones-oxidación |
| ID de ontología RSC | RXNO: 0000356 |
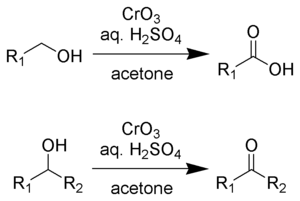
La oxidación de Jones es una reacción orgánica para la oxidación de alcoholes primarios y secundarios a ácidos carboxílicos y cetonas , respectivamente. Lleva el nombre de su descubridor, Sir Ewart Jones . La reacción fue un método temprano para la oxidación de alcoholes. Su uso ha disminuido debido a que se han desarrollado reactivos más suaves y selectivos, por ejemplo, el reactivo de Collins .
El reactivo de Jones es una solución preparada disolviendo trióxido de cromo en ácido sulfúrico acuoso . Para efectuar una oxidación de Jones, esta mezcla ácida se agrega luego a una solución de acetona del sustrato. Alternativamente, se puede usar dicromato de potasio en lugar de trióxido de cromo. La oxidación es muy rápida y bastante exotérmica . Los rendimientos suelen ser altos. El reactivo es conveniente y económico. Sin embargo, los compuestos de Cr (VI) son cancerígenos, lo que disuade el uso de esta metodología.
Estequiometría y mecanismo
El reactivo de Jones convertirá los alcoholes primarios y secundarios en aldehídos y cetonas, respectivamente. Dependiendo de las condiciones de reacción, los aldehídos pueden convertirse luego en ácidos carboxílicos. Para las oxidaciones a aldehídos y cetonas, dos equivalentes de ácido crómico oxidan tres equivalentes del alcohol:
- 2 HCrO 4 - + 3 RR'C (OH) H + 8 H + + 4 H 2 O → 2 [Cr (H 2 O) 6 ] 3+ + 3 RR'CO
Para la oxidación de alcoholes primarios a ácidos carboxílicos, 4 equivalentes de ácido crómico oxidan 3 equivalentes del alcohol. El aldehído es un intermedio.
- 4 HCrO 4 - + 3 RCH 2 OH + 16 H + + 11 H 2 O → 4 [Cr (H 2 O) 6 ] 3+ + 3 RCOOH
Los productos inorgánicos son verdes, característicos de los complejos de cromo (III) aquo .
Como muchas otras oxidaciones de alcoholes por óxidos metálicos, la reacción procede a través de la formación de un éster de cromato mixto : Estos ésteres tienen la fórmula CrO 3 (OCH 2 R) -
- CrO 3 (OH) - + RCH 2 OH → CrO 3 (OCH 2 R) - + H 2 O
Como los ésteres convencionales, la formación de este éster de cromato es acelerada por el ácido. Estos ésteres pueden aislarse cuando el alcohol es terciario porque carecen del hidrógeno α que se perdería para formar el carbonilo. Por ejemplo, utilizando alcohol terc- butílico , se puede aislar cromato de terc- butilo ((CH 3 ) 3 CO) 2 CrO 2 ), que en sí mismo es un buen oxidante.
Para aquellas estructuras con hidrógeno alfa al oxígeno, los ésteres de cromato se degradan, liberando el producto carbonilo y un producto Cr (IV) mal definido:
- CrO 3 (OCH 2 R) - → "CrO 2 OH - " + O = CHR
Los alcoholes deuterados HOCD 2 R se oxidan aproximadamente seis veces más lentamente que los derivados no deuterados. Este gran efecto de isótopo cinético muestra que el enlace C – H (o C – D) se rompe en el paso que determina la velocidad .
La estequiometría de la reacción implica a la especie Cr (IV) "CrO 2 OH - ", que se compaporciona con el ácido crómico para dar un óxido de Cr (V), que también funciona como oxidante del alcohol.
Se propone que la oxidación de los aldehídos proceda a través de la formación de intermedios similares al hemiacetal , que surgen de la adición del enlace O 3 CrO-H - a través del enlace C = O.
El reactivo rara vez oxida enlaces insaturados.
Reacciones y aplicaciones ilustrativas
Sigue siendo útil en síntesis orgánica . Se puede utilizar una variedad de técnicas espectroscópicas, incluida la espectroscopía infrarroja , para controlar el progreso de una reacción de oxidación de Jones. En un momento, la oxidación de Jones se usó en alcoholímetros .
Procesos relacionados
Los principales reactivos son reactivo de Collins, PDC y PCC. Estos reactivos representan mejoras sobre los reactivos de cromo inorgánico (VI) como el reactivo de Jones .
Referencias históricas
- Bowden, K .; Heilbron, MI; Jones, ER H (1946). "13. Investigaciones sobre compuestos acetilénicos. Parte I. La preparación de cetonas acetilénicas por oxidación de carbinoles y glicoles acetilénicos". J. Chem. Soc. : 39. doi : 10.1039 / jr9460000039 .
- Heilbron, MI; Jones, ERH; Sondheimer, F (1949). "129. Investigaciones sobre compuestos acetilénicos. Parte XV. La oxidación de carbinoles y glicoles acetilénicos primarios". J. Chem. Soc. : 604. doi : 10.1039 / jr9490000604 .
- Bladon, P; Fabián, Joyce M .; Henbest, HB; Koch, HP; Madera, Geoffrey W. (1951). "532. Estudios en el grupo de los esteroles. Parte LII. Absorción infrarroja de centros etilénicos trisustituidos y tetrasustituidos nucleares". J. Chem. Soc. : 2402. doi : 10.1039 / jr9510002402 .
- Jones, ER H (1953). "92. La química de los triterpenos. Parte XIII. La caracterización ulterior del ácido poliporénico A". J. Chem. Soc. : 457. doi : 10.1039 / jr9530000457 .
- Jones, ER H (1953). "520. La química de los triterpenos y compuestos relacionados. Parte XVIII. Elucidación de la estructura del ácido poliporénico C". J. Chem. Soc. : 2548. doi : 10.1039 / jr9530002548 .
- Jones, ER H (1953). "599. La química de los triterpenos y compuestos relacionados. Parte XIX. Más pruebas sobre la estructura del ácido poliporénico A". J. Chem. Soc. : 3019. doi : 10.1039 / jr9530003019 .
- C. Djerassi , R. Engle y A. Bowers (1956). "Notas - La conversión directa de Δ5-3β-alcoholes esteroides en Δ5- y Δ4-3-cetonas". J. Org. Chem. 21 (12): 1547-1549. doi : 10.1021 / jo01118a627 .