Punto isoeléctrico - Isoelectric point
El punto isoeléctrico ( pI , pH (I) , IEP ), es el pH al que una molécula no lleva carga eléctrica neta o es eléctricamente neutra en la media estadística . La nomenclatura estándar para representar el punto isoeléctrico es pH (I). Sin embargo, también se utiliza pI. Por brevedad , este artículo utiliza pI. La carga neta de la molécula se ve afectada por el pH de su entorno circundante y puede cargarse más positiva o negativamente debido a la ganancia o pérdida, respectivamente, de protones (H + ).
Las superficies se cargan naturalmente para formar una doble capa . En el caso común cuando los iones que determinan la carga superficial son H + / HO - , la carga superficial neta se ve afectada por el pH del líquido en el que se sumerge el sólido.
El valor pI puede afectar la solubilidad de una molécula a un pH dado. Estas moléculas tienen una solubilidad mínima en agua o en soluciones salinas al pH que corresponde a su pI y, a menudo, precipitan de la solución . Las moléculas anfóteras biológicas , como las proteínas, contienen grupos funcionales tanto ácidos como básicos . Los aminoácidos que forman las proteínas pueden ser de naturaleza positiva, negativa, neutra o polar, y juntos dan a una proteína su carga general. A un pH por debajo de su pI, las proteínas tienen una carga neta positiva; por encima de su pI, tienen una carga neta negativa. Las proteínas pueden, por lo tanto, separarse por carga neta en un gel de poliacrilamida usando electroforesis preparativa en gel , que usa un pH constante para separar proteínas o enfoque isoeléctrico , que usa un gradiente de pH para separar proteínas. El enfoque isoeléctrico es también el primer paso en la electroforesis en gel de poliacrilamida en gel 2-D .
En las biomoléculas, las proteínas se pueden separar mediante cromatografía de intercambio iónico . Las proteínas biológicas están formadas por compuestos de aminoácidos bipolares ; la carga neta de estas proteínas puede ser positiva o negativa dependiendo del pH del ambiente. El pI específico de la proteína diana se puede usar para modelar el proceso y luego el compuesto se puede purificar del resto de la mezcla. Se pueden usar tampones de varios pH para este proceso de purificación para cambiar el pH del medio ambiente. Cuando una mezcla que contiene una proteína diana se carga en un intercambiador de iones, la matriz estacionaria puede estar cargada positivamente (para aniones móviles) o cargada negativamente (para cationes móviles). A valores de pH bajos, la carga neta de la mayoría de las proteínas de la mezcla es positiva; en los intercambiadores de cationes, estas proteínas con carga positiva se unen a la matriz con carga negativa. A valores de pH altos, la carga neta de la mayoría de las proteínas es negativa, donde se unen a la matriz cargada positivamente en los intercambiadores de aniones. Cuando el ambiente tiene un valor de pH igual al pI de la proteína, la carga neta es cero y la proteína no está unida a ningún intercambiador y, por lo tanto, puede eluirse.
Calcular valores de pI
Para un aminoácido con solo una amina y un grupo carboxilo , el pI se puede calcular a partir de la media de los pKas de esta molécula.
El pH de un gel electroforético se determina mediante el tampón utilizado para ese gel. Si el pH del tampón está por encima del pI de la proteína que se está procesando, la proteína migrará al polo positivo (la carga negativa es atraída por un polo positivo). Si el pH del tampón está por debajo del pI de la proteína que se está procesando, la proteína migrará al polo negativo del gel (la carga positiva se atrae al polo negativo). Si la proteína se procesa con un pH de tampón que es igual al pI, no migrará en absoluto. Esto también es cierto para los aminoácidos individuales.
Ejemplos de

|
|
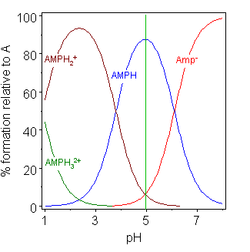
| glicina pK = 2,72, 9,60 | monofosfato de adenosina pK = 0,9, 3,8, 6,1 |
En los dos ejemplos (a la derecha), el punto isoeléctrico se muestra con la línea vertical verde. En glicina, los valores de pK están separados por casi 7 unidades. Así, en la fase gaseosa, la concentración de la especie neutra, glicina (GlyH), es efectivamente el 100% de la concentración analítica de glicina. La glicina puede existir como un ion híbrido en el punto isoeléctrico, pero la constante de equilibrio para la reacción de isomerización en solución
- H 2 NCH 2 CO 2 H ⇌ H 3 N + CH 2 CO 2 -
no es conocido.
El otro ejemplo, el monofosfato de adenosina , ilustra el hecho de que, en principio, puede estar implicada una tercera especie. De hecho, la concentración de (AMP) H 3 2+ es insignificante en el punto isoeléctrico en este caso. Si el pI es mayor que el pH, la molécula tendrá carga positiva.
Punto isoeléctrico de péptidos y proteínas.
Se han desarrollado varios algoritmos para estimar puntos isoeléctricos de péptidos y proteínas . La mayoría usa la ecuación de Henderson-Hasselbalch con diferentes valores de pK. Por ejemplo, dentro del modelo propuesto por Bjellqvist y colaboradores, los pK se determinaron entre inmovilinas estrechamente relacionadas, al enfocar la misma muestra en gradientes de pH superpuestos. También se han propuesto algunas mejoras en la metodología (especialmente en la determinación de los valores de pK para aminoácidos modificados). Los métodos más avanzados tienen en cuenta el efecto de los aminoácidos adyacentes ± 3 residuos de un ácido aspártico o glutámico cargado , los efectos sobre el extremo C libre, y aplican un término de corrección a los valores de pK correspondientes utilizando un algoritmo genético . Otros enfoques recientes se basan en un algoritmo de máquina de vectores de soporte y la optimización de pKa contra puntos isoeléctricos de proteínas / péptidos conocidos experimentalmente.
Además, el punto isoeléctrico de proteínas medido experimentalmente se agregó a las bases de datos. Recientemente, también se desarrolló una base de datos de puntos isoeléctricos para todas las proteínas predichas usando la mayoría de los métodos disponibles.
Materiales cerámicos
Los puntos isoeléctricos (IEP) de las cerámicas de óxido metálico se utilizan ampliamente en la ciencia de los materiales en varios pasos de procesamiento acuoso (síntesis, modificación, etc.). En ausencia de especies quimisorbidas o fisisorbidas, se supone generalmente que las superficies de las partículas en suspensión acuosa están cubiertas con especies de hidroxilo superficiales, M-OH (donde M es un metal como Al, Si, etc.). A valores de pH por encima del IEP, la especie de superficie predominante es MO - , mientras que a valores de pH por debajo del IEP, predominan las especies M-OH 2 + . A continuación se enumeran algunos valores aproximados de cerámicas comunes:
| Material | IEP | Material | IEP | Material | IEP | Material | IEP | Material | IEP | Material | IEP |
|---|---|---|---|---|---|---|---|---|---|---|---|
| WO 3 | 0,2-0,5 | Ta 2 O 5 | 2,7-3,0 | δ-MnO 2 | 1,5 | Fe 2 O 3 | 3.3-6.7 | Fe 2 O 3 | 8.4-8.5 | ZnO | 8,7-10,3 |
| Sb 2 O 5 | <0,4-1,9 | SnO 2 | 4-5,5 (7,3) | β-MnO 2 | 7.3 | Director ejecutivo 2 | 6,7-8,6 | α Al 2 O 3 | 8-9 | NiO | 10-11 |
| V 2 O 5 | 1-2 (3) | ZrO 2 | 4-11 | TiO 2 | 2,8-3,8 | Cr 2 O 3 | 6.2-8.1 (7) | Si 3 N 4 | 9 | PbO | 10,7-11,6 |
| SiO 2 | 1,7-3,5 | MnO 2 | 4-5 | Si 3 N 4 | 6-7 | γ Al 2 O 3 | 7-8 | Y 2 O 3 | 7,15-8,95 | La 2 O 3 | 10 |
| Sic | 2-3,5 | ITO | 6 | Fe 3 O 4 | 6.5-6.8 | Tl 2 O | 8 | CuO | 9.5 | MgO | 12-13 (9,8-12,7) |
Nota: La siguiente lista proporciona el punto isoeléctrico a 25 ° C para materiales seleccionados en agua. El valor exacto puede variar ampliamente, dependiendo de factores del material como la pureza y la fase, así como de parámetros físicos como la temperatura. Además, la medición precisa de los puntos isoeléctricos puede ser difícil, por lo que muchas fuentes a menudo citan valores diferentes para los puntos isoeléctricos de estos materiales.
Los óxidos mixtos pueden presentar valores de punto isoeléctrico intermedios a los de los correspondientes óxidos puros. Por ejemplo, inicialmente se midió que un aluminosilicato amorfo preparado sintéticamente (Al 2 O 3 -SiO 2 ) tenía un IEP de 4,5 (el comportamiento electrocinético de la superficie estaba dominado por especies de Si-OH de superficie, lo que explica el valor de IEP relativamente bajo). Otros han informado valores de IEP significativamente más altos (pH 6 a 8) para 3Al 2 O 3 -2SiO 2 . De manera similar, también se reportó IEP de titanato de bario , BaTiO 3 en el rango 5-6 mientras que otros obtuvieron un valor de 3. Se estudiaron mezclas de titania (TiO 2 ) y zirconia (ZrO 2 ) y se encontró que tenían un punto isoeléctrico entre 5.3 -6,9, variando de forma no lineal con% (ZrO 2 ). La carga superficial de los óxidos mixtos se correlacionó con la acidez. Un mayor contenido de titania condujo a un aumento de la acidez de Lewis, mientras que los óxidos ricos en zirconia mostraron una acidez brillante. Los diferentes tipos de acidez produjeron diferencias en las tasas y capacidades de adsorción de iones.
Punto isoeléctrico versus punto de carga cero
Los términos punto isoeléctrico (IEP) y punto de carga cero (PZC) a menudo se usan indistintamente, aunque bajo ciertas circunstancias, puede ser productivo hacer la distinción.
En sistemas en los que H + / OH - son los iones determinantes de potencial de la interfaz, el punto de carga cero se da en términos de pH. El pH al cual la superficie exhibe una carga eléctrica neta neutra es el punto de carga cero en la superficie. Los fenómenos electrocinéticos generalmente miden el potencial zeta , y un potencial zeta cero se interpreta como el punto de carga neta cero en el plano de corte . Esto se denomina punto isoeléctrico. Por lo tanto, el punto isoeléctrico es el valor de pH en el que la partícula coloidal permanece estacionaria en un campo eléctrico. Se espera que el punto isoeléctrico sea algo diferente del punto de carga cero en la superficie de la partícula, pero esta diferencia a menudo se ignora en la práctica para las llamadas superficies prístinas, es decir, superficies sin cargas positivas o negativas específicamente adsorbidas . En este contexto, se entiende por adsorción específica la adsorción que se produce en una capa Stern o quimisorción . Por lo tanto, el punto de carga cero en la superficie se considera igual al punto isoeléctrico en ausencia de adsorción específica en esa superficie.
Según Jolivet, en ausencia de cargas positivas o negativas, la superficie se describe mejor mediante el punto de carga cero. Si las cargas positivas y negativas están presentes en cantidades iguales, entonces este es el punto isoeléctrico. Así, el PZC se refiere a la ausencia de cualquier tipo de carga superficial, mientras que el IEP se refiere a un estado de carga superficial neta neutra. La diferencia entre los dos, por lo tanto, es la cantidad de sitios cargados en el punto de carga neta cero. Jolivet usa las constantes de equilibrio de superficie intrínsecas, p K - y p K + para definir las dos condiciones en términos del número relativo de sitios cargados:
Para Δp K grande (> 4 según Jolivet), la especie predominante es MOH mientras que hay relativamente pocas especies cargadas, por lo que el PZC es relevante. Para valores pequeños de Δp K , hay muchas especies cargadas en números aproximadamente iguales, por lo que se habla del IEP.
Ver también
- Ecuación de Henderson-Hasselbalch
- Enfoque isoeléctrico
- potencial zeta
- Deposición electroforética
- Punto isoiónico
- constante de disociación del ácido pK
- QPNC-PAGE
Referencias
Otras lecturas
- Nelson DL, Cox MM (2004). Principios de bioquímica de Lehninger . WH Freeman; 4ª edición (tapa dura). ISBN 0-7167-4339-6
- Kosmulski M. (2009). Carga superficial y puntos de carga cero . Prensa CRC; 1ª edición (tapa dura). ISBN 978-1-4200-5188-9
enlaces externos
- IPC - Calculadora de punto isoeléctrico - calcule el punto isoeléctrico de la proteína utilizando más de 15 métodos
- prot pi - punto isoeléctrico de proteínas - un programa en línea para calcular pI de proteínas (incluye múltiples subunidades y modificaciones postraduccionales)
- CurTiPot : un conjunto de hojas de cálculo para calcular los equilibrios ácido-base (gráfico de carga versus pH de moléculas anfóteras, por ejemplo, aminoácidos)
- pICalculax : predictor de punto isoeléctrico (pI) para péptidos y proteínas modificados químicamente
- SWISS-2DPAGE : una base de datos de puntos isoeléctricos procedentes de electroforesis en gel de poliacrilamida bidimensional (~ 2000 proteínas)
- PIP-DB : una base de datos de puntos isoeléctricos de proteínas (~ 5000 proteínas)
- Proteoma-pI : una base de datos de puntos isoeléctricos del proteoma (punto isoeléctrico predicho para todas las proteínas)


![{\ mathrm {p}} K ^ {-} - {\ mathrm {p}} K ^ {+} = \ Delta {\ mathrm {p}} K = \ log {{\ frac {\ left [{\ mathrm {MOH}} \ right] ^ {2}} {\ left [{\ mathrm {MOH}} {_ {2} ^ {+}} \ right] \ left [{\ mathrm {MO}} ^ {-} \Derecha]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1e3191d7ab56090ff3c419b53868c6c52134d80a)