Hassium - Hassium
| Hassium | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciación |
/ H æ s i ə m / ( escuchar ) |
||||||||||||||||||||
| Número de masa | [269] (datos no decisivos) | ||||||||||||||||||||
| Hassium en la tabla periódica | |||||||||||||||||||||
| |||||||||||||||||||||
| Número atómico ( Z ) | 108 | ||||||||||||||||||||
| Grupo | grupo 8 | ||||||||||||||||||||
| Período | período 7 | ||||||||||||||||||||
| Cuadra | bloque d | ||||||||||||||||||||
| Configuración electronica | [ Rn ] 5f 14 6d 6 7s 2 | ||||||||||||||||||||
| Electrones por capa | 2, 8, 18, 32, 32, 14, 2 | ||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||
| Fase en STP | sólido (predicho) | ||||||||||||||||||||
| Densidad (cerca de rt ) | 27-29 g / cm 3 (predicho) | ||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||
| Estados de oxidación | (+2), ( +3 ), ( +4 ), (+6), +8 (corchetes: predicción ) | ||||||||||||||||||||
| Energías de ionización | |||||||||||||||||||||
| Radio atómico | empírico: 126 pm (estimado) | ||||||||||||||||||||
| Radio covalente | 134 pm (estimado) | ||||||||||||||||||||
| Otras propiedades | |||||||||||||||||||||
| Ocurrencia natural | sintético | ||||||||||||||||||||
| Estructura cristalina | hexagonal compacta (hcp)
(predicho) |
||||||||||||||||||||
| Número CAS | 54037-57-9 | ||||||||||||||||||||
| Historia | |||||||||||||||||||||
| Nombrar | después de Hassia , latín de Hesse , Alemania, donde se descubrió | ||||||||||||||||||||
| Descubrimiento | Gesellschaft für Schwerionenforschung (1984) | ||||||||||||||||||||
| Principales isótopos de hassio | |||||||||||||||||||||
| |||||||||||||||||||||
El hasio es un elemento químico con el símbolo Hs y el número atómico 108. El hasio es altamente radiactivo ; sus isótopos más estables conocidos tienen vidas medias de aproximadamente diez segundos. Uno de sus isótopos, 270 Hs, tiene números mágicos tanto de protones como de neutrones para núcleos deformados, lo que le confiere una mayor estabilidad frente a la fisión espontánea . Hassium es un elemento superpesado ; se ha producido en un laboratorio sólo en cantidades muy pequeñas fusionando núcleos pesados con núcleos más ligeros. Se han formulado hipótesis sobre apariciones naturales del elemento, pero nunca se han encontrado.
En la tabla periódica de elementos, el hasio es un elemento transactínido , un miembro del séptimo período y del grupo 8 ; por tanto, es el sexto miembro de la serie 6d de metales de transición . Los experimentos químicos han confirmado que el hasio se comporta como el homólogo más pesado del osmio , reaccionando fácilmente con el oxígeno para formar un tetróxido volátil . Las propiedades químicas del hasio se han caracterizado solo en parte, pero se comparan bien con la química de los otros elementos del grupo 8.
La principal innovación que condujo al descubrimiento del hassio fue la técnica de fusión en frío, en la que los núcleos fusionados no diferían tanto en masa como en técnicas anteriores. Se basaba en una mayor estabilidad de los núcleos diana, lo que a su vez reducía la energía de excitación. Esto disminuyó el número de eyecciones de neutrones durante la síntesis, creando núcleos resultantes más pesados y estables. La técnica se probó por primera vez en el Instituto Conjunto de Investigaciones Nucleares (JINR) en Dubna , Óblast de Moscú , SFSR de Rusia , Unión Soviética , en 1974. El JINR utilizó esta técnica para intentar la síntesis del elemento 108 en 1978, en 1983 y en 1984; el último experimento resultó en una afirmación de que se había producido el elemento 108. Más tarde, en 1984, siguió una afirmación de síntesis de la Gesellschaft für Schwerionenforschung (GSI) en Darmstadt , Hesse , Alemania Occidental . El informe de 1993 del Transfermium Working Group, formado por la Unión Internacional de Química Pura y Aplicada y la Unión Internacional de Física Pura y Aplicada , concluyó que el informe de Darmstadt era concluyente por sí solo, mientras que el de Dubna no lo era, y un crédito importante fue asignado a los científicos alemanes. GSI anunció formalmente que deseaban nombrar el elemento hassium en honor al estado alemán de Hesse (Hassia en latín), hogar de la instalación en 1992; este nombre fue aceptado como definitivo en 1997.
Introducción a los elementos más pesados

| Video externo | |
|---|---|
|
|
Los núcleos atómicos más pesados se crean en reacciones nucleares que combinan otros dos núcleos de tamaño desigual en uno; aproximadamente, cuanto más desiguales son los dos núcleos en términos de masa, mayor es la posibilidad de que reaccionen. El material hecho de los núcleos más pesados se convierte en un objetivo, que luego es bombardeado por el haz de núcleos más ligeros. Dos núcleos solo pueden fusionarse en uno si se acercan lo suficiente; normalmente, los núcleos (todos cargados positivamente) se repelen entre sí debido a la repulsión electrostática . La interacción fuerte puede superar esta repulsión, pero solo a una distancia muy corta de un núcleo; Por tanto, los núcleos de los haces se aceleran enormemente para hacer que dicha repulsión sea insignificante en comparación con la velocidad del núcleo del haz. Acercarse por sí solo no es suficiente para que dos núcleos se fusionen: cuando dos núcleos se acercan entre sí, generalmente permanecen juntos durante aproximadamente 10-20 segundos y luego se separan (no necesariamente en la misma composición que antes de la reacción) en lugar de formar un solo núcleo. núcleo. Si se produce la fusión, la fusión temporal, denominada núcleo compuesto, es un estado excitado . Para perder su energía de excitación y alcanzar un estado más estable, un núcleo compuesto se fisiona o expulsa uno o varios neutrones , que se llevan la energía. Esto ocurre aproximadamente entre 10 y 16 segundos después de la colisión inicial.
El rayo atraviesa el objetivo y llega a la siguiente cámara, el separador; si se produce un nuevo núcleo, se transporta con este rayo. En el separador, el núcleo recién producido se separa de otros nucleidos (el del haz original y cualquier otro producto de reacción) y se transfiere a un detector de barrera de superficie , que detiene el núcleo. Se marca la ubicación exacta del próximo impacto en el detector; también están marcadas su energía y la hora de la llegada. La transferencia tarda entre 10 y 6 segundos; para ser detectado, el núcleo debe sobrevivir tanto tiempo. El núcleo se registra nuevamente una vez que se registra su desintegración, y se miden la ubicación, la energía y el tiempo de desintegración.
La estabilidad del núcleo es proporcionada por la interacción fuerte. Sin embargo, su alcance es muy corto; a medida que los núcleos se hacen más grandes, su influencia sobre los nucleones más externos ( protones y neutrones) se debilita. Al mismo tiempo, el núcleo se rompe por la repulsión electrostática entre protones, ya que tiene un alcance ilimitado. Por tanto, los núcleos de los elementos más pesados se predicen teóricamente y hasta ahora se ha observado que se desintegran principalmente a través de modos de desintegración causados por dicha repulsión: desintegración alfa y fisión espontánea ; estos modos son predominantes para núcleos de elementos superpesados . Las desintegraciones alfa son registradas por las partículas alfa emitidas y los productos de la desintegración son fáciles de determinar antes de la desintegración real; si tal desintegración o una serie de desintegraciones consecutivas produce un núcleo conocido, el producto original de una reacción se puede determinar aritméticamente. Sin embargo, la fisión espontánea produce varios núcleos como productos, por lo que el nucleido original no se puede determinar a partir de sus hijas.
La información disponible para los físicos que pretenden sintetizar uno de los elementos más pesados es, por lo tanto, la información recopilada en los detectores: ubicación, energía y tiempo de llegada de una partícula al detector, y los de su desintegración. Los físicos analizan estos datos y buscan concluir que efectivamente fue causado por un nuevo elemento y no pudo haber sido causado por un nucleido diferente al que se afirma. A menudo, los datos proporcionados son insuficientes para llegar a la conclusión de que definitivamente se creó un nuevo elemento y no hay otra explicación para los efectos observados; Se han cometido errores en la interpretación de los datos.
Descubrimiento

Fusión fría
Las reacciones nucleares utilizadas en la década de 1960 produjeron altas energías de excitación que requirieron la expulsión de cuatro o cinco neutrones; estas reacciones utilizaron dianas hechas de elementos con números atómicos altos para maximizar la diferencia de tamaño entre los dos núcleos en una reacción. Si bien esto aumentó la posibilidad de fusión debido a la menor repulsión electrostática entre el objetivo y el proyectil, los núcleos compuestos formados a menudo se rompieron y no sobrevivieron para formar un nuevo elemento. Además, los procesos de fusión producen inevitablemente núcleos pobres en neutrones, ya que los elementos más pesados requieren más neutrones por protón para maximizar la estabilidad; por lo tanto, la expulsión necesaria de neutrones da como resultado productos finales que normalmente tienen una vida útil más corta . Como tal, los haces de luz (de seis a diez protones) permitieron la síntesis de elementos solo hasta 106 .
Para avanzar a elementos más pesados, el físico soviético Yuri Oganessian del Instituto Conjunto de Investigación Nuclear (JINR) en Dubna , Óblast de Moscú , RSFS de Rusia , Unión Soviética , propuso un mecanismo diferente, en el que el núcleo bombardeado sería plomo-208, que ha números mágicos de protones y neutrones, u otro núcleo cercano a él. Cada protón y neutrón tiene un valor fijo de energía en reposo ; los de todos los protones son iguales y también los de todos los neutrones. En un núcleo, parte de esta energía se desvía para unir protones y neutrones; si un núcleo tiene un número mágico de protones y / o neutrones, entonces se desvía aún más de su energía en reposo, lo que le da al nucleido estabilidad adicional. Esta estabilidad adicional requiere más energía para que un núcleo externo rompa el existente y lo penetre. Más energía desviada a los nucleones de unión significa menos energía en reposo, lo que a su vez significa menos masa (la masa es proporcional a la energía en reposo). Los números atómicos más iguales de los núcleos que reaccionan dan como resultado una mayor repulsión electrostática entre ellos, pero el menor exceso de masa del núcleo objetivo lo equilibra. Esto deja menos energía de excitación para el núcleo compuesto recién creado, que necesita menos eyecciones de neutrones para alcanzar un estado estable. Debido a esta diferencia de energía, el primer mecanismo se conoció como "fusión en caliente" y el segundo como "fusión en frío".
La fusión fría fue declarada exitosa por primera vez en 1974 en JINR, cuando se probó la síntesis del elemento 106 aún no descubierto . Se proyectó que estos nuevos núcleos se descompondrían a través de la fisión espontánea. Los físicos del JINR concluyeron que el elemento 106 se produjo en el experimento porque ningún núcleo de fisión conocido en ese momento mostraba parámetros de fisión similares a los observados durante el experimento y porque el cambio de cualquiera de los dos núcleos en las reacciones anulaba los efectos observados. Los físicos del Laboratorio Lawrence Berkeley (LBL; originalmente Laboratorio de Radiación, RL, y más tarde Laboratorio Nacional Lawrence Berkeley , LBNL) de la Universidad de California en Berkeley , California , Estados Unidos, también expresaron gran interés en la nueva técnica. Cuando se le preguntó acerca de hasta dónde podría llegar este nuevo método y si los objetivos principales fueran un Klondike de física , Oganessian respondió: "Klondike puede ser una exageración [...] Pero pronto, intentaremos obtener los elementos 107 ... 108 en estos reacciones ".
Informes
La síntesis del elemento 108 se intentó por primera vez en 1978 por un equipo de investigación dirigido por Oganessian en el JINR. El equipo utilizó una reacción que generaría el elemento 108, específicamente, el isótopo 270108 , a partir de la fusión del radio (específicamente, el isótopo226
88Real academia de bellas artes
) y calcio (48
20California
) . Los investigadores no estaban seguros de interpretar sus datos, y su artículo no afirmaba sin ambigüedades haber descubierto el elemento. El mismo año, otro equipo de JINR investigó la posibilidad de síntesis del elemento 108 en reacciones entre plomo (208
82Pb
) y hierro (58
26Fe
) ; no estaban seguros de interpretar los datos, lo que sugiere la posibilidad de que el elemento 108 no se hubiera creado.

En 1983, se realizaron nuevos experimentos en JINR. Los experimentos probablemente dieron como resultado la síntesis del elemento 108; bismuto (209
83Bi
) fue bombardeado con manganeso (55
25Minnesota
) para obtener 263108 , plomo (207
82Pb
, 208
82Pb
) fue bombardeado con hierro (58
26Fe
) para obtener 264108 , y californio (249
98Cf
) fue bombardeado con neón (22
10Nordeste
) para obtener 270 108. Estos experimentos no se reclamaron como un descubrimiento y Oganessian los anunció en una conferencia en lugar de en un informe escrito.
En 1984, los investigadores del JINR en Dubna realizaron experimentos configurados de manera idéntica a los anteriores; bombardearon objetivos de bismuto y plomo con iones de elementos más ligeros manganeso y hierro, respectivamente. Se registraron veintiún eventos de fisión espontánea; los investigadores concluyeron que fueron causados por 264 108.
Más tarde, en 1984, un equipo de investigación dirigido por Peter Armbruster y Gottfried Münzenberg en Gesellschaft für Schwerionenforschung (GSI; Instituto de Investigación de Iones Pesados ) en Darmstadt , Hesse , Alemania Occidental , intentó crear el elemento 108. El equipo bombardeó una pista (208
82Pb
) objetivo con hierro acelerado (58
26Fe
) núcleos. El experimento de GSI para crear el elemento 108 se retrasó hasta después de la creación del elemento 109 en 1982, ya que los cálculos anteriores habían sugerido que incluso, incluso los isótopos del elemento 108 tendrían vidas medias de fisión espontánea de menos de un microsegundo , lo que los hacía difíciles de detectar y identificar. El experimento del elemento 108 finalmente prosiguió después de que se sintetizaron 266 109 y se descubrió que se desintegraban por emisión alfa, lo que sugiere que los isótopos del elemento 108 harían lo mismo, y esto fue corroborado por un experimento destinado a sintetizar isótopos del elemento 106. GSI informó síntesis de tres átomos de 265 108. Dos años más tarde, informaron de la síntesis de un átomo de los 264 108 pares .
Arbitraje
En 1985, la Unión Internacional de Química Pura y Aplicada (IUPAC) y la Unión Internacional de Física Pura y Aplicada (IUPAP) formaron el Grupo de Trabajo de Transfermium (TWG) para evaluar los descubrimientos y establecer los nombres finales de los elementos con números atómicos superiores a 100. El partido mantuvo reuniones con delegados de los tres institutos competidores; en 1990, establecieron criterios para el reconocimiento de un elemento y en 1991, terminaron el trabajo de evaluación de descubrimientos y se disolvieron. Estos resultados se publicaron en 1993.
Según el informe, las obras de 1984 de JINR y GSI establecieron de forma simultánea e independiente la síntesis del elemento 108. De las dos obras de 1984, se dijo que la de GSI era suficiente como descubrimiento por sí sola. El trabajo de JINR, que precedió al de GSI, "muy probablemente" mostró la síntesis del elemento 108. Sin embargo, eso se determinó en retrospectiva dado el trabajo de Darmstadt; el trabajo de JINR se centró en identificar químicamente a las nietas remotas de los isótopos del elemento 108 (lo que no podía excluir la posibilidad de que estos isótopos hijos tuvieran otros progenitores), mientras que el trabajo de GSI identificó claramente la ruta de desintegración de esos isótopos del elemento 108. El informe concluyó que el mayor crédito debería otorgarse a GSI. En respuestas escritas a esta decisión, tanto JINR como GSI estuvieron de acuerdo con sus conclusiones. En la misma respuesta, GSI confirmó que ellos y JINR pudieron resolver todos los conflictos entre ellos.
Nombrar
Históricamente, un elemento recién descubierto fue nombrado por su descubridor. La primera regulación se produjo en 1947, cuando la IUPAC decidió que la denominación requería una regulación en caso de que hubiera nombres en conflicto. Estos asuntos serían resueltos por la Comisión de Nomenclatura Inorgánica y la Comisión de Pesos Atómicos . Revisarían los nombres en caso de conflicto y seleccionarían uno; la decisión se basaría en una serie de factores, como el uso, y no sería un indicador de la prioridad de una reclamación. Las dos comisiones recomendarían un nombre al Consejo de la IUPAC, que sería la autoridad final. Los descubridores tenían derecho a nombrar un elemento, pero su nombre estaría sujeto a la aprobación de la IUPAC. La Comisión de Pesos Atómicos se distanció de la denominación de elementos en la mayoría de los casos.
Bajo la nomenclatura de Mendeleev para elementos no nombrados y no descubiertos , hassium se conocería como "eka- osmium ", como en "el primer elemento debajo del osmium en la tabla periódica" (del sánscrito eka que significa "uno"). En 1979, la IUPAC publicó recomendaciones según las cuales el elemento debía llamarse "unniloctium" y le asignaba el símbolo correspondiente de "Uno", un nombre de elemento sistemático como marcador de posición hasta que se descubría el elemento y luego se confirmaba el descubrimiento, y un nombre permanente. fue decidido. Aunque estas recomendaciones se siguieron ampliamente en la comunidad química, los físicos competidores en el campo las ignoraron. Lo llamaron "elemento 108", con los símbolos E108 , (108) o 108 , o utilizaron el nombre propuesto "hassium".
En 1990, en un intento de romper un punto muerto al establecer la prioridad del descubrimiento y la denominación de varios elementos, la IUPAC reafirmó en su nomenclatura de química inorgánica que después de que se estableciera la existencia de un elemento, los descubridores podrían proponer un nombre. (Además, la Comisión de Pesos Atómicos fue excluida del proceso de denominación). La primera publicación sobre criterios para el descubrimiento de un elemento, publicada en 1991, especificó la necesidad de reconocimiento por parte de TWG.
Armbruster y sus colegas, los descubridores alemanes oficialmente reconocidos, celebraron una ceremonia de nombramiento de los elementos 107 a 109, que habían sido reconocidos como descubiertos por GSI, el 7 de septiembre de 1992. Para el elemento 108, los científicos propusieron el nombre "hassium". Se deriva del nombre latino Hassia para el estado alemán de Hesse donde se encuentra el instituto. Este nombre fue propuesto a la IUPAC en una respuesta por escrito a su decisión sobre la prioridad de los reclamos de descubrimiento de elementos, firmada el 29 de septiembre de 1992.
El proceso de nombrar el elemento 108 fue parte de un proceso más amplio de nombrar varios elementos comenzando con el elemento 101 ; tres equipos, JINR, GSI y LBL, afirmaron haber descubierto varios elementos y el derecho a nombrar esos elementos. A veces, estas afirmaciones chocaban; Dado que se consideraba que un descubridor tenía derecho a nombrar un elemento, los conflictos sobre la prioridad del descubrimiento a menudo resultaban en conflictos sobre los nombres de estos nuevos elementos. Estos conflictos se conocieron como las Guerras Transfermium . Diferentes sugerencias para nombrar todo el conjunto de elementos a partir de 101 en adelante y ocasionalmente asignaban nombres sugeridos por un equipo para ser utilizados para elementos descubiertos por otro. Sin embargo, no todas las sugerencias fueron recibidas con la misma aprobación; los equipos protestaron abiertamente por las propuestas de nombres en varias ocasiones.
En 1994, la Comisión de Nomenclatura de Química Inorgánica de la IUPAC recomendó que el elemento 108 se llamara "hahnio" (Hn) en honor al físico alemán Otto Hahn, por lo que los elementos que llevan el nombre de Hahn y Lise Meitner (se recomendó que el elemento 109 se llamara meitnerio, siguiendo la sugerencia de GSI ) estarían uno al lado del otro, en honor a su descubrimiento conjunto de la fisión nuclear; La IUPAC comentó que sentían que la sugerencia alemana era oscura. GSI protestó, diciendo que esta propuesta contradecía la convención de larga data de darle al descubridor el derecho a sugerir un nombre; la American Chemical Society apoyó a GSI. El nombre "hahnium", aunque con el símbolo diferente Ha, ya había sido propuesto y utilizado por los científicos estadounidenses para el elemento 105 , por el cual tenían una disputa de descubrimiento con JINR; así protestaron por la confusa mezcla de nombres. Tras el alboroto, la IUPAC formó un comité ad hoc de representantes de las organizaciones nacionales adheridas de los tres países que albergan a las instituciones competidoras; produjeron un nuevo conjunto de nombres en 1995. El elemento 108 se llamó nuevamente hahnio ; esta propuesta también fue retractada. El compromiso final se alcanzó en 1996 y se publicó en 1997; el elemento 108 se llamó hassium (Hs). Al mismo tiempo, el nombre dubnium (Db; de Dubna, la ubicación JINR) fue asignado al elemento 105, y el nombre hahnio no se utilizó para cualquier elemento.
La justificación oficial para este nombre, junto con el de darmstadtium para el elemento 110, fue que completó un conjunto de nombres geográficos para la ubicación del GSI; este conjunto había sido iniciado por los nombres europio y germanio del siglo XIX . Este conjunto serviría como respuesta a la denominación anterior de americio , californio y berkelio para elementos descubiertos en Berkeley. Armbruster comentó sobre esto, "esta mala tradición fue establecida por Berkeley. Queríamos hacerlo para Europa". Más tarde, al comentar sobre la denominación del elemento 112 , Armbruster dijo: "Hice todo lo posible para asegurarme de que no continuamos con científicos alemanes y ciudades alemanas".
Isótopos
| Isótopo | Media vida | Modo de decaimiento |
Año de descubrimiento |
Reacción de descubrimiento |
|
|---|---|---|---|---|---|
| Valor | Árbitro | ||||
| 263 Hs | 760 μs | α, SF | 2009 | 208 Pb ( 56 Fe, n) | |
| 264 Hs | 540 μs | α, SF | 1986 | 207 Pb ( 58 Fe, n) | |
| 265 Hs | 1,96 ms | α, SF | 1984 | 208 Pb ( 58 Fe, n) | |
| 265 millones de Hs | 360 μs | α | 1995 | 208 Pb ( 56 Fe, n) | |
| 266 Hs | 3,02 ms | α, SF | 2001 | 270 Ds (-, α) | |
| 266 millones de Hs | 280 ms | α | 2011 | 270 m Ds (-, α) | |
| 267 Hs | 55 ms | α | 1995 | 238 U ( 34 S, 5n) | |
| 267 millones de Hs | 990 μs | α | 2004 | 238 U ( 34 S, 5n) | |
| 268 Hs | 1,42 s | α | 2010 | 238 U ( 34 S, 4n) | |
| 269 Hs | 16 s | α | 1996 | 277 Cn (-, 2α) | |
| 270 Hs | 9 s | α | 2003 | 248 cm ( 26 mg, 4 n) | |
| 271 Hs | 10 s | α | 2008 | 248 cm ( 26 mg, 3 n) | |
| 273 Hs | 510 ms | α | 2010 | 285 Fl (-, 3α) | |
| 275 Hs | 200 ms | α | 2004 | 287 Fl (-, 3α) | |
| 277 Hs | 12 ms | α | 2010 | 289 Fl (-, 3α) | |
| 277m Hs | 130 s | SF | 2012 | 293m Lv (-, 4α) | |
El hasio no tiene isótopos estables o de origen natural. Se han sintetizado varios isótopos radiactivos en el laboratorio, ya sea fusionando dos átomos o observando la desintegración de elementos más pesados. A partir de 2019, la cantidad de todo el hasio jamás producido fue del orden de cientos de átomos. Se han informado doce isótopos con números de masa que van desde 263 a 277 (con las excepciones de 272, 274 y 276), cuatro de los cuales, hassio-265, -266, -267 y -277, tienen estados metaestables conocidos , aunque el de hassium-277 no está confirmado. La mayoría de estos isótopos se desintegran predominantemente a través de la desintegración alfa; este es el más común para todos los isótopos para los que se dispone de características completas de desintegración, siendo la única excepción el hassio-277, que sufre una fisión espontánea. Los isótopos más ligeros se sintetizaron generalmente por fusión directa entre dos núcleos más ligeros, mientras que los isótopos más pesados se observaron típicamente como productos de desintegración de núcleos con números atómicos más grandes.
Los núcleos atómicos tienen capas nucleares bien establecidas, y la existencia de estas capas proporciona a los núcleos estabilidad adicional. Si un núcleo tiene cierta cantidad de protones o neutrones, llamados números mágicos, que completan ciertas capas nucleares, entonces el núcleo es aún más estable contra la desintegración. Los números mágicos más altos conocidos son 82 para protones y 126 para neutrones. Esta noción a veces se amplía para incluir números adicionales entre esos números mágicos, que también proporcionan cierta estabilidad adicional e indican el cierre de "subconchas". A diferencia de los núcleos más ligeros más conocidos, los núcleos superpesados están deformados. Hasta la década de 1960, el modelo de gota de líquido fue la explicación dominante de la estructura nuclear. Sugirió que la barrera de fisión desaparecería para núcleos con aproximadamente 280 nucleones. Por tanto, se pensó que la fisión espontánea ocurriría casi instantáneamente antes de que los núcleos pudieran formar una estructura que pudiera estabilizarlos; parecía que los núcleos con Z ≈ 103 eran demasiado pesados para existir durante un período de tiempo considerable.
El último modelo de capa nuclear sugirió que los núcleos con alrededor de trescientos nucleones formarían una isla de estabilidad en la que los núcleos serán más resistentes a la fisión espontánea y principalmente sufrirán desintegración alfa con vidas medias más largas, y el siguiente núcleo doblemente mágico (que tiene magia número de protones y neutrones) se encuentra en el centro de la isla de estabilidad en la vecindad de Z = 110-114 y el número de neutrones mágicos predicho N = 184. Descubrimientos posteriores sugirieron que la isla predicha podría estar más lejos de lo que originalmente anticipado También demostraron que los núcleos intermedios entre los actínidos de vida larga y la isla predicha se deforman y obtienen estabilidad adicional a partir de los efectos de la capa. La adición a la estabilidad contra la fisión espontánea debería ser particularmente grande contra la fisión espontánea, aunque el aumento de la estabilidad contra la desintegración alfa también sería pronunciado. El centro de la región en un gráfico de nucleidos que correspondería a esta estabilidad para núcleos deformados se determinó como 270 Hs, y se esperaba que 108 fuera un número mágico para protones para núcleos deformados (núcleos que están lejos de ser esféricos) y 162 un número mágico. número de neutrones para tales núcleos. Los experimentos en núcleos superpesados más ligeros, así como en aquellos más cercanos a la isla esperada, han demostrado una estabilidad mayor de la anticipada contra la fisión espontánea, lo que demuestra la importancia de los efectos de la capa sobre los núcleos.
Los modelos teóricos predicen que una región de inestabilidad para algunos isótopos de hassio se encuentra alrededor de A = 275 y N = 168-170, que se encuentra entre los cierres de capa de neutrones predichos en N = 162 para núcleos deformados y N = 184 para núcleos esféricos. Se predice que los nucleidos dentro de esta región tienen bajas alturas de barrera de fisión, lo que resulta en vidas medias parciales cortas hacia la fisión espontánea. Esta predicción está respaldada por la vida media de once milisegundos observada de 277 Hs y la de la isobara vecina 277 Mt porque se demostró que los factores de impedimento del nucleón impar eran mucho más bajos de lo esperado. Las vidas medias medidas son incluso más bajas que las predichas para los pares pares 276 Hs y 278 Ds, lo que sugiere una brecha en la estabilidad lejos de los cierres de caparazón y quizás un debilitamiento de los cierres de caparazón en esta región.
En 1991, los físicos polacos Zygmunt Patyk y Adam Sobiczewski predijeron que 108 es un número mágico de protones para núcleos deformados y 162 es un número mágico de neutrones para tales núcleos. Esto significa que dichos núcleos se deforman permanentemente en su estado fundamental, pero tienen barreras de fisión altas y estrechas para una mayor deformación y, por lo tanto, una vida útil relativamente larga hacia la fisión espontánea. Las perspectivas computacionales para la estabilización de la capa para 270 Hs lo convirtieron en un candidato prometedor para un núcleo doblemente mágico deformado. Los datos experimentales son escasos, pero los investigadores interpretan los datos existentes para respaldar la asignación de N = 162 como un número mágico. En particular, esta conclusión se extrajo de los datos de desintegración de 269 Hs, 270 Hs y 271 Hs. En 1997, el físico polaco Robert Smolańczuk calculó que el isótopo 292 Hs puede ser el núcleo superpesado más estable contra la desintegración alfa y la fisión espontánea como consecuencia del cierre de capa N = 184 previsto .
Ocurrencia natural
No se sabe que el hasio se encuentre de forma natural en la Tierra; las vidas medias de todos sus isótopos conocidos son lo suficientemente cortas como para que ningún hasio primordial hubiera sobrevivido hasta el día de hoy. Esto no descarta la posibilidad de la existencia de isótopos desconocidos, de vida más larga o isómeros nucleares , algunos de los cuales aún podrían existir en cantidades traza si tienen una vida suficiente. Ya en 1914, el físico alemán Richard Swinne propuso el elemento 108 como fuente de rayos X en la capa de hielo de Groenlandia . Aunque Swinne no pudo verificar esta observación y, por lo tanto, no reclamó el descubrimiento, propuso en 1931 la existencia de "regiones" de elementos transuránicos de larga vida, incluida una alrededor de Z = 108.
En 1963, el geólogo soviético y físico Viktor Cherdyntsev, que había solicitado previamente la existencia de primordial curio -247, afirmó haber descubierto el elemento 108 de forma específica al 267 108 isótopos, que supuestamente tenía una vida media de entre 400 y 500 millones de años, en molibdenita natural y sugirió el nombre provisional sergenium (símbolo Sg); este nombre toma su origen del nombre de la Ruta de la Seda y se explicó como "procedente de Kazajstán ". Su razón para afirmar que el sergenio era el homólogo más pesado del osmio era que los minerales que supuestamente contenían sergenio formaban óxidos volátiles cuando se hervían en ácido nítrico , de manera similar al osmio.
Los hallazgos de Cherdyntsev fueron criticados por el físico soviético Vladimir Kulakov con el argumento de que algunas de las propiedades que Cherdyntsev afirmaba que tenía el sergenio eran incompatibles con la física nuclear vigente en ese momento. Las preguntas principales planteadas por Kulakov fueron que la energía de desintegración alfa alegada del sergenio era muchos órdenes de magnitud más baja de lo esperado y la vida media dada fue ocho órdenes de magnitud más corta de lo que se predeciría para un núclido alfa en desintegración con la desintegración declarada. energía. Al mismo tiempo, una vida media corregida en la región de 10 16 años sería imposible porque implicaría que las muestras contienen alrededor de cien miligramos de sergenio. En 2003, se sugirió que la desintegración alfa observada con energía de 4.5 MeV podría deberse a una transición de baja energía y fuertemente mejorada entre diferentes estados hiperdeformados de un isótopo de hassio alrededor de 271 Hs, sugiriendo así que la existencia de elementos superpesados en la naturaleza era al menos posible, aunque poco probable.
En 2006, el geólogo ruso Alexei Ivanov planteó la hipótesis de que un isómero de 271 Hs podría tener una vida media de alrededor de(2,5 ± 0,5) × 10 8 años, lo que explicaría la observación de partículas alfa con energías del orden de 4,4 MeV en algunas muestras de molibdenita y osmiridio . Este isómero de 271 Hs podría producirse a partir de la desintegración beta de 271 Bh y 271 Sg, que, siendo homólogos al renio y al molibdeno respectivamente, deberían ocurrir en la molibdenita junto con el renio y el molibdeno si ocurrieran en la naturaleza. Debido a que el hassium es homólogo al osmio, debería ocurrir junto con el osmio en el osmiridium si ocurre en la naturaleza. Las cadenas de desintegración de 271 Bh y 271 Sg son hipotéticas y la vida media predicha de este hipotético isómero de hassio no es lo suficientemente larga para que quede una cantidad suficiente en la Tierra. Es posible que se depositen más 271 Hs en la Tierra a medida que el Sistema Solar viaja a través de los brazos espirales de la Vía Láctea ; esto explicaría los excesos de plutonio-239 que se encuentran en los fondos oceánicos del Océano Pacífico y el Golfo de Finlandia . Sin embargo, se prevé que los minerales enriquecidos con 271 Hs tengan excesos de sus derivados uranio-235 y plomo-207; también tendrían diferentes proporciones de elementos que se forman durante la fisión espontánea, como el criptón , el circonio y el xenón . La presencia natural de hasio en minerales como la molibdenita y la osmirida es teóricamente posible, pero muy poco probable.
En 2004, JINR inició una búsqueda de hassium natural en el Laboratorio Subterráneo Modane en Modane , Auvergne-Rhône-Alpes , Francia; esto se hizo bajo tierra para evitar interferencias y falsos positivos de los rayos cósmicos . En 2008-09, un experimento realizado en el laboratorio dio como resultado la detección de varios eventos registrados de multiplicidad de neutrones (número de neutrones libres emitidos después de que un neutrón golpeó un núcleo y se fisionó) por encima de tres en el osmio natural, y en 2012– 13, estos hallazgos se reafirmaron en otro experimento realizado en el laboratorio. Estos resultados insinuaron que el hasio natural podría existir en la naturaleza en cantidades que permitan su detección por medio de la química analítica, pero esta conclusión se basa en una suposición explícita de que existe un isótopo de hasio de larga duración al que se podrían atribuir los eventos registrados.
Dado que 292 Hs puede ser particularmente estable contra la desintegración alfa y la fisión espontánea, se consideró como un candidato para existir en la naturaleza. Sin embargo, se predice que este nucleido será muy inestable hacia la desintegración beta y cualquier isótopo beta estable de hasio, como 286 Hs, sería demasiado inestable en los otros canales de desintegración para ser observado en la naturaleza. Una búsqueda en 2012 de 292 Hs en la naturaleza junto con su osmio homólogo en el Laboratorio Maier-Leibnitz en Garching , Baviera , Alemania, no tuvo éxito, estableciendo un límite superior para su abundancia en3 × 10 -15 gramos de hassium por gramo de osmio.
Propiedades previstas
Varios cálculos sugieren que el hassium debería ser el elemento del grupo 8 más pesado hasta ahora, de acuerdo con la ley periódica . Por lo general, sus propiedades deberían coincidir con las esperadas para un homólogo más pesado de osmio; como es el caso de todos los transactínidos , se espera que surjan algunas desviaciones de los efectos relativistas .
Se han medido muy pocas propiedades del hasio o sus compuestos; esto se debe a su producción extremadamente limitada y costosa y al hecho de que el hasio (y sus padres) se descompone muy rápidamente. Se han medido algunas propiedades singulares relacionadas con la química, como la entalpía de adsorción del tetróxido de hasio, pero las propiedades del metal de hasio siguen siendo desconocidas y solo se dispone de predicciones.
Efectos relativistas
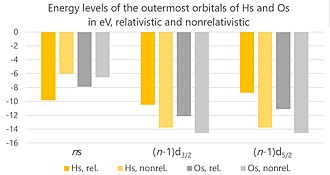
Los efectos relativistas sobre el hasio deberían surgir debido a la alta carga de sus núcleos, lo que hace que los electrones alrededor del núcleo se muevan más rápido, tan rápido que su velocidad se vuelve comparable a la velocidad de la luz. Hay tres efectos principales: el efecto relativista directo, el efecto relativista indirecto y la división espín-órbita . (Los cálculos existentes no tienen en cuenta las interacciones Breit , pero son insignificantes y su omisión solo puede dar como resultado una incertidumbre de los cálculos actuales de no más del 2%).
A medida que aumenta el número atómico, también lo hace la atracción electrostática entre un electrón y el núcleo. Esto hace que la velocidad del electrón aumente, lo que conduce a un aumento de su masa . Esto a su vez conduce a la contracción de los orbitales atómicos , más específicamente los orbitales sy p 1/2 . Sus electrones se unen más estrechamente al átomo y son más difíciles de extraer del núcleo. Este es el efecto relativista directo. Originalmente se pensó que era fuerte solo para los electrones más internos, pero más tarde se estableció que también influía significativamente en los electrones de valencia.
Dado que los orbitales syp 1/2 están más cerca del núcleo, toman una porción mayor de la carga eléctrica del núcleo sobre sí mismos (lo "protegen"). Esto deja menos carga para la atracción de los electrones restantes, cuyos orbitales, por lo tanto, se expanden, lo que facilita su extracción del núcleo. Este es el efecto relativista indirecto. Como resultado de la combinación de los efectos relativistas directos e indirectos, el ion Hs + , en comparación con el átomo neutro, carece de un electrón de 6d, en lugar de un electrón de 7s. En comparación, Os + carece de un electrón 6s en comparación con el átomo neutro. El radio iónico (en estado de oxidación +8) del hassio es mayor que el del osmio debido a la expansión relativista de los orbitales 6p 3/2 , que son los orbitales más externos de un ion Hs 8+ (aunque en la práctica iones tan cargados estaría demasiado polarizado en entornos químicos para tener mucha realidad).
Hay varios tipos de orbitales electrónicos, indicados por las letras s, p, d y f (se espera que los orbitales g comiencen a ser químicamente activos entre los elementos posteriores al elemento 120 ). Cada uno de estos corresponde a un número cuántico azimutal l : sa 0, p a 1, d a 2 y f a 3. Cada electrón también corresponde a un número cuántico de espín s , que puede ser igual a +1/2 o −1 / 2. Por lo tanto, el número cuántico de momento angular total j = l + s es igual a j = l ± 1/2 (excepto para l = 0, para el cual para ambos electrones en cada orbital j = 0 + 1/2 = 1/2) . El espín de un electrón interactúa relativistamente con su órbita, y esta interacción conduce a la división de una subcapa en dos con diferentes energías (la que tiene j = l - 1/2 es de menor energía y, por lo tanto, estos electrones son más difíciles de extraer): por ejemplo, de los seis electrones 6p, dos se convierten en 6p 1/2 y cuatro en 6p 3/2 . Esta es la división espín-órbita (a veces también conocida como división de subcapa o acoplamiento jj ). Es más visible con los electrones p, que no juegan un papel importante en la química del hasio, pero los de los electrones dyf están dentro del mismo orden de magnitud (cuantitativamente, la división espín-órbita expresada en unidades de energía, como electronvoltios ).
Estos efectos relativistas son responsables del aumento esperado de la energía de ionización , disminución de la afinidad electrónica y aumento de la estabilidad del estado de oxidación +8 en comparación con el osmio; sin ellos, las tendencias se revertirían. Los efectos relativistas disminuyen las energías de atomización de los compuestos de hasio porque la división espín-órbita del orbital d reduce la energía de enlace entre los electrones y el núcleo y porque los efectos relativistas reducen el carácter iónico en el enlace.
Físico y atómico
Los miembros anteriores del grupo 8 tienen puntos de fusión relativamente altos: Fe, 1538 ° C; Ru , 2334 ° C; Os, 3033ºC . Al igual que ellos, se predice que el hassio será un sólido a temperatura ambiente, aunque su punto de fusión no se ha calculado con precisión. El hasio debería cristalizar en la estructura hexagonal compacta ( c / a = 1,59), de forma similar a su congénere osmio más ligero . Se calcula que el hassio metálico puro tiene un módulo de volumen (resistencia a la compresión uniforme) de 450 GPa , comparable con el del diamante , 442 GPa. Se espera que el hasio sea uno de los más densos de los 118 elementos conocidos, con una densidad prevista de 27 a 29 g / cm 3 frente a los 22,59 g / cm 3 medidos para el osmio.
Se espera que el radio atómico del hasio sea de alrededor de 126 pm. Debido a la estabilización relativista del orbital 7s y la desestabilización del orbital 6d, se predice que el ion Hs + tendrá una configuración electrónica de [ Rn ] 5f 14 6d 5 7s 2 , dando un electrón 6d en lugar de un electrón 7s, que es lo opuesto al comportamiento de sus homólogos más ligeros. Se espera que el ion Hs 2+ tenga una configuración electrónica de [Rn] 5f 14 6d 5 7s 1 , análoga a la calculada para el ion Os 2+ . En los compuestos químicos , el hassio se calcula para mostrar la característica de unión de un elemento de bloque d , cuya unión será ejecutada principalmente por orbitales 6d 3/2 y 6d 5/2 ; en comparación con los elementos de los períodos anteriores, los orbitales 7s, 6p 1/2 , 6p 3/2 y 7p 1/2 deberían ser más importantes.
Químico
| Elemento | Estados de oxidación estables | |||||||
|---|---|---|---|---|---|---|---|---|
| planchar | +6 | +3 | +2 | |||||
| rutenio | +8 | +6 | +5 | +4 | +3 | +2 | ||
| osmio | +8 | +6 | +5 | +4 | +3 | +2 | ||
Hassium es el sexto miembro de la serie 6d de metales de transición y se espera que sea muy parecido a los metales del grupo del platino . Algunas de estas propiedades fueron confirmadas por experimentos de química en fase gaseosa. Los elementos del grupo 8 representan una amplia variedad de estados de oxidación, pero el rutenio y el osmio representan fácilmente su estado de oxidación de grupo de +8; este estado se vuelve más estable en el grupo. Este estado de oxidación es extremadamente raro: entre los elementos estables, solo el rutenio, el osmio y el xenón pueden alcanzarlo en compuestos razonablemente estables. Se espera que el hasio siga a sus congéneres y tenga un estado estable +8, pero al igual que ellos, debería mostrar estados de oxidación estable más bajos como +6, +4, +3 y +2. Se espera que el hasio (IV) sea más estable que el hasio (VIII) en solución acuosa. El hasium debería ser un metal bastante noble . Se espera que el potencial de reducción estándar para la pareja Hs 4+ / Hs sea de 0,4 V.
Los elementos del grupo 8 muestran una química de óxido distintiva . Todos los miembros más ligeros tienen tetróxidos conocidos o hipotéticos, MO 4 . Su poder oxidante disminuye a medida que se desciende del grupo. El FeO 4 no se conoce debido a su extraordinariamente grande afinidad electrónica, la cantidad de energía liberada cuando se agrega un electrón a un átomo o molécula neutral para formar un ión negativo, lo que da como resultado la formación del conocido ferrato de oxianión (VI). , FeO2−
4. El tetróxido de rutenio , RuO 4 , que se forma por oxidación de rutenio (VI) en ácido, se reduce fácilmente a rutenato (VI), RuO2−
4. La oxidación del rutenio metálico en el aire forma el dióxido, RuO 2 . En contraste, las quemaduras de osmio para formar el estable tetróxido , OSO 4 , que complejos con el ión hidróxido para formar una de osmio (VIII) - comieron complejo, [OsO _ 4 (OH) 2 ] 2- . Por lo tanto, el hassio debería comportarse como un homólogo más pesado del osmio al formar un tetróxido HsO 4 estable y muy volátil , que sufre una complejación con hidróxido para formar un hasato (VIII), [HsO 4 (OH) 2 ] 2− . El tetróxido de rutenio y el tetróxido de osmio son volátiles debido a su geometría molecular tetraédrica simétrica y porque tienen carga neutra; De manera similar, el tetróxido de hasio debería ser un sólido muy volátil. Se sabe experimentalmente que la tendencia de las volatilidades de los tetróxidos del grupo 8 es RuO 4 < OsO 4 > HsO 4 , lo que confirma los resultados calculados. En particular, las entalpías de adsorción calculadas ( la energía requerida para la adhesión de átomos, moléculas o iones de un gas, líquido o sólido disuelto a una superficie) de HsO 4 , - (45,4 ± 1) kJ / mol en cuarzo , concuerda muy bien con el valor experimental de - (46 ± 2) kJ / mol.
Química experimental
El primer objetivo de la investigación química fue la formación del tetróxido; se eligió porque el rutenio y el osmio forman tetróxidos volátiles, siendo los únicos metales de transición que presentan un compuesto estable en el estado de oxidación +8. A pesar de que esta selección para los estudios químicos en fase gaseosa fue clara desde el principio, la caracterización química del hasio se consideró una tarea difícil durante mucho tiempo. Aunque los isótopos de hassio se sintetizaron por primera vez en 1984, no fue hasta 1996 que se sintetizó un isótopo de hassio lo suficientemente longevo como para permitir estudios químicos. Desafortunadamente, este isótopo de hassio, 269 Hs, se sintetizó indirectamente a partir de la desintegración de 277 Cn; Los métodos de síntesis indirecta no solo no son favorables para los estudios químicos, sino que la reacción que produjo el isótopo 277 Cn tuvo un bajo rendimiento (su sección transversal fue de solo 1 pb) y, por lo tanto, no proporcionó suficientes átomos de hasio para una investigación química. La síntesis directa de 269 Hs y 270 Hs en la reacción 248 Cm ( 26 Mg, x n) 274− x Hs ( x = 4 o 5) parecía más prometedora porque la sección transversal de esta reacción era algo mayor a 7 pb. Este rendimiento fue todavía unas diez veces menor que el de la reacción utilizada para la caracterización química del bohrium . Se tuvieron que introducir nuevas técnicas de irradiación, separación y detección antes de que el hasio pudiera caracterizarse químicamente con éxito.
El rutenio y el osmio tienen una química muy similar debido a la contracción del lantánido, pero el hierro muestra algunas diferencias con respecto a ellos; por ejemplo, aunque el rutenio y el osmio forman tetróxidos estables en los que el metal se encuentra en el estado de oxidación +8, el hierro no lo hace. En preparación para la caracterización química del hasio, la investigación se centró en el rutenio y el osmio en lugar del hierro porque se esperaba que el hasio fuera similar al rutenio y al osmio, ya que los datos previstos sobre el hasio coincidían estrechamente con los de esos dos.
Los primeros experimentos de química se realizaron mediante termocromatografía de gases en 2001, utilizando como referencia los radioisótopos de osmio sintético 172 Os y 173 Os. Durante el experimento, se sintetizaron siete átomos de hasio usando las reacciones 248 Cm ( 26 Mg, 5n) 269 Hs y 248 Cm ( 26 Mg, 4n) 270 Hs. Luego se termalizaron y oxidaron en una mezcla de gases de helio y oxígeno para formar moléculas de tetróxido de hasio.
- Hs + 2 O 2 → HsO 4
La temperatura de deposición medida del tetróxido de hassio fue más alta que la del tetróxido de osmio, lo que indicó que el primero era el menos volátil, y esto colocó al hassio firmemente en el grupo 8. La entalpía de adsorción para HsO 4 medida,−46 ± 2 kJ / mol , fue significativamente menor que el valor predicho,−36,7 ± 1,5 kJ / mol , lo que indica que el OsO 4 es más volátil que el HsO 4 , lo que contradice cálculos anteriores que implicaban que deberían tener volatilidades muy similares. A modo de comparación, el valor de OsO 4 es−39 ± 1 kJ / mol . (Los cálculos que arrojaron una coincidencia más cercana con los datos experimentales se produjeron después del experimento, en 2008). Es posible que el tetróxido de hasio interactúe de manera diferente con el nitruro de silicio que con el dióxido de silicio , los productos químicos utilizados para el detector; Se requiere más investigación para establecer si existe una diferencia entre tales interacciones y si ha influido en las mediciones. Dicha investigación incluiría mediciones más precisas de las propiedades nucleares de 269 Hs y comparaciones con RuO 4 además de OsO 4 .
En 2004, los científicos hicieron reaccionar tetróxido de hassio e hidróxido de sodio para formar hassato de sodio (VIII), una reacción que es bien conocida con el osmio. Esta fue la primera reacción ácido-base con un compuesto de hassio, formando hassato de sodio (VIII):
-
HsO
4+ 2 NaOH → Na
2[HsO
4(OH)
2]
El equipo de la Universidad de Mainz planeó en 2008 estudiar la electrodeposición de átomos de hasio utilizando la nueva instalación TASCA en GSI. Su objetivo era utilizar la reacción 226 Ra ( 48 Ca, 4n) 270 Hs. Los científicos de GSI esperaban utilizar TASCA para estudiar la síntesis y las propiedades del compuesto de hassio (II) hassoceno, Hs ( C 5 H 5 ) 2 , utilizando la reacción 226 Ra ( 48 Ca, x n). Este compuesto es análogo a los compuestos más ligeros ferroceno , rutenoceno y osmoceno , y se espera que tenga los dos anillos de ciclopentadienilo en una conformación eclipsada como el rutenoceno y el osmoceno y no en una conformación escalonada como el ferroceno. Se eligió el hassoceno, que se espera que sea un compuesto estable y altamente volátil, porque tiene hasio en el estado de oxidación formal bajo de + 2, aunque la unión entre el metal y los anillos es principalmente covalente en los metalocenos, en lugar de la alta + 8 estado que se había investigado previamente, y se esperaba que los efectos relativistas fueran más fuertes en el estado de oxidación inferior. La estructura altamente simétrica del hassoceno y su bajo número de átomos facilitan los cálculos relativistas. A partir de 2021, no hay informes experimentales de hassoceno.
Notas
Referencias
Bibliografía
- Audi, G .; Kondev, FG; Wang, M .; et al. (2017). "La evaluación NUBASE2016 de las propiedades nucleares" (PDF) . Física C china . 41 (3): 030001. Código bibliográfico : 2017ChPhC..41c0001A . doi : 10.1088 / 1674-1137 / 41/3/030001 . S2CID 126750783 . Archivado desde el original (PDF) el 1 de agosto de 2020.
- Barber, RC; Greenwood, NN ; Hrynkiewicz, AZ; et al. (1993). "Descubrimiento de los elementos Transfermium" (PDF) . Química pura y aplicada . 65 (8): 1757–1814. doi : 10.1351 / pac199365081757 . S2CID 195819585 . Archivado (PDF) desde el original el 20 de septiembre de 2016 . Consultado el 7 de septiembre de 2016 .
- Beiser, A. (2003). Conceptos de física moderna (6ª ed.). McGraw-Hill. ISBN 978-0-07-244848-1. OCLC 48965418 .
- Greenwood, NN; Earnshaw, A. (1997). Química de los Elementos (2ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- Hoffman, DC ; Ghiorso, A .; Seaborg, GT (2000). La gente de Transuranium: la historia interna . World Scientific . ISBN 978-1-78-326244-1.
- Hoffman, DC; Lee, DM; Pershina, V. (2006). "Transactínidos y los elementos del futuro". En Morss, LR; Edelstein, NM; Fuger, J. (eds.). La química de los elementos actínidos y transactínidos (3ª ed.). Springer Science + Business Media . pp. 1652 -1752. ISBN 978-1-4020-3555-5.
- Kragh, H. (2018). De los elementos transuránicos a los superpesados: una historia de disputas y creación . Springer . ISBN 978-3-319-75813-8.
- Lide, DR (2004). Manual de química y física (84ª ed.). Prensa CRC. ISBN 978-0-8493-0566-5.
- Zagrebaev, V .; Karpov, A .; Greiner, W. (2013). "Futuro de la investigación de elementos superpesados: ¿Qué núcleos podrían sintetizarse en los próximos años?" . Journal of Physics: Serie de conferencias . 420 (1): 012001. arXiv : 1207.5700 . Código bibliográfico : 2013JPhCS.420a2001Z . doi : 10.1088 / 1742-6596 / 420/1/012001 . ISSN 1742-6588 . S2CID 55434734 .
enlaces externos
-
 Medios relacionados con Hassium en Wikimedia Commons
Medios relacionados con Hassium en Wikimedia Commons