Enolato - Enolate
Los enolatos son aniones orgánicos derivados de la desprotonación de compuestos carbonílicos. Rara vez aislados, se utilizan ampliamente como reactivos en la síntesis de compuestos orgánicos.
Vinculación y estructura
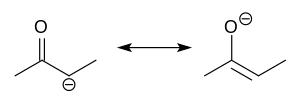
Los aniones enolato están relacionados electrónicamente con los aniones alilo. La carga aniónica se deslocaliza sobre el oxígeno y los dos sitios de carbono. Por tanto, tienen el carácter tanto de alcóxido como de carbanión .
Aunque a menudo se dibujan como sales simples, de hecho adoptan estructuras complicadas que a menudo presentan agregados.
Preparación
La desprotonación de cetonas, aldehídos y ésteres enolizables produce enolatos. Con bases fuertes, la desprotonación es cuantitativa. Normalmente, los enolatos se generan a partir del uso de diisopropilamida de litio (LDA).
A menudo, como en las condensaciones de Claisen convencionales , las reacciones de Mannich y las condensaciones aldólicas , los enolatos se generan en concentraciones bajas con bases alcóxido. En tales condiciones, existen en concentraciones bajas, pero aún sufren reacciones con electrófilos. Muchos factores afectan el comportamiento de los enolatos, especialmente el disolvente, los aditivos (por ejemplo, diaminas) y el contracatión (Li + frente a Na + , etc.). Para las cetonas asimétricas, existen métodos para controlar la regioquímica de la desprotonación.
La desprotonación de los ácidos de carbono puede proceder con un control de reacción cinético o termodinámico . Por ejemplo, en el caso de la fenilacetona , la desprotonación puede producir dos enolatos diferentes. Se ha demostrado que la LDA desprotona el grupo metilo, que es el curso cinético de la desprotonación. Para asegurar la producción del producto cinético, se utiliza un ligero exceso (1,1 equiv.) De diisopropilamida de litio y se añade la cetona a la base a -78 ° C. Debido a que la cetona se convierte rápida y cuantitativamente en el enolato y la base está presente en exceso en todo momento, la cetona no puede actuar como lanzadera de protones para catalizar la formación gradual del producto termodinámico. Una base más débil, como un alcóxido , que desprotona reversiblemente el sustrato, produce el enolato bencílico más estable termodinámicamente.
Los enolatos pueden quedar atrapados por acilación y sililación , que ocurren en el oxígeno. Los éteres de silil enol son reactivos comunes en la síntesis orgánica, como lo ilustra la reacción aldólica de Mukaiyama :
Reacciones
Como nucleófilos poderosos, los enolatos reaccionan fácilmente con una variedad de electrófilos. Los electrófilos habituales son haluros de alquilo, aldehídos y cetonas y aceptores de Michael . Estas reacciones generan nuevos enlaces CC y, a menudo, nuevos estereocentros. La estereoselectividad está influenciada por aditivos.
Aza enolates
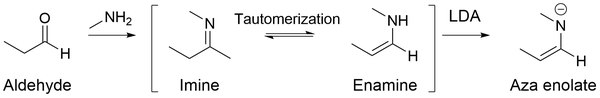
Los enolatos de aza (también conocidos como aniones imina, enamidas, bases de Schiff metaladas y metaloenaminas) son análogos de nitrógeno a los enolatos. Cuando las iminas se tratan con bases fuertes como LDA , se generan enolatos aza altamente nucleofílicos.
El principal beneficio de usar enolatos de aza es que no experimentan autocondensación (es decir, reacción aldólica para aldehídos ) en una solución básica o neutra, sino que favorecen la alquilación en el carbono alfa. Esto se debe principalmente a que las iminas contienen dobles enlaces carbono-nitrógeno a diferencia de los aldehídos, que contienen dobles enlaces oxígeno-carbono. Dado que el oxígeno es más electronegativo que el nitrógeno, extrae más densidad de electrones del carbono carbonilo, lo que induce una mayor carga parcialmente positiva en el carbono. Por lo tanto, con más carbono electrófilo, los aldehídos permiten una mejor adición nucleófila al carbono en el doble enlace carbono-oxígeno.
Por otro lado, la imina tiene menos nitrógeno electronegativo que induce una carga parcialmente positiva más débil en el carbono carbonilo. Como resultado, si bien las iminas aún pueden reaccionar con los organolitios, no reaccionan con otros nucleófilos (incluidos los enolatos de aza) para sufrir adiciones nucleófilas .
En cambio, los enolatos de aza reaccionan de manera similar a los enolatos, formando productos alquilados SN2 . A través de la conjugación de pares solitarios de nitrógeno, el carbono β se convierte en un sitio nucleofílico, lo que permite que los enolatos de aza experimenten reacciones de alquilación. Por lo tanto, los enolatos de aza pueden reaccionar con numerosos electrófilos como epóxidos y haluros de alquilo para formar un nuevo enlace carbono-carbono en el carbono β.
A continuación se muestran dos posibles mecanismos de reacción:
Dado que el epóxido es una molécula de anillo de tres miembros, tiene un alto grado de deformación del anillo . Aunque los carbonos en el sistema de anillos son tetraédricos , prefiriendo 109,5 grados entre cada átomo, el epóxido deforma los ángulos del anillo en 60 grados. Para contrarrestar este efecto, los enolatos aza nucleofílicos reaccionan fácilmente con epóxidos para reducir sus tensiones anulares.
Además de reaccionar con epóxidos, los enolatos de aza también pueden reaccionar con haluros de alquilo (o haluros de alilo como se muestra arriba) para formar un nuevo enlace sigma carbono-carbono . Esta reacción es uno de los pasos clave en la síntesis de la feromona de agresión masculina, Oulema melanopus. El enolato de aza se genera por reacción de LDA con pivaldehído, que luego reacciona con un haluro de alquilo para formar un intermedio de Oulema melanopus.
Los enolatos de Aza también pueden formarse con reactivos de Grignard y reaccionar con otros electrófilos blandos, incluidos los receptores de Michael .