Ciclofano - Cyclophane
Un ciclofano es un hidrocarburo que consta de una unidad aromática (típicamente un anillo de benceno ) y una cadena alifática que forma un puente entre dos posiciones no adyacentes del anillo aromático. También se conocen derivados más complejos con múltiples unidades aromáticas y puentes que forman estructuras en forma de jaula . Los ciclofanos están bien estudiados en química orgánica porque adoptan conformaciones químicas inusuales debido a la acumulación de tensión .
Los tipos básicos de ciclofanos son [n] metaciclophanes ( I ) en el esquema 1 , [n] paraciclophanes ( II ) y [n.n '] cyclophanes ( III ). Los prefijos meta y para corresponden a los patrones habituales de sustitución de arenos y n se refiere al número de átomos de carbono que forman el puente.
Estructura
Los paraciclofanos adoptan la conformación de bote que normalmente se observa en los ciclohexanos, pero aún pueden conservar la aromaticidad . Cuanto menor sea el valor de n, mayor será la desviación de la planaridad aromática. En '[6] paracyclophane', que es uno de los ciclofanos más pequeños, pero estables, la cristalografía de rayos X muestra que el átomo de carbono aromático de la cabeza de puente forma un ángulo de 20,5 ° con el plano. Los carbonos de bencilo se desvían otros 20,2 °. La alternancia de la longitud del enlace carbono-carbono ha aumentado de 0 para el benceno a 39 µm .
En reacciones orgánicas [6], el ciclofano tiende a reaccionar como un derivado de dieno y no como un areno. Con bromo da adición 1,4 y con cloro se forma el producto de adición 1,2.
Sin embargo, el espectro de RMN de protones muestra los protones aromáticos y sus posiciones habituales sin blindaje alrededor de 7,2 ppm y los protones de metileno centrales en el puente alifático están incluso severamente blindados a una posición de alrededor de 0,5 ppm, es decir, incluso blindados en comparación con el tetrametilsilano de referencia interno. . Con respecto al criterio de la corriente de anillo diamagnético para la aromaticidad, este ciclofano sigue siendo aromático.
Un campo de investigación particular en ciclofanos implica sondear qué tan cerca pueden llegar los átomos por encima del centro de un núcleo aromático. En los llamados in-ciclofanos con parte de la molécula forzada a apuntar hacia uno de los hidrógeno más cercanos al areno, las distancias determinadas experimentalmente son solo 168 picómetros (pm).
Se registra una distancia de nitrógeno no enlazante al areno de 244 pm para un piridinofano y en el superfano inusual los dos anillos de benceno están separados por solo 262 pm. Otros representantes de este grupo son in-metilciclofanos , in-cetociclofanos e in , in -Bis (hidrosilano).
Métodos sintéticos
[6] paraciclofano se puede sintetizar en el laboratorio por una reacción Bamford-Stevens con espiro cetona 1 en el esquema 3 reordenación en una pirólisis reacción a través del carbeno intermedio 4 . El ciclofano se puede convertir fotoquímicamente en Dewar benceno 6 y viceversa mediante la aplicación de calor. Una ruta separada a la forma Dewar es mediante una reacción de transposición inducida por perclorato de plata catiónico del compuesto de biciclopropenilo 7 .
Los metaparaciclofanos constituyen otra clase de ciclofanos como el [14] [14] metaparaciclofano en el esquema 4 que presenta una reacción de Ramberg-Bäcklund in situ que convierte la sulfona 3 en el alqueno 4 .
Ciclofanos de origen natural
A pesar de llevar tensión, el motivo ciclofano existe en la naturaleza. Un ejemplo de metaciclofano es la cavicularina .
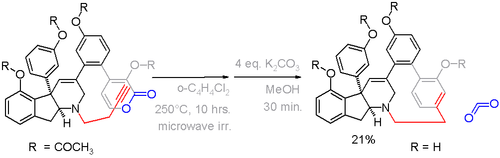
La haouamina A es un paraciclofano que se encuentra en una determinada especie de tunicado . Debido a su aplicación potencial como fármaco contra el cáncer , también está disponible a partir de la síntesis total a través de una reacción de Diels-Alder alquino - pirona en el paso crucial con la expulsión del dióxido de carbono ( esquema 5 ).
En este compuesto, la desviación de la planaridad es de 13 ° para el anillo de benceno y de 17 ° para los carbonos de cabeza de puente. Se desarrolló una estrategia alternativa de formación de ciclofano en el esquema 6 basada en la aromatización del anillo mucho después de la formación del puente.
Se descubrieron dos tipos adicionales de ciclofanos en la naturaleza cuando se aislaron de dos especies de cianobacterias de la familia Nostocacae . Estas dos clases de ciclofanos son [7,7] paraciclophanes y recibieron el nombre de la especie de la que se extrajeron: cylindrocyclophanes de Cylindrospermum lichenforme y nostocyclophanes de Nostoc linckia .
[nn] Paraciclophanes
Un miembro bien explotado de la familia [nn] paracyclophane es [2.2] paracyclophane . Un método para su preparación es por eliminación 1,6-Hofmann :
El [2.2] paraciclofano-1,9-dieno se ha aplicado en ROMP a un poli (p-fenileno vinileno) con enlaces alternos cis-alqueno y trans-alqueno utilizando el catalizador de segunda generación de Grubbs :
La fuerza impulsora para la apertura del anillo y la polimerización es el alivio de tensión. Se cree que la reacción es una polimerización viva debido a la falta de reacciones competitivas.
Debido a que los dos anillos de benceno están muy próximos, este tipo de ciclofano también sirve como conejillo de indias para reacciones de dimerización fotoquímica como se ilustra en este ejemplo:
El producto formado tiene un esqueleto de octaedrano . Cuando el grupo amina se reemplaza por un grupo metileno, no se produce ninguna reacción: la dimerización requiere un solapamiento del enlace pasante entre los electrones aromáticos pi y los electrones sigma en el enlace CN en los reactivos LUMO .
Cicloparafenilenos
[n] Los cicloparafenilenos ([n] CPP) consisten en grupos fenilo cíclicos totalmente unidos en para. Esta clase de compuestos tiene cierto interés como bloque de construcción potencial para nanotubos . Se ha informado de miembros con 18, 12, 10, 9, 8, 7, 6 y 5 fenilenos . Estas moléculas son únicas porque no contienen ningún grupo enlazador alifático que ejerza presión sobre la unidad aromática. En cambio, toda la molécula es una unidad aromática tensa.
Phanes
La generalización de ciclofanos llevó al concepto de fanes en la nomenclatura de la IUPAC.
El nombre de la nomenclatura de fanas sistemática para, por ejemplo, [14] metaciclofano es 1 (1,3) -benzenaciclopentadecafano;
y [2,2 '] paraciclofano (o [2,2] paraciclofano) es 1,4 (1,4) -dibencenaciclohexafano.


![Esquema 2. [6] paraciclophanes](https://upload.wikimedia.org/wikipedia/commons/thumb/d/d9/-6-cyclophanes.png/300px--6-cyclophanes.png)

![Esquema 3. [6] síntesis de paraciclofano](https://upload.wikimedia.org/wikipedia/commons/thumb/3/31/-6-cyclophaneSynthesis.png/500px--6-cyclophaneSynthesis.png)
![Esquema 4. [14] [14] metaparaciclofano](https://upload.wikimedia.org/wikipedia/commons/thumb/9/93/Metaparacyclophane.png/600px-Metaparacyclophane.png)