Conformación de ciclohexano - Cyclohexane conformation
En química orgánica , las conformaciones de ciclohexano son cualquiera de varias formas tridimensionales adoptadas por moléculas de ciclohexano . Debido a que muchos compuestos presentan anillos de seis miembros estructuralmente similares , la estructura y la dinámica del ciclohexano son prototipos importantes de una amplia gama de compuestos.
Los ángulos internos de un hexágono plano regular son 120 °, mientras que el ángulo preferido entre enlaces sucesivos en una cadena de carbono es de aproximadamente 109,5 °, el ángulo tetraédrico ( arco coseno de -1/3). Por lo tanto, el anillo de ciclohexano tiende a asumir conformaciones no planas (alabeadas) , que tienen todos los ángulos más cercanos a 109,5 ° y, por lo tanto, una menor energía de deformación que la forma hexagonal plana.
Si mantenemos los átomos de carbono 1, 2 y 3 estacionarios, con las longitudes de enlace correctas y el ángulo tetraédrico entre los dos enlaces, y luego continuamos agregando los átomos de carbono 4, 5 y 6 con la longitud de enlace correcta y el ángulo tetraédrico, podemos variar los tres ángulos diedros para las secuencias (2, 3, 4), (3, 4, 5) y (4, 5, 6). El siguiente enlace, del átomo 6, también da un ángulo diedro, por lo que tenemos cuatro grados de libertad . Pero ese último enlace tiene que terminar en la posición del átomo 1, que impone tres condiciones en el espacio tridimensional. Esto significa que hay un grado de libertad de conformación, asumiendo que todas las longitudes de los enlaces son iguales y que todos los ángulos entre los enlaces son iguales. Resulta que hay dos conjuntos de soluciones para este problema geométrico. Un conjunto consta de dos configuraciones de silla (una en la que la cadena de átomos 1, 2, 3 y 4 tiene un ángulo diedro positivo y otra en la que es negativo). El otro conjunto es un continuo, un círculo topológico donde la deformación del ángulo es cero, incluidas las conformaciones de bote de torsión y bote . Todas las conformaciones en este continuo tienen un eje de simetría doble que atraviesa el anillo, mientras que las conformaciones de silla no lo tienen (tienen simetría D 3d , con un eje triple que atraviesa el anillo). En este círculo, la energía varía debido a la deformación de Pitzer relacionada con los ángulos diedros. El bote giratorio tiene una energía menor que el bote. Para pasar de la conformación de silla a una conformación de bote giratorio o la otra conformación de silla, los ángulos de unión deben cambiarse, lo que lleva a una conformación de media silla de alta energía . Entonces las estabilidades relativas son: silla> bote giratorio> bote> media silla. Todas las energías conformacionales relativas se muestran a continuación. A temperatura ambiente, la molécula puede moverse fácilmente entre estas conformaciones, pero solo la silla y el bote giratorio pueden aislarse en forma pura, porque los otros no están en mínimos de energía local.
Las conformaciones de bote y bote de torsión, como se dijo, se encuentran a lo largo de un continuo de deformación de ángulo cero. Si hay sustituyentes que permiten distinguir los diferentes átomos de carbono, entonces este continuo es como un círculo con seis conformaciones de bote y seis conformaciones de bote giratorio entre ellos, tres "diestros" y tres "zurdos". (Lo que debería llamarse diestro no es importante). Pero si los átomos de carbono son indistinguibles, como en el propio ciclohexano, el movimiento a lo largo del continuo lleva a la molécula de la forma de bote a un bote giratorio "diestro", y luego de regreso a la misma forma de bote (con una permutación de los átomos de carbono), luego a un bote giratorio "zurdo", y luego de regreso nuevamente al bote aquiral.
Conformadores principales
Las diferentes conformaciones se denominan "conformadores", una combinación de las palabras "conformación" e "isómero".
Conformación de la silla
La conformación de la silla es la conformadora más estable. A 25 ° C, el 99,99% de todas las moléculas en una solución de ciclohexano adoptan esta conformación.
La simetría es D 3d . Todos los centros de carbono son equivalentes. Seis centros de hidrógeno están colocados en posiciones axiales, aproximadamente paralelos al eje C 3 , y seis átomos de hidrógeno están ubicados cerca del ecuador. Estos átomos de H se denominan respectivamente axiales y ecuatoriales.
Cada carbono lleva un hidrógeno "arriba" y otro "abajo". Los enlaces CH en carbonos sucesivos están así escalonados de modo que hay poca tensión de torsión . La geometría de la silla a menudo se conserva cuando los átomos de hidrógeno son reemplazados por halógenos u otros grupos simples .
Si pensamos en un átomo de carbono como un punto con cuatro medios enlaces que sobresalen hacia los vértices de un tetraedro , podemos imaginarlos de pie sobre una superficie con un medio enlace apuntando hacia arriba. Mirando desde arriba, los otros tres parecen ir hacia los vértices de un triángulo equilátero , por lo que los enlaces parecerían tener un ángulo de 120 ° entre ellos. Ahora considere seis de esos átomos que se encuentran en la superficie de modo que sus medios enlaces no verticales se encuentren y formen un hexágono perfecto. Si luego reflejamos que tres de los átomos estén debajo de la superficie, tenemos algo muy similar al ciclohexano de conformación de silla. En este modelo, los seis medios enlaces verticales son exactamente verticales y los extremos de los seis medios enlaces no verticales que sobresalen del anillo están exactamente en el ecuador (es decir, en la superficie). Dado que los enlaces CH son en realidad más largos que la mitad de un enlace CC, los átomos de hidrógeno "ecuatoriales" del ciclohexano de silla estarán en realidad por debajo del ecuador cuando se unan a un carbono que está por encima del ecuador, y viceversa. Esto también es cierto para otros sustituyentes. El ángulo diedro para una serie de cuatro átomos de carbono que giran alrededor del anillo en este modelo alterna exactamente entre + 60 ° y -60 ° (llamado torcido ).
La conformación de la silla no se puede deformar sin cambiar los ángulos o longitudes de unión. Podemos pensar en él como dos cadenas, imágenes especulares una de la otra, que contienen los átomos 1-2-3-4 y 1-6-5-4, con ángulos diedros opuestos. La distancia del átomo 1 al átomo 4 depende del valor absoluto del ángulo diedro. Si estos dos ángulos diedros cambian (aún siendo opuestos uno del otro), no es posible mantener el ángulo de enlace correcto tanto en el carbono 1 como en el carbono 4.
Conformaciones de bote y bote giratorio
Las conformaciones de bote tienen mayor energía que las conformaciones de silla. La interacción entre los dos hidrógenos de asta de bandera , en particular, genera tensión estérica . También existe tensión de torsión entre los enlaces C2-C3 y C5-C6 (el carbono número 1 es uno de los dos en un plano de espejo), que están eclipsados , es decir, estos dos enlaces son paralelos entre sí a través de un plano de espejo. Debido a esta tensión, la configuración del barco es inestable (es decir, no es un mínimo de energía local).
La simetría molecular es C 2v .
Las conformaciones de bote se distorsionan espontáneamente en conformaciones de bote giratorio. Aquí la simetría es D 2 , un grupo de puntos puramente rotacionales con tres ejes dobles. Esta conformación se puede derivar de la conformación de bote aplicando un ligero giro a la molécula para eliminar el eclipse de dos pares de grupos metileno. La conformación de bote giratorio es quiral, existiendo en versiones para diestros y zurdos.
La concentración de la conformación de bote giratorio a temperatura ambiente es inferior al 0,1%, pero a 1073 grados Kelvin puede alcanzar el 30%. El enfriamiento rápido de una muestra de ciclohexano de 1073 K a 40 K se congelará en una gran concentración de conformación de bote giratorio, que luego se convertirá lentamente en la conformación de silla al calentarse.
Dinámica
Silla-silla
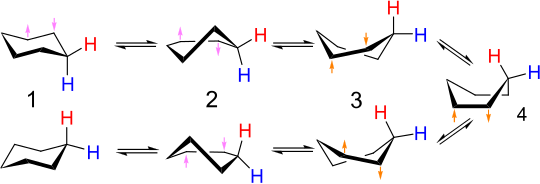
La interconversión de los conformadores de sillas se llama voltereta de anillos o voltereta de silla . Los enlaces carbono-hidrógeno que son axiales en una configuración se vuelven ecuatoriales en la otra y viceversa. A temperatura ambiente, las dos conformaciones de silla se equilibran rápidamente . El espectro de RMN de protones del ciclohexano es un singlete a temperatura ambiente.
En una forma de silla, el ángulo diedro de la cadena de átomos de carbono 1-2-3-4 es positivo mientras que el de la cadena 1-6-5-4 es negativo, pero en la otra forma de silla, la situación es la opuesta. . Por tanto, ambas cadenas tienen que sufrir una inversión del ángulo diedro. Cuando una de estas dos cadenas de cuatro átomos se aplana a un ángulo diedro de cero, tenemos la conformación de media silla , con una energía máxima a lo largo de la ruta de conversión. Cuando el ángulo diedro de esta cadena se vuelve igual (tanto en signo como en magnitud) al de la otra cadena de cuatro átomos, la molécula ha alcanzado el continuo de conformaciones, incluido el bote de torsión y el bote, donde los ángulos de enlace y todas las longitudes pueden estar en sus valores normales y, por tanto, la energía es relativamente baja. Después de eso, la otra cadena de cuatro carbonos tiene que cambiar el signo de su ángulo diedro para lograr la forma de silla objetivo, por lo que nuevamente la molécula tiene que pasar a través de la media silla cuando el ángulo diedro de esta cadena pasa por cero. Cambiar los signos de las dos cadenas secuencialmente de esta manera minimiza el estado de máxima energía a lo largo del camino (en el estado de media silla) - hacer que los ángulos diedros de ambas cadenas de cuatro átomos cambien de signo simultáneamente significaría pasar por una conformación de pares mayor energía debido a la deformación angular en los carbonos 1 y 4.
El mecanismo detallado de la interconversión de presidente a presidente ha sido objeto de mucho estudio y debate. El estado de media silla ( D , en la figura siguiente) es el estado de transición clave en la interconversión entre las conformaciones de silla y bote giratorio. La media silla tiene simetría C 2 . La interconversión entre las dos conformaciones de silla implica la siguiente secuencia: silla → media silla → bote giratorio → media silla ′ → silla ′.
Barco de torsión - barco de torsión
La conformación de bote ( C , abajo) es un estado de transición, lo que permite la interconversión entre dos conformaciones de bote de torsión diferentes. Si bien la conformación de bote no es necesaria para la interconversión entre las dos conformaciones de silla del ciclohexano, a menudo se incluye en el diagrama de coordenadas de reacción utilizado para describir esta interconversión porque su energía es considerablemente menor que la de la media silla, por lo que cualquier molécula con suficiente La energía para pasar de un bote giratorio a una silla también tiene suficiente energía para pasar de un bote giratorio a otro. Por lo tanto, existen múltiples vías por las cuales una molécula de ciclohexano en la conformación de bote giratorio puede lograr nuevamente la conformación de silla.
Derivados sustituidos
En ciclohexano, las dos conformaciones de silla tienen la misma energía. La situación se vuelve más compleja con derivados sustituidos. En el metilciclohexano, los dos conformadores de silla no son isoenergéticos. El grupo metilo prefiere la orientación ecuatorial. La preferencia de un sustituyente hacia la conformación ecuatorial se mide en términos de su valor A , que es la diferencia de energía libre de Gibbs entre las dos conformaciones de silla. Un valor A positivo indica preferencia hacia la posición ecuatorial. La magnitud de los valores de A varía desde casi cero para sustituyentes muy pequeños como el deuterio , hasta aproximadamente 5 kcal / mol (21 kJ / mol) para sustituyentes muy voluminosos como el grupo terc -butilo .
Ciclohexanos disustituidos
Para los ciclohexanos disustituidos en 1,2 y 1,4, una configuración cis conduce a un grupo axial y uno ecuatorial. Estas especies se someten a volteretas de silla rápidas y degeneradas. Para el ciclohexano disustituido en 1,2 y 1,4, una configuración trans , la conformación diaxial se previene eficazmente por su alta tensión estérica. Para los ciclohexanos 1,3-disustituidos, la forma cis es diecuatorial y la conformación invertida sufre una interacción estérica adicional entre los dos grupos axiales. Los ciclohexanos trans -1,3-disustituidos son como cis -1,2- y cis -1,4- y pueden alternar entre las dos formas axiales / ecuatoriales equivalentes.
Cis -1,4-Di- terc -butylcyclohexane tiene un axial terc -butil grupo en la conformación de silla y la conversión a los lugares de conformación de bote torcido ambos grupos en posiciones ecuatoriales más favorables. Como resultado, la conformación de bote de torsión es más estable en 0,47 kJ / mol (0,11 kcal / mol) a 125 K, medido por espectroscopía de RMN .
Análogos heterocíclicos
Los análogos heterocíclicos del ciclohexano son omnipresentes en azúcares, piperidinas, dioxanos, etc. Existen en general que siguen las tendencias observadas para el ciclohexano, es decir, el conformador de silla es más estable. Sin embargo, los equilibrios axiales-ecuatoriales (valores A) se ven fuertemente afectados por la sustitución de un metileno por O o NH. Son ilustrativas las conformaciones de los glucósidos . El 1,2,4,5-tetratiano ((SCH 2 ) 3 ) carece de las interacciones 1,3-diaxiales desfavorables del ciclohexano. En consecuencia, su conformación de bote giratorio está poblada; en la estructura tetrametil correspondiente, 3,3,6,6-tetrametil-1,2,4,5-tetratiano, domina la conformación de bote de torsión.
Antecedentes históricos
En 1890, Hermann Sachse , un asistente de 28 años en Berlín, publicó instrucciones para doblar una hoja de papel para representar dos formas de ciclohexano que él llamó simétrico y asimétrico (lo que ahora llamaríamos silla y bote ). Entendió claramente que estas formas tenían dos posiciones para los átomos de hidrógeno (nuevamente, para usar la terminología moderna, axial y ecuatorial ), que dos sillas probablemente se interconvertirían, e incluso cómo ciertos sustituyentes podrían favorecer una de las formas de la silla ( teoría de Sachse-Mohr ). Debido a que expresó todo esto en lenguaje matemático, pocos químicos de la época entendieron sus argumentos. Tuvo varios intentos de publicar estas ideas, pero ninguno logró capturar la imaginación de los químicos. Su muerte en 1893 a la edad de 31 años hizo que sus ideas se hundieran en la oscuridad. Fue sólo en 1918 que Ernst Mohr , basado en la estructura molecular del diamante que se había resuelto recientemente utilizando la entonces muy nueva técnica de cristalografía de rayos X, pudo argumentar con éxito que la silla de Sachse era el motivo fundamental. Derek Barton y Odd Hassel compartieron el Premio Nobel de 1969 por su trabajo en las conformaciones del ciclohexano y varias otras moléculas.
Referencias
Otras lecturas
- Colin A. Russell, 1975, "Los orígenes del análisis conformacional", en Van 't Hoff-Le Bel Centennial, OB Ramsay, Ed. (Simposio ACS Serie 12), Washington, DC: American Chemical Society, págs. 159-178.
- William Reusch, 2010, "Ring Conformations" y "Substituted Cyclohexane Compounds", en Virtual Textbook of Organic Chemistry, East Lansing, MI, EE. UU .: Michigan State University, ver [2] y [3] , consultado el 20 de junio de 2015.



