La proteína juega un papel importante en la formación de vesículas recubiertas.
La clatrina es una proteína que juega un papel importante en la formación de vesículas recubiertas . La clatrina fue aislada y nombrada por primera vez por Barbara Pearse en 1976. Forma una forma de triskelion compuesta por tres cadenas pesadas de clatrina y tres cadenas ligeras. Cuando las triskelia interactúan, forman una red poliédrica que rodea la vesícula, de ahí el nombre de la proteína, que se deriva del latín clathrum, que significa red. Las proteínas de la cubierta, como la clatrina, se utilizan para construir pequeñas vesículas con el fin de transportar moléculas dentro de las células. La endocitosis y exocitosis de las vesículas permite que las células se comuniquen, transfieran nutrientes, importen receptores de señalización, medien en una respuesta inmune después de muestrear el mundo extracelular y limpien los restos celulares dejados por la inflamación de los tejidos. La vía endocítica puede ser secuestrada por virus y otros patógenos para poder ingresar a la célula durante la infección.
Estructura
El clatrin triskelion está compuesto por tres cadenas pesadas de clatrina que interactúan en sus extremos C-terminales , cada cadena pesada de ~ 190 kDa tiene una cadena ligera de ~ 25 kDa fuertemente unida a ella. Las tres cadenas pesadas proporcionan la columna vertebral estructural de la red de clatrina, y se cree que las tres cadenas ligeras regulan la formación y el desmontaje de una red de clatrina. Hay dos formas de cadenas ligeras de clatrina, denominadas ay b. La principal cadena pesada de clatrina, ubicada en el cromosoma 17 en humanos, se encuentra en todas las células. Un segundo gen de cadena pesada de clatrina, en el cromosoma 22 , se expresa en el músculo.
La cadena pesada de clatrina a menudo se describe como una pierna, con subdominios, que representan el pie (el dominio N-terminal ), seguido del tobillo, la pierna distal, la rodilla, la pierna proximal y los dominios de trimerización. El dominio N-terminal consta de una estructura de hélice β de siete palas. Los otros dominios forman una superhélice de hélices alfa cortas. Esto se determinó originalmente a partir de la estructura del dominio proximal de la pierna que identificó y está compuesto por un módulo estructural más pequeño denominado motivos repetidos de cadena pesada de clatrina. Las cadenas ligeras se unen principalmente a la porción proximal de la rama de la cadena pesada con alguna interacción cerca del dominio de trimerización. La hélice β en el "pie" de la clatrina contiene múltiples sitios de unión para la interacción con otras proteínas.
Una jaula de clatrina con un solo triskelion resaltado en azul. El mapa CryoEM EMD_5119 se renderizó en UCSF Chimera y se resaltó un triskelion de clatrina.
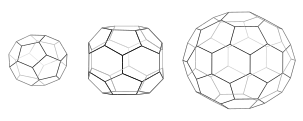
Cada jaula tiene 12 pentágonos. La minicapa (izquierda) tiene 4 hexágonos y simetría tetraédrica como en un triakis tetraedro truncado. El cañón hexagonal (medio) tiene 8 hexágonos y simetría D6. El balón de fútbol (derecha) tiene 20 hexágonos y simetría icosaédrica como en un icosaedro truncado.
Cuando las triskelia se ensamblan en solución, pueden interactuar con suficiente flexibilidad para formar anillos de 6 lados ( hexágonos ) que producen una celosía plana, o anillos de 5 lados ( pentágonos ) que son necesarios para la formación de celosías curvas. Cuando muchos triskelions se conectan, pueden formar una estructura similar a una canasta. La estructura que se muestra está construida con 36 triskelias, una de las cuales se muestra en azul. Otro ensamblaje común es un icosaedro truncado . Para encerrar una vesícula, exactamente 12 pentágonos deben estar presentes en la red.
En una célula, clathrin triskelion en el citoplasma se une a una proteína adaptadora que se ha unido a la membrana, uniendo uno de sus tres pies a la membrana a la vez. La clatrina no se puede unir a la membrana o la carga directamente y, en cambio, utiliza proteínas adaptadoras para hacer esto. Este triskelion se unirá a otros triskelia adheridos a la membrana para formar una celosía redondeada de hexágonos y pentágonos, que recuerda a los paneles de un balón de fútbol, que tira de la membrana en un brote. Al construir diferentes combinaciones de anillos de 5 y 6 lados, se pueden ensamblar vesículas de diferentes tamaños. La jaula de clatrina más pequeña comúnmente fotografiada, llamada minicapa, tiene 12 pentágonos y solo dos hexágonos. Incluso las jaulas más pequeñas con cero hexágonos probablemente no se forman a partir de la proteína nativa, porque las patas de la triskelia son demasiado voluminosas.
Función
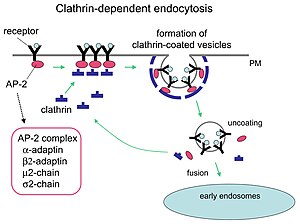
Mecanismo de endocitosis mediada por clatrina.
La clatrina desempeña funciones críticas en la formación de vesículas redondeadas en el citoplasma para el tráfico intracelular. Las vesículas recubiertas de clatrina (CCV) clasifican de forma selectiva la carga en la membrana celular , la red trans- Golgi y los compartimentos endosomales para múltiples vías de tráfico de membranas. Después de que una vesícula brota en el citoplasma, la capa se desmonta rápidamente, lo que permite que la clatrina se recicle mientras la vesícula se transporta a una variedad de ubicaciones.
Las moléculas adaptadoras son responsables del autoensamblaje y el reclutamiento. Dos ejemplos de proteínas adaptadoras son AP180 y epsin . AP180 se utiliza en la formación de vesículas sinápticas. Recluta clatrina a las membranas y también promueve su polimerización . La epsina también recluta clatrina en las membranas y promueve su polimerización, y puede ayudar a deformar la membrana y, por lo tanto, pueden brotar vesículas recubiertas de clatrina. En una célula, un triskelion que flota en el citoplasma se une a una proteína adaptadora, uniendo uno de sus pies a la membrana a la vez. El skelion se unirá a otros adheridos a la membrana para formar una celosía poliédrica, skelion, que tira de la membrana para formar un brote. El skelion no se une directamente a la membrana, sino que se une a las proteínas adaptadoras que reconocen las moléculas en la superficie de la membrana.
La clatrina tiene otra función además del recubrimiento de orgánulos . En las células que no se dividen, la formación de vesículas recubiertas de clatrina se produce de forma continua. La formación de vesículas recubiertas de clatrina se detiene en las células que experimentan mitosis . Durante la mitosis, la clatrina se une al aparato del huso , en complejo con otras dos proteínas: TACC3 y ch-TOG / CKAP5 . La clatrina ayuda a la congresión de los cromosomas al estabilizar las fibras del cinetocoro del huso mitótico . El dominio amino-terminal de la cadena pesada de clatrina y el dominio TACC de TACC3 hacen que la superficie de unión de microtúbulos para TACC3 / ch-TOG / clatrina se una al huso mitótico . La estabilización de las fibras del cinetocoro requiere la estructura trimérica de la clatrina para reticular los microtúbulos.
La endocitosis mediada por clatrina (CME) regula muchos procesos fisiológicos celulares como la internalización de factores de crecimiento y receptores, la entrada de patógenos y la transmisión sináptica. Se cree que los invasores celulares utilizan la vía de los nutrientes para acceder a los mecanismos de replicación de una célula. Ciertas moléculas de señalización abren la vía de los nutrientes. Dos compuestos químicos llamados Pitstop 1 y Pitstop 2, inhibidores selectivos de la clatrina, pueden interferir con la actividad patógena y, por lo tanto, proteger a las células contra la invasión. Estos dos compuestos bloquean selectivamente la asociación del ligando endocítico con el dominio terminal de clatrina in vitro. Sin embargo, se ha cuestionado la especificidad de estos compuestos para bloquear la endocitosis mediada por clatrina.
Ver también
Referencias
Otras lecturas
-
Wakeham DE, Chen CY, Greene B, Hwang PK, Brodsky FM (octubre de 2003). "El autoensamblaje de clatrina implica interacciones débiles coordinadas favorables para la regulación celular" . El diario EMBO . 22 (19): 4980–90. doi : 10.1093 / emboj / cdg511 . PMC 204494 . PMID 14517237 .
-
Ford MG, Mills IG, Peter BJ, Vallis Y, Praefcke GJ, Evans PR, McMahon HT (septiembre de 2002). "Curvatura de fosas recubiertas de clatrina impulsadas por epsin". Naturaleza . 419 (6905): 361–6. Código Bib : 2002Natur.419..361F . doi : 10.1038 / nature01020 . PMID 12353027 . S2CID 4372368 .
-
Fotin A, Cheng Y, Sliz P, Grigorieff N, Harrison SC, Kirchhausen T, Walz T (2004). "Modelo molecular para una celosía de clatrina completa de criomicroscopía electrónica". Naturaleza . 432 (7017): 573–9. Código Bibliográfico : 2004Natur.432..573F . doi : 10.1038 / nature03079 . PMID 15502812 . S2CID 4396282 .
-
Mousavi SA, Malerød L, Berg T, Kjeken R (2004). "Endocitosis dependiente de clatrina" . Revista bioquímica . 377 (Pt 1): 1-16. doi : 10.1042 / BJ20031000 . PMC 1223844 . PMID 14505490 .
-
Smith CJ, Grigorieff N, Pearse BM (septiembre de 1998). "Recubrimientos de clatrina a una resolución de 21 A: un conjunto celular diseñado para reciclar múltiples receptores de membrana" . El diario EMBO . 17 (17): 4943–53. doi : 10.1093 / emboj / 17.17.4943 . PMC 1170823 . PMID 9724631 . (Modelo de ensamblaje Clathrin)
-
Pérez-Gómez J, Moore I (marzo de 2007). "Endocitosis vegetal: es clatrina después de todo" . Biología actual . 17 (6): R217–9. doi : 10.1016 / j.cub.2007.01.045 . PMID 17371763 . S2CID 17680351 . (Revisión sobre la participación de la clatrina en la endocitosis vegetal)
-
Royle SJ, Bright NA, Lagnado L (abril de 2005). "La clatrina es necesaria para la función del huso mitótico" . Naturaleza . 434 (7037): 1152–7. Código Bibliográfico : 2005Natur.434.1152R . doi : 10.1038 / nature03502 . PMC 3492753 . PMID 15858577 .
-
Hood FE, Williams SJ, Burgess SG, Richards MW, Roth D, Straube A, Pfuhl M, Bayliss R, Royle SJ (agosto de 2013). "La coordinación de dominios adyacentes media el ensamblaje de TACC3-ch-TOG-clathrin y la unión del huso mitótico" . J Cell Biol . 202 (3): 463–78. doi : 10.1083 / jcb.201211127 . PMC 3734082 . PMID 23918938 .
-
Knuehl C, Chen CY, Manalo V, Hwang PK, Ota N, Brodsky FM (2006). "Nuevos sitios de unión en clatrina y adaptadores regulan distintos aspectos del ensamblaje de la capa" . Tráfico . 7 (12): 1688–700. doi : 10.1111 / j.1600-0854.2006.00499.x . PMID 17052248 . S2CID 19087208 .
-
Edeling MA, Smith C, Owen D (2006). "Vida de una capa de clatrina: conocimientos de clatrina y estructuras AP". Nature Reviews Biología celular molecular . 7 (1): 32–44. doi : 10.1038 / nrm1786 . PMID 16493411 . S2CID 19393938 .
-
Dutta D, Williamson CD, Cole NB, Donaldson JG (septiembre de 2012). "Pitstop 2 es un potente inhibidor de la endocitosis independiente de la clatrina" . PLOS ONE . 7 (9): e45799. Código bibliográfico : 2012PLoSO ... 745799D . doi : 10.1371 / journal.pone.0045799 . PMC 3448704 . PMID 23029248 .
enlaces externos