Quimotripsina - Chymotrypsin
| Quimotripsina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Estructura cristalográfica del quimotripsinógeno Bos taurus
| |||||||||
| Identificadores | |||||||||
| CE no. | 3.4.21.1 | ||||||||
| No CAS. | 9004-07-3 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| FÁCIL | NiceZyme vista | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | camino metabólico | ||||||||
| PRIAM | perfil | ||||||||
| Estructuras PDB | RCSB PDB PDBe PDBsum | ||||||||
| Ontología de genes | AmiGO / QuickGO | ||||||||
| |||||||||
| Quimotripsina C | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| CE no. | 3.4.21.2 | ||||||||
| No CAS. | 9036-09-3 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Entrada BRENDA | ||||||||
| FÁCIL | NiceZyme vista | ||||||||
| KEGG | Entrada KEGG | ||||||||
| MetaCyc | camino metabólico | ||||||||
| PRIAM | perfil | ||||||||
| Estructuras PDB | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
La quimotripsina ( EC 3.4.21.1 , quimotripsinas A y B, alfa-quimotripsina, avazyme, quimar, quimotest, enzeon, quimar, quimotrasa, alfa-quimiar, alfa-quimotripsina A, alfa-quimotripsina) es un componente enzimático digestivo del jugo pancreático. actuando en el duodeno , donde realiza la proteólisis , la degradación de proteínas y polipéptidos. La quimotripsina escinde preferentemente enlaces amida peptídicos donde la cadena lateral del aminoácido N-terminal al enlace amida escindible (la posición P 1 ) es un aminoácido hidrofóbico grande ( tirosina , triptófano y fenilalanina ). Estos aminoácidos contienen un anillo aromático en su cadena lateral que encaja en un bolsillo hidrofóbico (la posición S 1 ) de la enzima. Se activa en presencia de tripsina . La complementariedad hidrófoba y de forma entre la cadena lateral del sustrato peptídico P 1 y la cavidad de unión de la enzima S 1 explica la especificidad del sustrato de esta enzima. La quimotripsina también hidroliza otros enlaces amida en péptidos a velocidades más lentas, en particular los que contienen leucina y metionina en la posición P 1 .
Estructuralmente, es la estructura arquetípica de su superfamilia , el clan de proteasas PA .
Activación
La quimotripsina se sintetiza en el páncreas mediante la biosíntesis de proteínas como un precursor llamado quimotripsinógeno que es enzimáticamente inactivo. La tripsina activa el quimotripsinógeno al escindir enlaces peptídicos en las posiciones Arg15 - Ile16 y produce π-quimotripsina. A su vez, el grupo amínico (-NH3 + ) del residuo Ile16 interactúa con la cadena lateral de Asp194, produciendo el "agujero oxianiónico" y el "bolsillo S1" hidrofóbico. Además, la quimotripsina induce su propia activación escindiendo en las posiciones 14-15, 146-147 y 148-149, produciendo α-quimotripsina (que es más activa y estable que la π-quimotripsina). La molécula resultante es una molécula de tres polipéptidos interconectados mediante enlaces disulfuro .
Mecanismo de acción y cinética.
In vivo , la quimotripsina es una enzima proteolítica ( serina proteasa ) que actúa en el sistema digestivo de muchos organismos. Facilita la escisión de enlaces peptídicos mediante una reacción de hidrólisis que, a pesar de ser termodinámicamente favorable, se produce de forma extremadamente lenta en ausencia de un catalizador. Los sustratos principales de la quimotripsina son los enlaces peptídicos en los que el aminoácido N-terminal del enlace es un triptófano, tirosina, fenilalanina o leucina. Como muchas proteasas, la quimotripsina también hidroliza los enlaces amida in vitro , una virtud que permitió el uso de análogos de sustrato como N-acetil-L-fenilalanina p-nitrofenilamida para ensayos enzimáticos.
La quimotripsina escinde los enlaces peptídicos atacando el grupo carbonilo no reactivo con un nucleófilo poderoso, el residuo de serina 195 ubicado en el sitio activo de la enzima, que se une brevemente covalentemente al sustrato, formando un intermedio enzima-sustrato. Junto con la histidina 57 y el ácido aspártico 102, este residuo de serina constituye la tríada catalítica del sitio activo.
Estos hallazgos se basan en ensayos de inhibición y el estudio de la cinética de escisión del sustrato mencionado anteriormente, aprovechando el hecho de que el intermedio enzima-sustrato p -nitrofenolato tiene un color amarillo, lo que permite medir su concentración midiendo la absorbancia de luz a 410 nm.
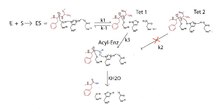
La catálisis de quimotripsina de la hidrólisis de un sustrato proteico (en rojo) se realiza en dos pasos. Primero, la nucleofilicidad de Ser-195 se ve reforzada por la catálisis de base general en la que el protón del grupo hidroxilo de serina se transfiere al resto imidazol de His-57 durante su ataque al carbono carbonilo deficiente en electrones de la proteína-sustrato principal. cadena (k1 paso). Esto ocurre a través de la acción concertada de los residuos de tres aminoácidos en la tríada catalítica. La acumulación de carga negativa en el intermedio tetraédrico resultante se estabiliza en el agujero de oxianión del sitio activo de la enzima, mediante la formación de dos enlaces de hidrógeno con los hidrógenos-amida de la cadena principal adyacentes.
El resto de imidazolio His-57 formado en el paso k1 es un catalizador ácido general para la reacción k-1. Sin embargo, la evidencia de una catálisis ácida general similar de la reacción k2 (Tet2) ha sido controvertida; aparentemente el agua proporciona un protón al grupo saliente de amina.
La descomposición de Tet1 (a través de k3) genera una enzima acil, que se hidroliza con His-57 que actúa como base general (kH2O) en la formación de un intermedio tetraédrico, que se descompone para regenerar la fracción hidroxilo de serina, así como el fragmento de proteína. con el carboxilo terminal recién formado.
Isoenzimas
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ver también
Referencias
Otras lecturas
- Stryer L, Berg JM, Tymoczko JL (2002). Bioquímica . San Francisco: WH Freeman. ISBN 0-7167-4684-0.
- Grisham CM, Reginald H (2005). Bioquímica . Australia: Thomson Brooks / Cole. ISBN 0-534-49033-6.
enlaces externos
- La base de datos en línea MEROPS para peptidasas y sus inhibidores: S01.001
- Quimotripsina en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU .