Alótropos del arsénico - Allotropes of arsenic
El arsénico en estado sólido se puede encontrar como alótropos grises, negros o amarillos . Estas diversas formas presentan diversos motivos estructurales, con el arsénico amarillo que permite la más amplia gama de reactividad. En particular, la reacción de arsénico amarillo con principales elementos del grupo de metales de transición y los resultados en compuestos con amplias motivos estructurales, con la mariposa , sándwich y rejalgar restos de tipo que ofrecen más prominente.
Arsénico gris
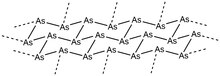
El arsénico gris o arsénico metálico es el alótropo más estable del elemento a temperatura ambiente y, como tal, es su forma más común. Este alótropo de arsénico suave y quebradizo tiene un color gris acero metálico y es un buen conductor. La forma romboédrica de este alótropo es análoga al fósforo alótropo del fósforo negro. En su forma α, los anillos de As 6 en las confirmaciones de silla se condensan en capas empaquetadas que se encuentran perpendiculares al eje c cristalográfico . Dentro de cada capa, las distancias de enlace As-As vecinales son 2,517 Å, mientras que las distancias de enlace As-As de capa a capa son 3,120 Å. La estructura general muestra una geometría octaédrica distorsionada, lo que resulta en las propiedades en gran parte metálicas de este alótropo. Tras la sublimación a 616 ° C, las moléculas de arsénico en fase gaseosa pierden esta disposición de empaquetamiento y forman pequeños grupos de As 4 , As 2 y As, aunque el As 4 es, con mucho, el más abundante en esta fase. Si estos vapores se condensan rápidamente en una superficie fría (<200 K), se produce arsénico amarillo sólido (As 4 ) debido a la falta de energía necesaria para formar la red romboédrica de arsénico gris. Por el contrario, la condensación de vapores de arsénico sobre una superficie caliente genera arsénico negro amorfo. La forma cristalina del arsénico negro también se puede aislar y la forma amorfa se puede templar para volver a la forma de arsénico gris metálico. El arsénico amarillo también se puede devolver al alótropo gris de manera fácil mediante la aplicación de luz o haciendo que la molécula vuelva a la temperatura ambiente.
Reactividad
Se han reportado relativamente pocas reacciones in situ relacionadas con el arsénico gris debido a su baja solubilidad, aunque reacciona en el aire para formar As 2 O 3 gaseoso . Se conocen dos ejemplos de la reactividad del arsénico gris frente a los metales de transición. En estas reacciones, los complejos de ciclopentadienilo de molibdeno, tungsteno y cromo proceden a través de la pérdida de monóxido de carbono para reaccionar con el arsénico gris y formar compuestos de mono, di y triarsénico.
Arsénico negro
El arsénico negro o amorfo (fórmula química As n ) se sintetiza primero mediante la sublimación de arsénico gris seguido de la condensación sobre una superficie calentada. Se cree que esta estructura es el análogo del arsénico del fósforo rojo . La estructura del arsénico negro en su fase cristalina, si bien no se sintetiza en su forma pura, es por extensión análoga al fósforo negro y adquiere una estructura ortorrómbica construida a partir de 6 anillos de As . El arsénico negro hasta ahora se ha sintetizado solo en presencia de impurezas atómicas, como mercurio, fósforo y oxígeno, aunque se encontró una forma pura de arsénico negro en la región de Copiapó de Chile . La exfoliación mecánica del mineral encontrado en las cuevas chilenas, arsenolamprite, reveló una estructura molecular con alta anisotropía en fase y potencial como material semiconductor.
Arsénico amarillo
La rápida condensación de los vapores de arsénico sobre una superficie fría da como resultado la formación de arsénico amarillo (As 4 ), que consta de cuatro átomos de arsénico dispuestos en una geometría tetraédrica análoga al fósforo blanco . Aunque es la única forma soluble de arsénico conocida, el arsénico amarillo es metaestable : a temperatura ambiente o en presencia de luz, la estructura se descompone rápidamente para adoptar la configuración de menor energía del arsénico gris. Por esta razón, se requiere mucho cuidado para mantener el arsénico amarillo en un estado adecuado para la reacción, incluida la rigurosa exclusión de la luz y el mantenimiento de temperaturas por debajo de -80 ° C. El arsénico amarillo es el alótropo más adecuado para los estudios de reactividad, debido a su solubilidad (baja, pero comparativamente grande en relación con el alótropo metálico) y naturaleza molecular. En comparación con su congénere más ligero, el fósforo , la reactividad del arsénico está relativamente poco explorada. Las investigaciones que investigan las reacciones con el arsénico se refieren principalmente a la activación del grupo principal y compuestos de metales de transición; en el caso de los complejos de metales de transición, As 4 ha demostrado una reactividad competente en el bloque d de la tabla periódica.
Reactividad hacia los compuestos del grupo principal
La primera activación de un compuesto del grupo principal por el arsénico amarillo fue reportada en 1992 por West y colaboradores, involucrando la reacción de As 4 con un compuesto de disileno, tetramesitildisileno, para generar una mezcla de compuestos que incluye un motivo estructural de mariposa de átomos de arsénico puente. Notablemente, la mezcla de productos obtenida en esta reacción difiere de la reacción análoga con P 4 que produce el compuesto mariposa solo, destacando que la reactividad del arsénico amarillo y el fósforo blanco no puede considerarse idéntica. El primer compuesto de As 4 organosustituido fue producido por Scheer y colaboradores en 2016 a través de la reacción con el radical Cp PEt . De manera análoga al compuesto de mariposa obtenido por el grupo de West, el producto obtenido en esta reacción presentaba un motivo de puente As 4 que devolvía reversiblemente As 4 y el radical parental en presencia de luz o calor. Esta característica hace que el complejo Cp PEt 2 As 4 sea una molécula de "almacenamiento" especialmente adecuada para el arsénico amarillo, ya que es estable cuando se almacena a temperatura ambiente en la oscuridad, pero puede liberar As 4 en soluciones térmicas o fotoquímicas.
Se ha demostrado que otras reacciones de los compuestos del grupo principal con arsénico amarillo involucran unidades de arsénico con más de cuatro átomos. En reacción con el compuesto de silileno [PhC (N t Bu) 2 SiN (SiMe 3 ) 2 ], se observó una agregación de As 4 para formar un compuesto de jaula de diez átomos de arsénico, incluido un anillo de arsénico de siete miembros en su centro.
Reactividad frente a compuestos de metales de transición
Metales del grupo 4 y 5
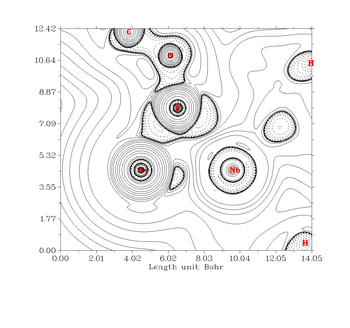
Entre los elementos de metales de transición tempranos (grupo 4 y 5), hasta la fecha se han informado pocos ejemplos de activación por arsénico. Complejos de monóxido de carbono de circonio con derivatizado ciclopentadienilo ligandos, se mostró a reaccionan con arsénico amarillo en xileno hirviendo para liberar CO y se unen el Como 4 resto en η 1: 1 -fashion. En este estudio también se informaron trazas de un dímero de circonio puenteado por una fracción (μ, η 2: 2: 1 -As 5 ), que describió los complejos como posibles reactivos para la transferencia de As 4 . En el grupo 5, la activación del arsénico se ha explorado más ampliamente, y se conocen complejos tanto de niobio como de tantalio. La investigación de la topología de densidad electrónica en un sistema que contiene fósforo / arsénico / niobio demostró la configuración única de enlace η 2 en estos complejos, en la que un doble enlace arsénico-fósforo se une lateralmente a un centro de niobio.
Metales del grupo 6
Las reacciones del arsénico amarillo con los metales de transición del grupo 6 proceden en gran medida a través de la eliminación termolítica del monóxido de carbono en los complejos de cromo y molibdeno carbonilo. Ejemplos notables incluyen la formación de complejos de tres pisos [(Cp R Mo) 2 (μ, η 6 -As 6 )] y [{Cp R Cr} 2 (μ, η 5 -As 5 )] mediante la reacción del correspondiente dímeros de molibdeno y cromo con arsénico amarillo. Estas notables estructuras presentan tres anillos planos dispuestos en paralelo para dar como resultado un grupo de puntos D 5h idealizado para el complejo de cromo. Ambas reacciones requieren condiciones de reacción duras como hirviendo xileno para superar las altas barreras a la activación de As 4 . Por el contrario, la utilización de ligandos más exigentes estéricamente en el centro metálico permitió reacciones en condiciones más suaves con molibdeno y cromo. El catalizador Mo (N ( t Bu) Ar) 3 de Cummins , también conocido por dividir el triple enlace NN en dinitrógeno, reacciona con el arsénico amarillo para formar un resto de arsénico terminal con triple enlace al centro metálico, uno de los únicos compuestos conocidos por contienen un átomo de arsénico terminal. Los complejos con enlaces múltiples metal-metal también permiten un parámetro de activación leve de As 4 . Una especie de cromo-cromo con enlaces quíntuples reportados por Kempe reacciona con el arsénico amarillo para formar un complejo corona en el que los cuatro átomos de arsénico forman una estructura aproximadamente tetraédrica, con cada átomo de cromo unido a tres átomos de arsénico.
Metales del grupo 8 y 9
Los metales de los grupos 8 y 9 cuentan con la biblioteca más extensa de reactividad con arsénico amarillo documentada en la literatura científica, con especial énfasis en las reacciones de los complejos de hierro y cobalto con As 4 . Al igual que los complejos sándwich de cromo y molibdeno, (Cp R Fe (CO) 2 ] 2 complejos de hierro reaccionan con el arsénico amarillo para producir productos bimetálicos análogos con geometría de "tres pisos". Estos informes también detallan el aislamiento de un intermedio clave, pentaarsaferroceno ([Cp R Fe (μ 5 -As 5 )]). Este intermedio, isolobal a ferroceno, reemplaza uno de los ligandos ciclopentadienilo con un ligando cíclico As 5 que presenta longitudes de enlace As-As de 2.312 Å (en línea con deslocalizado Dobles enlaces As-As). Esta reactividad de "formación de sándwich" se puede ajustar significativamente mediante la introducción de ligandos más voluminosos. La modificación de los grupos ciclopentadienilo con derivados mucho más voluminosos produce un conjunto de productos muy diferente. Primero, un complejo de mariposa con una unidad As 4 central La irradiación con luz conduce a una mayor eliminación de CO y a la formación de un complejo de mariposa con puente, que luego se reorganiza en un complejo único con un resto central de As 8. Este ligando, formalmente tetraaniónico, forma s un anillo de ocho miembros que une cuatro átomos de hierro en total.
Gran parte de la misma reactividad, incluida la formación de compuestos de mariposa y sándwich, se ha descrito para los complejos de cobalto en presencia de arsénico amarillo. Más allá de estos compuestos, la historia de la reactividad del cobalto y el arsénico amarillo se remonta a 1978, cuando Sacconi y sus colaboradores informaron de la reacción del tetrafluoroborato de cobalto y el arsénico amarillo en presencia de trifos . El complejo resultante cuenta con una cíclico Como 3 resto puente dos centros de cobalto, de los cuales el primero se asignan formalmente como un sistema 3π-electrón. La reacción del dímero [Cp * Co (CO)] 2 con arsénico amarillo fue mostrada por Scherer et al. para producir una amplia variedad de productos aislables, con una mezcla de restos de arsénico enlazantes que incluyen complejos tipo ciclobutano y tipo mariposa. También se conocen reacciones análogas con complejos de rodio.
Metales del grupo 10 y 11
Entre los elementos del grupo 10 y 11, el níquel y el cobre ocupan un lugar destacado en las reacciones bibliográficas con el arsénico amarillo. Sales de tetrafluoroborato de níquel reaccionan de forma análoga a complejos de cobalto en presencia de triphos para formar una estructura sándwich con una cíclico central, como 3 resto. Al igual que el hierro, la reacción de los complejos de ciclopentadienil carbonilo de níquel con As 4 produce una variedad de productos bimetálicos y multimetálicos dependiendo del tamaño de los ligandos presentes, aunque la naturaleza y la estructura geométrica de estos compuestos difieren de las observadas con el hierro. Estos incluyen trímeros con restos As 4 y As 5 puente en disposiciones estructurales de cubano cuando se emplean ligandos Cp más pequeños, y complejos de prismas hexagonales distorsionados con dos fragmentos de níquel y cuatro átomos de arsénico cuando se introducen grupos Cp más voluminosos.
La reacción del complejo de cobre [L 2 Cu (NCMe)] (L 2 = [{N (C 6 H 3 i Pr 2 -2,6) C (Me)} 2 CH]) con arsénico amarillo produce el As 4 -dímero de puente [{L 2 Cu} 2 - (μ, η 2: 2 -As 4 )]. Se consideró que el resto de arsénico de cuatro átomos en este complejo era arsénico amarillo "intacto" mediante el uso de cálculos de la teoría funcional de densidad que determina el cambio en los puntos críticos de enlace entre las moléculas de arsénico libre y unida. Específicamente, solo se observó un pequeño cambio en los puntos críticos de enlace entre los átomos de arsénico involucrados en la unión al cobre; los puntos críticos de unión restantes eran muy similares al arsénico amarillo libre.
Ver también
Referencias
- ^ a b c d e f g Seidl, Michael; Balázs, Gábor; Scheer, Manfred (22 de marzo de 2019). "La química del arsénico amarillo" . Revisiones químicas . 119 (14): 8406–8434. doi : 10.1021 / acs.chemrev.8b00713 . ISSN 0009-2665 .
- ^ "Alótropo: arsénico" . dirkncl.github.io . Consultado el 1 de noviembre de 2020 .
- ↑ a b Ziegler, ML (1988). "Darstellung und Charakterisierung von Tetrahedranen des Typs Cp3M3As (CO) 6 und Cp2M2As2 (CO) 4 (Cp = C5H5, M = Mo, W) sowie von Derivaten dieser Tetrahedrane" . Chemische Berichte . 121 (1). doi : 10.1002 / cber.v121: 1 . ISSN 0009-2940 .
- ^ a b Goh, Lai Yoong .; Wong, Richard CS; Yip, Wai Hing .; Mak, Thomas CW (1991). "Síntesis y termólisis de complejos de di- y triarsénico de cromo. Estructura cristalina de [CpCr (CO) 2] 2As2" . Organometálicos . 10 (4): 875–879. doi : 10.1021 / om00050a015 . ISSN 0276-7333 .
- ^ Chen, Yabin; Chen, Chaoyu; Kealhofer, Robert; Liu, Huili; Yuan, Zhiquan; Jiang, Lili; Suh, Joonki; Park, Joonsuk; Ko, Changhyun; Choe, Hwan Sung; Ávila, José (2018). "Arsénico negro: un semiconductor en capas con anisotropía extrema en el plano" . Materiales avanzados . 30 (30): 1800754. doi : 10.1002 / adma.201800754 . ISSN 1521-4095 .
- ^ Tan, Robin P .; Comerlato, Nadia M .; Powell, Douglas R .; West, Robert (1992). "La reacción de tetramesityldisilene con As4: síntesis y estructura de un nuevo sistema de anillo tricíclico de silicio-arsénico" . Angewandte Chemie International Edition en inglés . 31 (9): 1217-1218. doi : 10.1002 / anie.199212171 . ISSN 1521-3773 .
- ^ a b Heinl, Sebastián; Balázs, Gábor; Stauber, Andreas; Scheer, Manfred (15 de noviembre de 2016). "CpPEt2As4-An As4Butterfly compuesto orgánico-sustituido" . Angewandte Chemie International Edition . 55 (50): 15524-15527. doi : 10.1002 / anie.201608478 . ISSN 1433-7851 .
- ↑ a b Seitz, Andreas E .; Eckhardt, Maria; Sen, Sakya S .; Erlebach, Andreas; Peresypkina, Eugenia V .; Roesky, Herbert W .; Sierka, Marek; Scheer, Manfred (2017). "Diferente reactividad de As4 hacia disilenos y sililenos" . Angewandte Chemie International Edition . 56 (23): 6655–6659. doi : 10.1002 / anie.201701740 . ISSN 1521-3773 .
- ^ a b Spinney, Heather A .; Piro, Nicholas A .; Cummins, Christopher C. (11 de noviembre de 2009). "Reactividad de triple enlace de un intermedio del complejo AsP: síntesis derivada del arsénico molecular, As4" . Revista de la Sociedad Química Estadounidense . 131 (44): 16233–16243. doi : 10.1021 / ja906550h . hdl : 1721,1 / 65118 . ISSN 0002-7863 .
- ^ Schmidt, Monika; Seitz, Andreas E .; Eckhardt, Maria; Balázs, Gábor; Peresypkina, Eugenia V .; Virovets, Alexander V .; Riedlberger, Felix; Bodensteiner, Michael; Zolnhofer, Eva M .; Meyer, Karsten; Scheer, Manfred (27 de septiembre de 2017). "Transferencia de reactivo para la unión de isómeros de complejos de hierro" . Revista de la Sociedad Química Estadounidense . 139 (40): 13981–13984. doi : 10.1021 / jacs.7b07354 . ISSN 0002-7863 .
- ↑ Scherer, Otto J .; Vondung, Jürgen; Wolmershäuser, Gotthelf (1989). "Tetrafosfaciclobutadieno como ligando complejo" . Angewandte Chemie International Edition en inglés . 28 (10): 1355-1357. doi : 10.1002 / anie.198913551 . ISSN 1521-3773 .
- ↑ Scherer, Otto J .; Wiedemann, Wolfgang; Wolmershäuser, Gotthelf (1990). "Chrom-Komplexe mitcyclo-Asx-Liganden" . Chemische Berichte (en alemán). 123 (1): 3–6. doi : 10.1002 / cber.19901230102 .
- ^ Scherer, DO (1989). "Un complejo sándwich de tres pisos con una capa media cíclica de Pentaarsane sin tensión". J. Organomet. Chem . 361 : C11-C14.
- ^ Scherer, DO (1989). "Un complejo sándwich de tres pisos con una capa media cíclica de Pentaarsane sin tensión". J. Organomet. Chem . 361 : C11-C14.
- ↑ Scherer, Otto J .; Wiedemann, Wolfgang; Wolmershäuser, Gotthelf (1990). "Chrom-Komplexe mitcyclo-Asx-Liganden" . Chemische Berichte (en alemán). 123 (1): 3–6. doi : 10.1002 / cber.19901230102 .
- ^ Curley, John J .; Piro, Nicholas A .; Cummins, Christopher C. (19 de octubre de 2009). "Un complejo de arseniuro de molibdeno terminal sintetizado a partir de arsénico amarillo" . Química inorgánica . 48 (20): 9599–9601. doi : 10.1021 / ic9016068 . hdl : 1721,1 / 64721 . ISSN 0020-1669 .
- ^ Schwarzmaier, Christoph; Noor, Awal; Glatz, Germund; Zabel, Manfred; Timoshkin, Alexey Y .; Cossairt, Brandi M .; Cummins, Christopher C .; Kempe, Rhett; Scheer, Manfred (2011). "Formación de unidades ciclo-E42− (E4 = P4, As4, AsP3) por un complejo con un enlace quíntuple CrCr" . Angewandte Chemie International Edition . 50 (32): 7283–7286. doi : 10.1002 / anie.201102361 . ISSN 1521-3773 .
- ↑ a b Schwarzmaier, Christoph; Timoshkin, Alexey Y .; Balázs, Gábor; Scheer, Manfred (2014). "Formación selectiva y reactividad inusual de complejos de tetraarsabiciclo [1.1.0] butano" . Angewandte Chemie International Edition . 53 (34): 9077–9081. doi : 10.1002 / anie.201404653 . ISSN 1521-3773 .
- ^ Scherer, DO; Blath, Christof; Wolmershäuser, Gotthelf (1 de mayo de 1990). "Ferroceno mit einem Pentaarsacyclopentadienyl-Liganden" . Revista de Química Organometálica (en alemán). 387 (2): C21 – C24. doi : 10.1016 / 0022-328X (90) 80029-Y . ISSN 0022-328X .
- ↑ a b Di Vaira, Massimo; Midollini, Stefano; Sacconi, Luigi (1979). "ciclo-trifósforo y ciclo-triarsénico como ligandos en complejos de" doble sándwich "de cobalto y níquel" . Revista de la Sociedad Química Estadounidense . 101 (7): 1757-1763. doi : 10.1021 / ja00501a019 . ISSN 0002-7863 .
- ↑ Scherer, Otto J .; Pfeiffer, Karl; Wolmershäuser, Gotthelf (1 de noviembre de 1992). "Cobaltkomplexe mit As4-Liganden" . Chemische Berichte . 125 (11): 2367–2372. doi : 10.1002 / cber.19921251107 . ISSN 0009-2940 .
- ↑ Scherer, Otto J .; Höbel, Bernd; Wolmershäuser, Gotthelf (1992). "Zweifach kantengeöffnetes P10-Dihydrofulvalen als 16-Elektronendonorligand" . Angewandte Chemie . 104 (8): 1042–1043. doi : 10.1002 / ange.19921040811 . ISSN 0044-8249 .
- ^ Spitzer, Fabián; Sierka, Marek; Latronico, Mario; Mastrorilli, Piero; Virovets, Alexander V .; Scheer, Manfred (2015). "Fijación y liberación de tetraedros E4 intactos (E = P, As)" . Angewandte Chemie International Edition . 54 (14): 4392–4396. doi : 10.1002 / anie.201411451 . ISSN 1521-3773 .