2-piridona - 2-Pyridone
|
|
|||
|
|
|||
| Nombres | |||
|---|---|---|---|
|
Nombre IUPAC preferido
Piridin-2 (1 H ) -ona |
|||
| Otros nombres
2 (1 H ) -Piridinona
2 (1 H ) -Piridona 1 H -Piridin-2-ona 2-Piridona 1,2-Dihidro-2-oxopiridina 1 H -2-Piridona 2-Oxopiridona 2-Piridinol 2-Hidroxipiridina |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| CHEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Tarjeta de información ECHA |
100.005.019 |
||
| Número CE | |||
| KEGG | |||
|
PubChem CID
|
|||
| Número RTECS | |||
| UNII | |||
|
Tablero CompTox ( EPA )
|
|||
|
|||
|
|||
| Propiedades | |||
| C 5 H 5 N O | |||
| Masa molar | 95,101 g · mol −1 | ||
| Apariencia | Sólido cristalino incoloro | ||
| Densidad | 1,39 g / cm³ | ||
| Punto de fusion | 107,8 ° C (226,0 ° F; 380,9 K) | ||
| Punto de ebullición | 280 ° C (536 ° F; 553 K) descomp. | ||
| Solubilidad en otros disolventes. | Soluble en agua , metanol , acetona. |
||
| Acidez (p K a ) | 11,65 | ||
| UV-vis (λ máx. ) | 293 nm (ε 5900, solución de H 2 O) | ||
| Estructura | |||
| Ortorrómbico | |||
| planar | |||
| 4.26 D | |||
| Riesgos | |||
| Principales peligros | irritante | ||
| Ficha de datos de seguridad | Ver: página de datos | ||
| Pictogramas GHS |
 
|
||
| Palabra de señal GHS | Peligro | ||
| H301 , H315 , H319 , H335 | |||
| P261 , P264 , P270 , P271 , P280 , P301 + 310 , P302 + 352 , P304 + 340 , P305 + 351 + 338 , P312 , P321 , P330 , P332 + 313 , P337 + 313 , P362 , P403 + 233 , P405 , P501 | |||
| NFPA 704 (diamante de fuego) | |||
| punto de inflamabilidad | 210 ° C (410 ° F; 483 K) | ||
| Compuestos relacionados | |||
|
Otros aniones
|
2-piridinolato | ||
|
Otros cationes
|
Iones 2-hidroxipiridinio | ||
|
Grupos funcionales relacionados
|
alcohol , lactama , lactima , piridina , cetona |
||
|
Compuestos relacionados
|
piridina , timina , citosina , uracilo , benceno |
||
| Página de datos complementarios | |||
|
Índice de refracción ( n ), constante dieléctrica (ε r ), etc. |
|||
|
Datos termodinámicos |
Comportamiento de fase sólido-líquido-gas |
||
| UV , IR , RMN , MS | |||
|
Salvo que se indique lo contrario, los datos se proporcionan para materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referencias de Infobox | |||
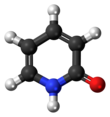
La 2-piridona es un compuesto orgánico con la fórmula C
5H
4NH (O) . Es un sólido incoloro. Es bien conocido por formar dímeros unidos por enlaces de hidrógeno y también es un caso clásico de un compuesto que existe como tautómeros .
Tautomería
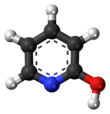
El segundo tautómero es 2-hidroxipiridina. Esta lactama lactima tautomería también puede ser exhibido en muchos compuestos relacionados.
Tautomería en estado sólido
El grupo amida puede participar en el enlace de hidrógeno con otras especies que contienen nitrógeno y oxígeno .
La forma de estado sólido predominante es 2-piridona. Esto ha sido confirmado por cristalografía de rayos X que muestra que el hidrógeno en estado sólido está más cerca del nitrógeno que del oxígeno (debido a la baja densidad de electrones en el hidrógeno, el posicionamiento exacto es difícil), y la espectroscopia IR , que muestra que la frecuencia longitudinal C = O está presente mientras que las frecuencias OH están ausentes.
Tautomería en solución
La determinación de cuál de las dos formas tautoméricas está presente en solución ha sido objeto de muchas publicaciones. La diferencia de energía parece ser muy pequeña y depende de la polaridad del solvente . Los disolventes no polares favorecen la formación de 2-hidroxipiridina mientras que los disolventes polares como los alcoholes y el agua favorecen la formación de 2-piridona.
La diferencia de energía para los dos tautómeros en la fase gaseosa se midió mediante espectroscopía IR y fue de 2,43 a 3,3 kJ / mol para el estado sólido y 8,95 kJ / mol y 8,83 kJ / mol para el estado líquido.
Mecanismo de tautomerización A
La tautomerización molecular única tiene un estado de transición suprafacial 1-3 prohibido y, por lo tanto, tiene una barrera de alta energía para esta tautomerización , que se calculó con métodos teóricos en 125 o 210 kJ / mol. La tautomerización directa no se favorece energéticamente. Existen otros posibles mecanismos para esta tautomerización.
Dimerización
La 2-piridona y la 2-hidroxipiridina pueden formar dímeros con dos enlaces de hidrógeno.
Agregación en estado sólido
En estado sólido, la forma dimérica no está presente; las 2-piridonas forman una estructura helicoidal sobre enlaces de hidrógeno. Algunas 2-piridonas sustituidas forman el dímero en estado sólido, por ejemplo, la 5-metil-3-carbonitrilo-2-piridona. La determinación de todas estas estructuras hecho por la cristalografía de rayos X . En estado sólido, el hidrógeno se encuentra más cerca del oxígeno, por lo que podría considerarse correcto llamar a los cristales incoloros del matraz 2-piridona.
Agregación en solución
En solución está presente la forma dimérica; la relación de dimerización depende en gran medida de la polaridad del disolvente. Los disolventes polares y próticos interactúan con los enlaces de hidrógeno y se forma más monómero . Los efectos hidrófobos en disolventes no polares conducen a un predominio del dímero. La proporción de las formas tautoméricas también depende del disolvente. Todos los posibles tautómeros y dímeros pueden estar presentes y formar un equilibrio, y la medición exacta de todas las constantes de equilibrio en el sistema es extremadamente difícil.
( La espectroscopia de RMN es un método lento, la espectroscopia de IR de alta resolución en solvente es difícil, la amplia absorción en la espectroscopia de UV hace que sea difícil discriminar 3 y más moléculas muy similares ).
Algunas publicaciones solo se enfocan en uno de los dos patrones posibles y descuidan la influencia del otro. Por ejemplo, el cálculo de la diferencia de energía de los dos tautómeros en una solución no polar conducirá a un resultado incorrecto si una gran cantidad de la sustancia está en el lado del dímero en equilibrio.
Mecanismo de tautomerización B
La tautomerización directa no se favorece energéticamente, pero una dimerización seguida de una doble transferencia de protones y la disociación del dímero es una ruta autocatalítica de un tautómero al otro. Los disolventes próticos también median en la transferencia de protones durante la tautomerización.
Síntesis
La 2-pirona puede obtenerse mediante una reacción de ciclación y convertirse en 2-piridona mediante una reacción de intercambio con amoníaco :
La piridina forma un N -óxido con algunos agentes oxidantes como el peróxido de hidrógeno . Este piridina- N -óxido sufre una reacción de transposición a 2-piridona en anhídrido acético :
En la condensación de Guareschi-Thorpe, la cianoacetamida reacciona con una 1,3-dicetona para dar una 2-piridona . La reacción lleva el nombre de Icilio Guareschi y Jocelyn Field Thorpe .
Propiedades químicas
Actividad catalítica
La 2-piridona cataliza una variedad de reacciones dependientes de protones, por ejemplo, la aminólisis de ésteres. En algunos casos, se utiliza 2-piridona fundida como disolvente. 2-piridona tiene un gran efecto sobre la reacción de los ésteres activados con aminas en no polar disolvente , que se atribuye a su tautomerización y utilidad como un receptor ditópico. El interés actual se centra en la transferencia de protones a partir de la 2-piridona y su tautómero, utilizando métodos de marcado de isótopos , cinética y química cuántica para determinar el paso que determina la velocidad en el mecanismo de reacción.
Química de coordinación
La 2-piridona y algunos derivados sirven como ligandos en la química de coordinación, generalmente como un ligando de puente 1,3 similar al carboxilato .
En naturaleza
La 2-piridona no se encuentra en la naturaleza, pero se ha aislado un derivado como cofactor en ciertas hidrogenasas .
Comportamiento ambiental
La 2-piridona se degrada rápidamente por los microorganismos en el medio ambiente del suelo, con una vida media de menos de una semana. Varios investigadores han aislado organismos capaces de crecer en 2-piridona como única fuente de carbono, nitrógeno y energía. El degradador de 2-piridona más estudiado es la bacteria gram positiva Arthrobacter crystallopoietes , un miembro del filo Actinobacteria que incluye numerosos organismos relacionados que han demostrado degradar la piridina o una o más piridinas sustituidas con alquilo, carboxilo o hidroxilo. La degradación de la 2-piridona se inicia comúnmente por el ataque de la monooxigenasa, lo que da como resultado un diol, como la 2,5-dihidroxipiridina, que se metaboliza a través de la vía del maleamato. La fisión del anillo se produce mediante la acción de la 2,5-dihidroxipiridina monooxigenasa, que también participa en el metabolismo del ácido nicotínico a través de la vía del maleamato. En el caso de los cristalopoyetos de Arthrobacter , al menos parte de la ruta de degradación se transmite por plásmidos. Los piridinioles se someten a una transformación química en solución para formar pigmentos de colores intensos. Se han observado pigmentos similares en la degradación de las quinolinas , también debido a la transformación de metabolitos; sin embargo, los pigmentos amarillos que a menudo se informan en la degradación de muchos disolventes de piridina, como la piridina o la picolina sin sustituir , generalmente son el resultado de la sobreproducción de riboflavina en presencia de estos disolventes. En términos generales, la degradación de piridonas, dihidroxipiridinas y ácidos piridincarboxílicos está mediada comúnmente por oxigenasas, mientras que la degradación de disolventes de piridina a menudo no lo es, y en algunos casos puede implicar una etapa reductora inicial.
Ver también
- 2-Piridona (página de datos)
- 2-pirona
- 4-piridona
- La 5-metil-2-piridona se usa para fabricar pirfenidona .
Referencias
Referencias generales
-
Engdahl K .; Ahlberg P. (1977). Revista de investigación química : 340–341. Falta o vacío
|title=( ayuda ) - Bensaude O, Chevrier M, Dubois J (1978). "Equilibrio tautomérico de lactim-lactama de 2-hidroxipiridinas. 1. Mecanismo de unión, dimerización e interconversión catiónica en disolventes apróticos. Un estudio cinético espectroscópico y de salto de temperatura". Mermelada. Chem. Soc. 100 (22): 7055–7066. doi : 10.1021 / ja00490a046 .
- Bensaude O, Dreyfus G, Dodin G, Dubois J (1977). "Transferencia de protones no disociativa intramolecular en soluciones acuosas de heterociclos tautoméricos: un estudio cinético de salto de temperatura". Mermelada. Chem. Soc. 99 (13): 4438–4446. doi : 10.1021 / ja00455a037 .
- Bensaude O, Chevrier M, Dubois J (1978). "Influencia de la hidratación sobre el equilibrio tautomérico". Tetrahedron Lett. 19 (25): 2221–2224. doi : 10.1016 / S0040-4039 (01) 86850-7 .
- Hammes GG, Park AC (1969). "Estudios cinéticos y termodinámicos del enlace de hidrógeno". Mermelada. Chem. Soc. 91 (4): 956–961. doi : 10.1021 / ja01032a028 .
- Hammes GG, Spivey HO (1966). "Un estudio cinético de la dimerización de enlaces de hidrógeno de 2-piridona". Mermelada. Chem. Soc. 88 (8): 1621–1625. doi : 10.1021 / ja00960a006 . PMID 5942979 .
- Beak P, Covington JB, Smith SG (1976). "Estudios estructurales de sistemas tautoméricos: la importancia de la asociación de 2-hidroxipiridina-2-piridona y 2-mercaptopiridina-2-tiopiridona". Mermelada. Chem. Soc. 98 (25): 8284–8286. doi : 10.1021 / ja00441a079 .
- Beak P, Covington JB, White JM (1980). "Modelo cuantitativo de los efectos del disolvente en los equilibrios de hidroxipiridina-piridona y mercaptopiridina-tiopiridona: correlación con el campo de reacción y los efectos de los enlaces de hidrógeno". J. Org. Chem. 45 (8): 1347-1353. doi : 10.1021 / jo01296a001 .
- Beak P, Covington JB, Smith SG, White JM, Zeigler JM (1980). "Desplazamiento de los equilibrios protoméricos por autoasociación: pares de isómeros hidroxipiridina-piridona y mercaptopiridina-tiopiridona". J. Org. Chem. 45 (8): 1354-1362. doi : 10.1021 / jo01296a002 .